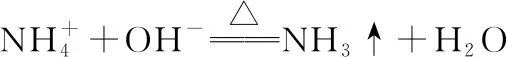
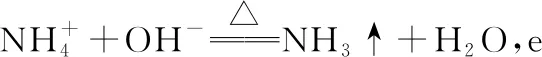把握考向,突破考点——氮气及其含氮化合物考查类型赏析
安徽
从历年的试题分析来看,氮及其化合物是元素化合物中的高频考点,高考中绝大部分地区试题都是以选择题、化学工艺流程题、实验制备题、化学反应原理综合题等形式加以出现,考查学生对基础知识的掌握情况和迁移应用能力以及提取信息处理信息的能力。在教学实践中,我发现绝大部分学生在解决这类习题时经常会出现错误,于是现将关于这种类型的习题进行系统总结,供老师和学生在复习时参考,以飨读者。
一、结合阿伏加德罗常数进行考查
阿伏加德罗常数,是中学化学中常考的一个重要知识点,也是历年高考必考选择题考查的重点之一,设置的4个选项涉及范围广,延伸多,考查学生的综合能力。
【例1】阿伏加德罗常数的值为NA,下列说法正确的是
( )
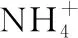
B.(2016·全国卷Ⅰ)1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.(2017·全国卷Ⅱ)标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
【答案】D

二、结合氧化还原反应考查
氧化还原反应中氧化性、还原性、氧化剂、还原剂、基本规律和应用以及利用得失电子守恒进行相关计算仍然是新课标高考中的基础内容,难度虽然不大,但是能和元素化合物知识相串联,从多维度考查学生的基本能力和素养。
【例2】(2016·全国卷Ⅱ·26·节选)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料:回答下列问题:
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是________。联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1 kg的联氨可除去水中溶解的O2________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是________。
【答案】(5)固体逐渐变黑,并有气泡产生 1 N2H4的用量少,不产生其他杂质(还原产物为N2和H2O,而Na2SO3产生Na2SO4)

三、结合氨气的制备与催化氧化、氮氧化物溶于水或碱等相关性质进行考查
氨气的制备、含氮化合物之间的相互转化、氮氧化物溶于水等一直是元素化合物知识中的重点,有时候高考题结合这些考点考查相关的计算。
【例3】(2016·上海卷)称取(NH4)2SO4和NH4HSO4混合物样品7.24 g,加入含0.1 mol NaOH的溶液,完全反应,生成NH31 792 mL(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为
( )
A.1∶1 B.1∶2 C.1.87∶1 D.3.65∶1
【答案】C
【解析】利用极值法分析,可知0.1 mol氢氧化钠不足,故先将NH4HSO4反应完,再反应(NH4)2SO4,因共生成0.08 mol NH3,故与H+反应的氢氧化钠为0.02 mol,则NH4HSO4为0.02 mol,(NH4)2SO4质量为7.24 g-115 g/mol×0.02 mol=4.94 g,(NH4)2SO4的物质的量为4.94 g÷132 g/mol=0.037 4 mol。因此(NH4)2SO4与NH4HSO4物质的量之比为1.87∶1。
四、结合金属与硝酸反应进行考查
金属与硝酸反应是中学化学中比较复杂的氧化还原反应,反应中反应条件、硝酸浓度等都对产物有影响,涉及金属与硝酸反应的计算则更为复杂。一般常用的方法有电子守恒法、原子守恒法、极端假设法等。
【例4】(2013·四川卷·7)1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1 120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀,下列说法不正确的是
( )
A.该合金中铜与镁的物质的量之比是2∶1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
【答案】D
【解析】设铜镁的物质的量分别为x、y,则①64x+24y=1.52,②64x+24y+34x+34y=2.54,解得x=0.02 mol,y=0.01 mol,设N2O4、NO2的物质的量分别为a、b,则根据得失电子数相等:2x+2y=2a+b,a+b=0.05,则a=0.01 mol,b=0.04 mol,A、C正确;c(HNO3)=(1 000×1.4×63%/63) mol·L-1=14.0 mol·L-1,B正确;沉淀达最大时,溶液中只有硝酸钠,根据原子守恒:n(NaOH)=n(HNO3)-(2a+b)=0.7 mol-0.06 mol=0.64 mol,氢氧化钠溶液体积为640 mL,D错误。
五、结合物质结构、元素周期律综合考查
该类试题与元素化合物的知识结合的比较多,元素推断只是一种载体,主要通过必修2和选修3的知识进行解答。一般考查常见单质及其化合物的性质、典型用途、制备,涉及氮的核外电子排布、第一电离能、电负性、杂化的类型、分子结构、等电子体、氢键、配位键、键角、晶胞密度的计算等。
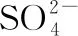

(3)与O3分子互为等电子体的一种阴离子为________(填化学式)。
(4)N2分子中σ键与π键的数目比n(σ)∶n(π)=________。
(5)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。

[Fe(NO)(H2O)5]2+结构示意图



六、结合电解质溶液氨水、铵盐水溶液综合考查
电解质溶液是每年高考考查的重点和热点,一般都以选择题或者在综合题中以填空形式出现,主要就是结合氨水、铵盐水溶液,酸碱中和滴定等综合考查溶液中离子浓度的大小比较、电离平衡常数、水解平衡常数等。
【例6】(贵州省遵义航天高级中学2019届高三上学期第五次模拟)25℃时,用0.10 mol·L-1的氨水滴定10.00 mLamol·L-1的盐酸,混合溶液的pH与氨水的体积(V)的关系如图所示。已知N点溶液中存在:c(H+)=c(OH-)+c(NH3·H2O),下列说法不正确的是
( )
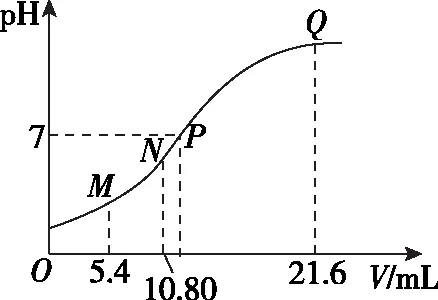
A.图上四点离子种类相同
B.a=0.1
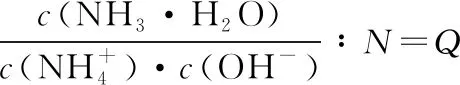
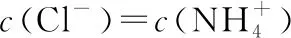
【答案】B

七、结合电化学中燃料电池综合考查
电化学是每年高考考查的重点和热点,主要就是结合最新科技(燃料电池)综合考查电极反应式的书写、化学计算、正负极的判断等。一般都以选择题或者在综合题中以填空形式出现。
【例7】(黑龙江省青冈县一中2018届高二下学期期末)韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视。一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示。下列说法正确的是
( )
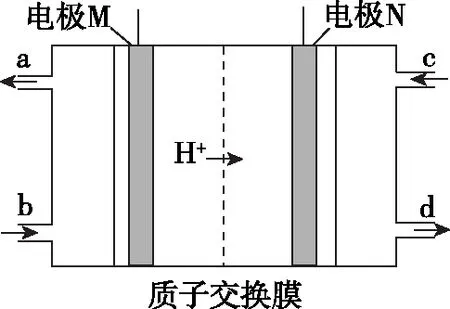
A.N极为电源负极,联氨从c口通入
B.负极上每消耗1 mol N2H4,转移6 mol电子

D.可将联氨改进为引火性低、稳定性好的N2H4·H2O
【答案】D

八、结合化学与生活、化学工艺流程等进行综合考查
以环境问题、合成氨工业等工艺流程为素材并有效结合元素化合物知识、离子方程式的书写、流程设计、反应条件的控制、化学计算等考查,有时候还涉及化学差量法的计算技巧。
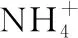
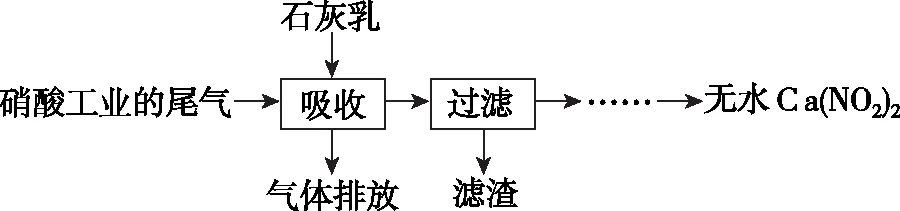

(1)固体1的主要成分为Ca(OH)2、________。
(3)查阅资料可知:向2 mol气体1中通入不同量的O2,并将所得混合气体通入NaOH溶液中,有关含氮组分的物质的量变化如图所示。

上述工艺流程中气体1与O2的体积比(相同条件)应控制为____________________。
(4)为测定上述流程中所得NaNO2溶液的物质的量浓度,准确量取10.00 mL NaNO2溶液样品与24.00 mL 0.05 mol/L 过量的酸性KMnO4溶液充分反应,反应后所得溶液用0.1 mol/L (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去,消耗(NH4)2Fe(SO4)2溶液10.00 mL。
通过计算确定NaNO2溶液的物质的量浓度为______________。
九、结合化学反应原理综合题考查化学学方程式的书写、氧化还原反应、盖斯定律、化学平衡、电化学等
从近几年课标试卷分析来看,结合选修中化学反应原理的相关知识考查的很多,侧重于化学反应速率与化学平衡的有关分析与计算,题目难度较大。试题设计新颖,陌生感强,计算量较大,对学生的要求较高。压强和平衡常数的计算是解答的难点,但是无论怎么考查,都回归到元素氮及其化合物知识,所以在复习时要学会把前后所学的知识加以联系,融会贯通。
【例9】(2018·全国卷Ⅰ·28)采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题:
(1)1840年Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为________________。
(2)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:


2N2O4(g)
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如表所示(t=∞时,N2O5(g) 完全分解):
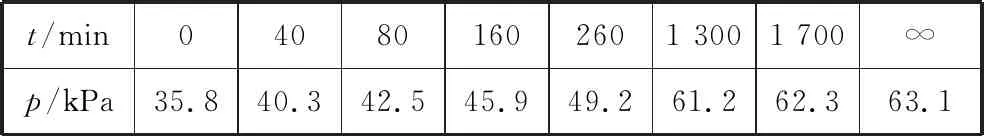
t/min040801602601 3001 700∞p/kPa35.840.342.545.949.261.262.363.1



②研究表明,N2O5(g)分解的反应速率v=2×10-3×pN2O5(kPa·min-1)。t=62 min时,测得体系中pO2=2.9 kPa,则此时的pN2O5=________kPa,v=________kPa·min-1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)________(填“大于”“等于”或“小于”)63.1 kPa,原因是______________。





其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是________(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
【答案】(1)O2(2)①53.1 ②30.0 6.0×10-2③大于 温度提高,体积不变,总压强提高;NO2二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高 ④13.4 (3)AC
【解析】(1)氯气在反应中得到电子作氧化剂,硝酸银中只有氧元素化合价会升高,所以氧化产物是氧气,分子式为O2。(2)①已知:


十、联系化学实验进行考查
一般以氨气、二氧化氮、银氨溶液、金属与铵盐反应、含氮化合物的制备为素材,结合了高中常见仪器综合考查了化学基本仪器的名称、实验方案设计与评价、离子方程式的书写、化学计算等。综合性较强,具有很高的区分度。
【例10】(2017·全国卷Ⅰ·26)凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知:


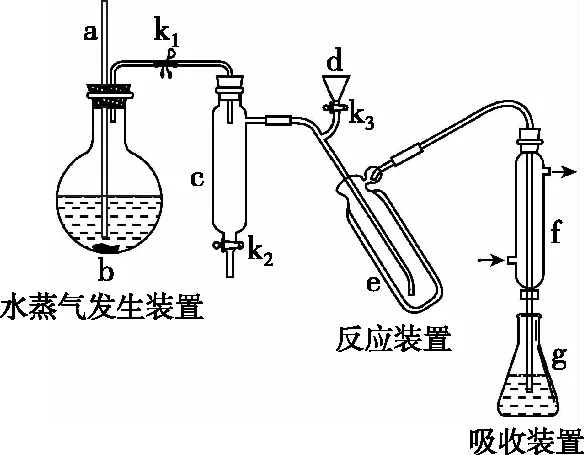
回答下列问题:
(1)a的作用是______________。
(2)b中放入少量碎瓷片的目的是______________。
f的名称是________。
(3)清洗仪器:g中加蒸馏水;打开k1,关闭k2、k3,加热b,蒸气充满管路;停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是____________________;打开k2放掉水,重复操作2~3次。
(4)仪器清洗后,g中加入硼酸(H3BO3)和指示剂,铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭k3,d中保留少量水。打开k1,加热b,使水蒸气进入e。
①d中保留少量水的目的是______________。
②e中主要反应的离子方程式为______________,
e采用中空双层玻璃瓶的作用是____________________。
(5)取某甘氨酸(C2H5NO2)样品mg进行测定,滴定g中吸收液时消耗浓度为cmol·L-1的盐酸VmL,则样品中氮的质量分数为________%,样品的纯度≤________%。