新课标卷Ⅱ物质结构与性质选考题难点突破及预测
安徽
化学人教版选修三《物质结构与性质》是必修内容的深化,有助于学生深刻理解元素周期律、化学键、物质性质等具体内容。在高考中以选考题的形式考查此内容,试题背景比较新颖,题型相对稳定,侧重考查物质与结构的核心知识,注重学生“结构决定性质”思想的树立以及空间想象能力的考查。命题以基础知识为主线,考点源于教材,又略高于教材,注重能力的考查。纵观近三年结构选考题,考查的基本内容变化不大,常以填空、识图、原因分析、简单计算等形式呈现。本文对近三年的命题特点进行对比分析,对2018年高考真题进行详细解析并总结出命题的共同特征。
一、近三年真题对比分析
1.对比
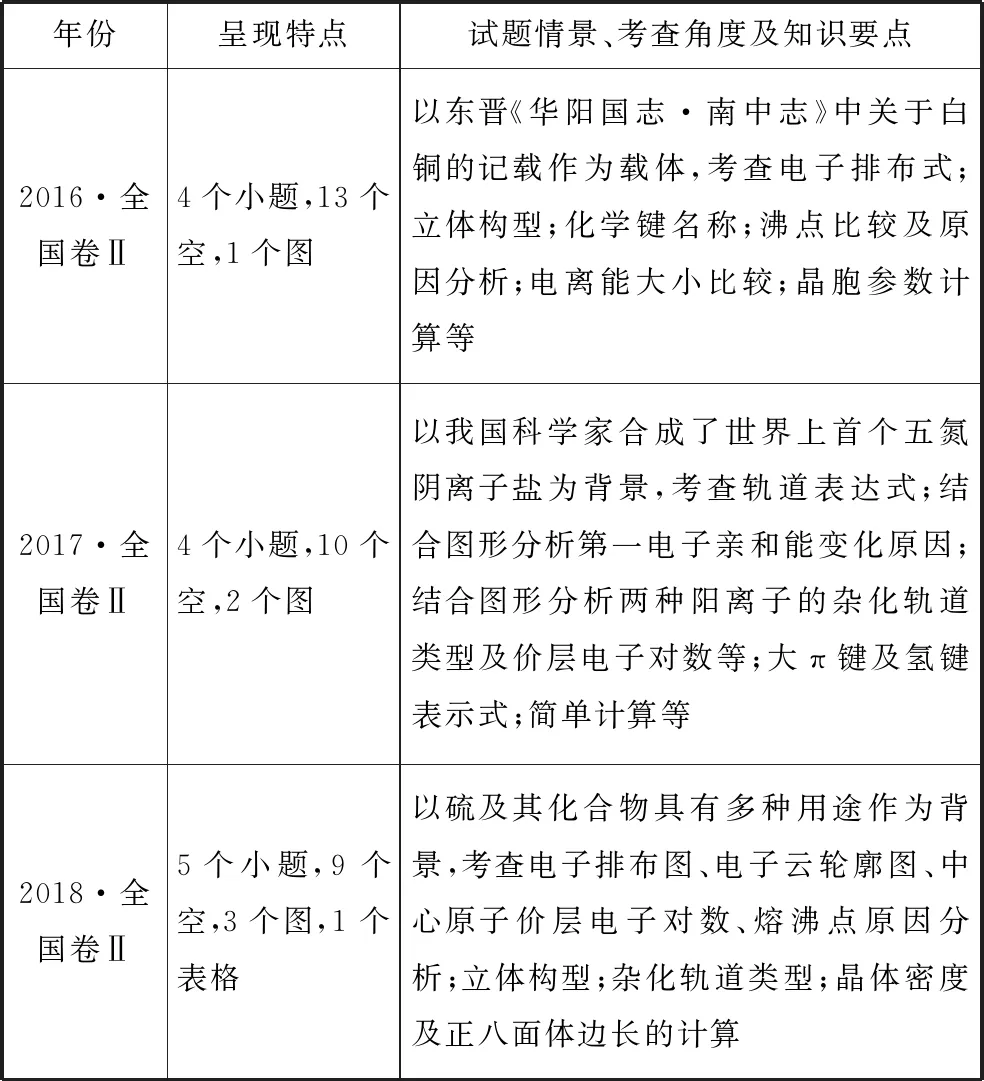
表1
2.考题的共同特征
(1)以弘扬中国古代传统文化或我国科学家最新科技成果作为载体,知识覆盖面广、综合性较强,各小题之间具有一定的独立性,无连带效应,一个问题解决困难通常不会影响下一个问题的解决。知识点少且发散性较弱,考点比较集中,思维、推理要求不是很高。考点一般比较固定:①电子排布式或轨道表达式;②立体构型、杂化轨道类型、价层电子对数等。
(2)题目往往给予2~3个图形,或列出表格。侧重考查学生读取图表信息能力,利用读取的信息解决实际问题的能力。难点有:①价层电子对互斥理论对物质几何构型的分析;②结合图形或给予的新信息对熔沸点的分析或对第一电离能、电子亲和能异常变化作出解释。
(3)注重化学计算能力的考查,每年均涉及密度、晶胞参数或晶胞中含有微粒的数目等简单计算。比如:2016年考查了晶胞参数的计算,2017年考查了晶胞中含有[(N5)6(H3O)3(NH4)4Cl]单元的数目,2018年考查了晶胞密度的计算表达式以及边长的大小。
3.真题解析
【例题】(2018·全国卷Ⅱ·35)硫及其化合物有许多用途,相关物质的物理常数如表所示:
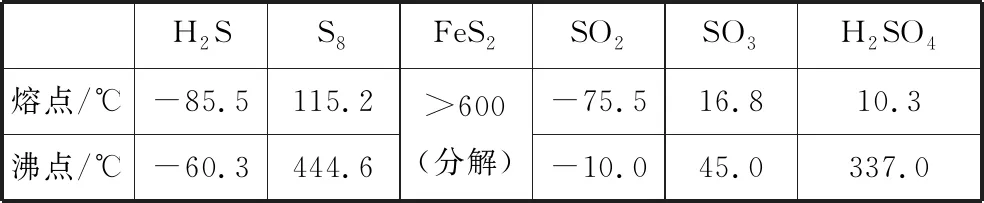
H2SS8FeS2SO2SO3H2SO4熔点/℃-85.5115.2沸点/℃-60.3444.6>600(分解)-75.516.810.3-10.045.0337.0
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为________。

图(a)
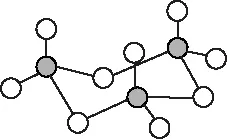
图(b)

图(c)
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
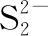

(2)H2S
(3)S8相对分子质量大,分子间范德华力较强
(4)平面三角 2 sp3
【解析】(2)根据价层电子对互斥理论,不同于其他分子的是H2S。
(3)S8与SO2均为分子晶体,S8相对分子质量较大,范德华力较强,所以其熔点和沸点要比二氧化硫的熔点和沸点高很多。
(4)气态三氧化硫分子的立体构型为平面三角形,其中共价键的类型有σ键、π键两种;固体三氧化硫中存在三聚分子,所以该分子中S原子的杂化轨道类型为sp3杂化。

二、命题特点
①题目设计与教材知识点联系紧密,依据教材,基于教材又略高于教材,设问明了、简洁。所涉及考点覆盖《物质结构与性质》模块的核心内容,主要考查物质结构的基础知识,考查面广。题目不回避高频考点,比如:2016年第一问考查电子排布式,2017、2018年均考查电子排布图。
②题目给予一个表格、三个图形,结合图表考查分子晶体熔沸点的比较、分子的立体构型、共价键及杂化轨道的类型、晶胞密度以及边长的计算,考查考生提取图表信息解决新问题的能力。要求考生能够根据已有的知识和题目图表、图形,提取、归纳相关信息,对化学问题进行逻辑推理和论证,得出正确的结论或作出正确的判断,并能把推理过程准确地表达出来的能力。
③该题目考查了化学核心素养中的宏观辨识与微观探析,以硫及其化合物作为载体,考查高频考点价层电子的电子排布图、电子云轮廓图、中心原子的价层电子数等基本问题,间接实现对素养的考查;体现了运用符号表征物质及其变化,从物质的微观层面理解其组成、结构和性质的联系。
④在试题的呈现方式上,稳中求变、强调应用、突出能力。2017年给予新信息“第一电子亲和能”,进行自主学习、吸收整合、灵活应用。2018年给予表格信息,要求学生对图表进行分析。比如:已知S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因是什么。
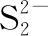
⑥经典图形重复考查,题目给予了3个图形,1个表格,笔者发现,在之前的高考题中均已经出现,可见高考命题并不回避经典的结构图形。如表2所示:

表2
表格信息与2016年全国卷Ⅰ较为相似,均考查分子晶体熔沸点的比较,(节选)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_________。

【答案】GeCl4、GeBr4、GeI4熔沸点依次升高,原因是分子结构相似,相对分子质量依次增大,分子相互作用力逐渐增强。
三、难点突破
1.价层电子对互斥理论(VSEPR)
价层电子对互斥理论在讨论分子的几何构型时,直接从中心原子的价电子对着手,价层电子对彼此相距最远时,排斥力最小,体系的能量最低。孤电子对间的排斥力较大,孤电子对越多,排斥力越强,键角越小。
(1)元素种类法
ABm型分子或离子的价层电子对数

中心原子上的孤电子对数=n(价电子对数)-m(配位原子数)
规定:①中心原子的价电子数等于中心原子的最外层电子数;作为中心原子,卤素原子提供7个电子,O、S原子提供6个电子;
②卤素原子和H原子作为配体,每个配原子向中心原子提供1个价层电子,O、S作为配原子时不提供电子;N原子作配原子时,它不仅不向中心原子提供价层电子,反而要从中心原子拉走1个价层电子。
③对于复杂离子,在计算价层电子对数时,还应加上阴离子的电荷数或减去阳离子的电荷数。
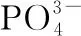
(2)结构式法
对非过渡系元素构成的分子来说,用结构式中共价键的性质不同来确定相关配原子向中心原子提供的价层电子数。在高考中可用于判断有机物或氰化物中价层电子对数。
规定:①以单键与中心原子结合的配原子,向中心原子提供1个价层电子;
②以双键与中心原子结合的配原子,不向中心原子提供价层电子;
③以三键与中心原子结合的配原子,不但不向中心原子提供价层电子,反而要从中心原子拉走1个价层电子。
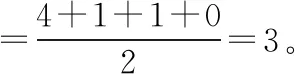
2.高频考点——晶体熔、沸点高低的比较
(1)不同类型晶体熔、沸点的高低的一般规律:原子晶体>离子晶体>分子晶体。
(2)金属晶体:金属离子半径越小,离子电荷数越多,金属键越强,金属熔、沸点就越高。
(3)原子晶体:一般情况,原子半径越小,则共价键键长越短,键能越大,晶体的熔、沸点越高。
(4)离子晶体:一般情况,阴阳离子所带电荷数越多,离子间距越小,则晶格能越大,其晶体的熔、沸点就越高。
(5)分子晶体:
①一般情况,分子间作用力越大,物质的熔、沸点越高;含有氢键的分子晶体熔、沸点反常更高。
②组成和结构相似的分子晶体,相对分子质量越大,则范德华力越大,熔、沸点越高。
③组成和结构不相似的分子晶体(相对分子质量接近),分子的极性越大,其熔、沸点越高。比如:CO熔沸点大于N2。
四、2019年高考预测及备考策略
(1)由于选修三内容抽象、术语陌生(例如:电子云、能级、基态、激发态、晶格能、晶胞等),知识点少且不易发散,所以2019年高考依然不回避高频考点,比如:书写1~36号中某元素的电子或价电子排布式、轨道表达式等;结合元素周期律考查第一电离能或电负性;结合价层电子对互斥理论(VSEPR)考查杂化方式以及分子的空间构型;结合简单立方、面心立方、体心立方、六方最密堆积等四种金属的晶胞类型考查晶体化学式的确定、配位数、空间结构及晶体密度计算。
(2)延续近年的命题特点,题目仍然会以我国古代传统文化或新科技成果为载体,不需要学生推导元素的种类,从教材基础知识出发,减少文字叙述,给予2~3个图表信息。注重考查学生提取题目给予图表信息的能力,重组、转换利用新信息的能力;“图表信息”或新信息往往隐含着解题的关键条件,通过考生现场阅读获得信息,面对新情景,解决新问题。
(3)《物质结构与性质》模块的理论性比较强,内容抽象而复杂,涉及原理较多,复习时要重视高频考点与主干知识间的联系和整合,从微观结构来理解物质的物理、化学特性。比如:学习氨气物理性质时,学生知道氨气极易溶于水(体积比1∶700),原因是什么呢?从结构的角度可以解释,因为氨气和水均为极性分子,根据相似相溶,极性分子易溶于极性溶剂,更重要的是氨分子与水分子能形成分子间氢键,溶解度增大。
(4)准确把握考试说明要求,复习过程中从关注知识点细节向形成结构化的知识转变。加强学生抽象概念的理解和空间想象能力构造的训练,教学中不要随意增加、拓深课程标准要求之外的内容。以“突出高频考点、强化重点热点、难点内容不拓宽、能力要求不拔高”为指导思想,以我国新科技所涉及的典型物质为载体,深化学生对物质结构、性质及其相互关系的理解,加强学生化学核心素养的培养。


