利拉鲁肽抑制ERS改善高脂饮食诱导的DN肾损害
梁日英?符畅?梁华?徐芬?王美君?蔡梦茵
【摘要】目的 探討内质网应激(ERS)机制是否参与调节利拉鲁肽改善高脂饮食诱导的糖尿病肾病(DN)。方法 采用高脂饮食喂养7 ~8周龄C56BL/6小鼠共12周以诱导早期DN,正常饮食喂养小鼠作为对照组。将高脂饮食小鼠分为高脂饮食(HFD)组及高脂饮食+利拉鲁肽干预(HFD+Lira)组,HFD+Lira组予腹腔注射利拉鲁肽400 μg/(kg·d)8周。HFD组与对照组均予相对应体积的生理盐水。每2周监测小鼠体质量及血糖情况,干预8周后评估/观察小鼠胰岛功能、胰岛素抵抗、尿蛋白、肾脏组织形态结构以及肾脏组织ERS通路蛋白葡萄糖调节蛋白78(GRP78)与剪接型X-盒结合蛋白1(XBP1s)的表达水平。结果 HFD组体质量、空腹血糖和体脂含量均高于对照组;利拉鲁肽干预8周后,与HFD组比较,HFD+Lira组体质量、空腹血糖和体脂含量均改善(P均< 0.01)。HFD组血糖、尿蛋白高于对照组、胰岛素抵抗较对照组明显,HFD+Lira组血糖及尿蛋白均低于HFD组、胰岛素抵抗较HFD组改善(P均< 0.017)。对照组肾小球、肾小管结构正常,HFD组可见肾小管区域大量空泡形成、肾小球囊腔扩大、大量脂质沉积,与HFD组相比,HFD+Lira组肾小管区域空泡减少、扩大的肾小球囊腔及脂质沉积腔改善。HFD组GRP78与XBP1s蛋白表达水平均较对照组高,HFD+Lira组XBP1s蛋白的表达水平低于HFD组(P均< 0.017)。结论 利拉鲁肽可能通过抑制ERS通路而改善高脂饮食喂养诱导的DN肾损害。
【关键词】糖尿病肾病;胰高血糖素样肽1;内质网应激;葡萄糖调节蛋白78;
剪接型X-盒结合蛋白1;利拉鲁肽
Liraglutide alleviates high-fat diet-induced diabetic nephropathy by inhibiting endoplasmic reticulum stress Liang Riying, Fu Chang, Liang Hua, Xu Fen, Wang Meijun, Cai Mengyin. Department of Endocrin-ology and Metabolism, the Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 510630, China
Corresponding author, Cai Mengyin, E-mail: my. sabrina. c@ 163. com
【Abstract】Objective To investigate whether the mechanism of endoplasmic reticulum stress (ERS) is involved in the protective effect of liraglutide on diabetic nephropathy (DN) induced by high-fat diet. Methods The 7-8-week old C56BL/6 mice were subjected to a high fat diet (HFD) for 12 weeks to establish mouse models with early DN, and those mice given with normal diet were allocated into the control group. Then, mice in the HFD group were further divided into the HFD and HFD+Liraglutide (HFD+Lira) groups. Mice in the HFD+Lira group were given with liraglutide at a dose of 400 μg/(kg·d) by intraperitoneal injection for 8 weeks. An equivalent amount of normal saline was administered in the HFD and control groups. During the period of animal experiment, body weight and fasting blood glucose were monitored every two weeks. At 8 weeks after intervention, the islet function, insulin resistance, urinary albumin, renal morphology and the expression levels of glucose regulatory protein 78 (GRP78) and X-box binding protein 1 splicing (XBP1s) on the ERS signaling pathway in the renal tissues were evaluated or observed. Results The body weight, fasting blood glucose and body fat content in the HFD group were significantly higher compared with those in the control group. At 8 weeks after liraglutide intervention, body weight, fasting blood glucose and body fat content in the HFD+Lira group were significantly alleviated than those in the HFD group (all P < 0.01). In the HFD group, the fasting blood glucose and urinary albumin were higher, whereas the insulin resistance was more evident compared with those in the control group. In the HFD+Lira group, the fasting blood glucose and urinary albumin were significantly lower, whereas the insulin resistance was ameliorated compared with those in the HFD group (all P < 0.017). The structures of glomerulus and renal tubules were normal in the control group. A large quantity of vacuoles in the renal tubule, Bowmans capsule space and a large amount of lipid deposition were observed in the HFD group. Compared with the HFD group, the amount of vacuoles in the renal tubule was reduced, and Bowmans capsule space and lipid deposition were alleviated. In the HFD group, the expression levels of GRP78 and XBP1s were significantly up-regulated compared with those in the control group (both P < 0.017). The expression level of XBP1s in the HFD+Lira group was remarkably down-regulated than that in the HFD group (P < 0.017). Conclusion Liraglutide can mitigate DN injury induced by high-fat diet probably by suppressing the ERS signaling pathway.
【Key words】Diabetic nephropathy;Glucagon-like peptide 1;Endoplasmic reticulum stress;
Glucose regulatory protein 78;X-box binding protein 1 splicing;Liraglutide
约30% ~ 40%的1型糖尿病和2型糖尿病(T2DM)最终会发展为糖尿病肾病(DN)[1]。DN的发病机制主要涉及糖脂代谢紊乱、血流动力学的不稳定和炎症通路等[2]。利拉鲁肽属于胰高血糖素样肽1(GLP-1)受体激动剂,是治疗T2DM的药物之一。利拉鲁肽的心血管结局(LEADER)研究显示标准治疗方案联合利拉鲁肽治疗组患者相较标准治疗方案组患者肾脏获益效应更明显,表现在肾脏不良事件包括新发大量蛋白尿、血清肌酐倍增、终末期肾病导致的死亡风险降低22%[3]。临床常用的治疗措施对防治DN仍远远不够。LEADER研究结果为DN的治疗带来了新希望。研究表明,利拉鲁肽有助于改善肥胖T2DM患者代谢指标,进一步探讨GLP-1肾脏保护作用的分子机制有重要的临床意义[4]。
内质网应激(ERS)是指细胞受到内外因素的刺激时,大量未折叠蛋白或错误折叠蛋白在内质网聚积,若ERS持续不缓解将导致内质网功能受损,进而发生细胞凋亡;肌醇蛋白1(IRE1)、内质网激酶(PERK)和活化转录因子6(ATF6)是内质网膜上的应激信号感受蛋白[5]。高糖及高脂毒性可引发过度的ERS,促进糖尿病及其并发症的发生与发展[6-7]。在患DN的人类及小鼠的肾脏组织标本中均可见过度的ERS[8-9]。X-盒结合蛋白1(XBP1) 是IRE1下游关键的转录调节因子,剪接型XBP1(XBP1s)是XBP1的活化形式。研究表明,XBP1s在调节糖脂代谢稳态中有重要的调控作用[10-11]。当内质网中未折叠蛋白含量增加且超过正常范围时,葡萄糖调节蛋白78 (GRP78)与内质网膜上的IRE1、PERK和ATF6感受蛋白结合,使GRP78 表达上调,此外,GRP78 作为ERS标志蛋白,可与ERS激活的促凋亡受体结合,抑制其信号表达,从而维持机体内环境稳态[12-13]。因此,GRP78与XBP1s常被视为ERS的标志性蛋白。本课题组初步探讨了ERS在利拉鲁肽改善高脂饮食诱导DN肾损害中的作用。
材料与方法
一、材 料
7 ~ 8周龄的C56BL/6小鼠18只,购自南京大学模式动物研究所,无特定病原体(SPF)级,体质量为19 ~ 22 g。小鼠饲养于中山大学附属第三医院实验动物中心屏障系统中。饲养环境为12 h人工日光灯照射、12 h黑夜,环境温度(21±2)℃,小鼠自由进食和饮水。对照饲料购自广东省实验动物中心,高脂饲料购自美国Research Diets公司。胰岛素注射液和利拉鲁肽注射液均购自丹麦诺和诺德制药有限公司。鼠尿蛋白ALBUWELL检测试剂盒购自美国EXOCLL公司。蛋白酶抑制剂、RIPA蛋白裂解液、二喹啉甲酸(BCA)蛋白浓度测定试剂盒购自美国Thermo Scientific公司。GRP78和XBP1s抗体购自美国CST公司;红外荧光染料标记兔二抗购自美国LI-COR公司。本实验经中山大学附属第三医院实验动物伦理委员会批准(批准号IACUC-F3-17-0801)。
二、方 法
1. 模型制备及标本采集
小鼠适应性喂养1周后,根据体质量分为正常饮食组(对照组,n = 5)及高脂饮食组(n = 13),分别给予正常对照饲料(脂肪供能占热卡百分比为11%)及高脂饲料(脂肪供能占热卡百分比为60%)饮食喂养诱导。喂养12周后再次根据体质量将高脂饮食组小鼠分为单纯高脂饮食组(HFD组,n = 7),高脂饮食+利拉鲁肽干预组(HFD+Lira组,n = 6)。HFD+Lira组小鼠给予利拉鲁肽注射液400 μg/(kg·d)腹腔注射,对照组与HFD组小鼠按照体质量给予相对应体积的生理盐水作为对照,3组均连续腹腔注射给药或生理盐水8周。
2. 指标检测及标本采集
利拉鲁肽腹腔注射8周后,收集小鼠24 h尿液;行腹腔内注射葡萄糖耐量试验(IPGTT)和腹腔内注射胰岛素耐量试验(IPITT);使用动物体脂定量分析仪测量每只小鼠体内总脂肪重量和总肌肉重量以计算体脂含量;每2周检测小鼠体质量及血糖。小鼠禁食8 h后麻醉处死,留取小鼠肾脏标本,固定于4%的多聚甲醛后进行苏木素-伊红(HE)染色,在光学显微镜下进行观察和拍照;制成冰冻切片后进行油红O染色、75%乙醇分化、苏木素复染后,用甘油明胶封片,在光学显微镜下进行观察和拍照。
3. 酶联免疫吸附法测定鼠尿蛋白
设置标准曲线和阴性、阳性对照孔,历经孵育抗体、洗涤、显色等实验步骤后,设置酶标仪的测量波长为450 nm,测量出每个样本的光密度(OD值)。将蛋白标准品的光OD值输入ELISA Calc软件,做出鼠尿蛋白标准曲线。根据软件得出的标准曲线,计算每个尿样品稀释之后的蛋白浓度。
4. 用蛋白免疫印跡法检测小鼠肾组织ERS通路相关蛋白GRP78及XBP1s的表达
剪取肾脏组织15 mg于100 μl预冷的含有蛋白酶抑制剂的RIPA蛋白裂解液提取肾脏总蛋白,用BCA法测定蛋白浓度。蛋白样品经过电泳、转膜、脱脂奶粉封闭、孵育一抗、外荧光染料标记二抗、Odyssey双色红外激光成像系统曝光蛋白条带后,使用Image-Pro Plus 软件进行灰度分析,用目的蛋白灰度值/内参灰度值表示目的蛋白相对表达水平。
三、统计学处理
采用SPSS 22.0处理数据,正态分布的计量资料以表示,多组定量资料比较用单因素方差分析。α= 0.05,两两比较采用Bonferroni法校正检验水准,即P < 0.017为差异有统计学意义。
结果
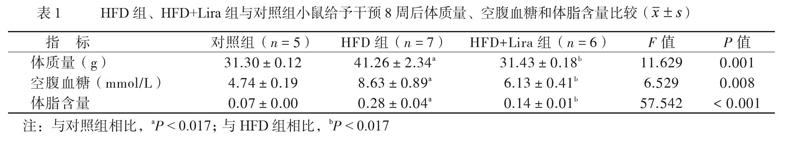
一、利拉鲁肽改善高脂饮食诱导所致C57BL/6小鼠体质量增加和空腹血糖受损情况
高脂诱导20周后,与对照组相比,HFD组小鼠体质量、空腹血糖和体脂含量升高(P均< 0.017);给予干预8周后,HFD+Lira组小鼠体质量、空腹血糖和体脂含量较HFD组改善(P均< 0.01),见表1。
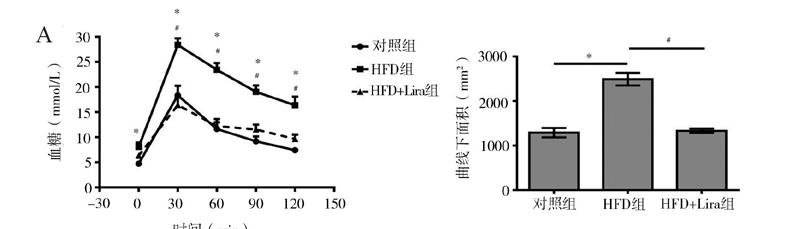
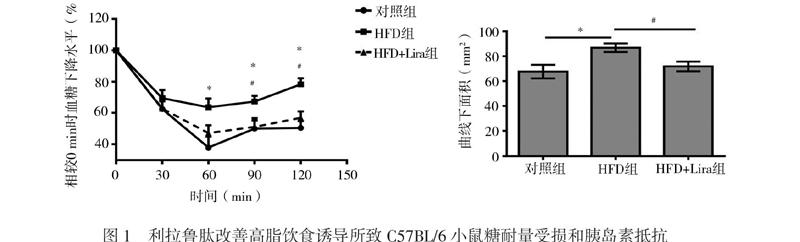
二、利拉鲁肽改善高脂饮食诱导所致C57BL/6小鼠糖耐量受损和胰岛素抵抗
IPGTT结果表明,腹腔注射葡萄糖后,3组小鼠的IPGTT结果曲线下面积比较差异有统计学意义(F = 25.523,P < 0.001)。与对照组相比,HFD组小鼠0、30、60、90、120 min时的血糖明显升高,曲线下面积增加[(2491.93±130.46)mm2 vs. (1290.30±94.10)mm2,P < 0.001)],提示HFD组小鼠葡萄糖耐量受损。给予干预8周后,与HFD组相比,HFD+Lira组30、60、90、120 min时的血糖下降,曲线下面积减少[(1332.00±43.95)mm2 vs.(2491.93±130.46)mm2,P < 0.001)],提示给予利拉鲁肽干预后高脂饮食诱导所致的葡萄糖耐量受损明显改善,见图1A。
IPITT结果表明,腹腔注射胰岛素后,3组小鼠的IPITT结果曲线下面积比较差异有统计学意义(F = 8.186,P = 0.004)。与对照组相比,HFD组小鼠60、90、120 min时的血糖相对0 min时的血糖下降的幅度更大,曲线下面积增加[(86.80±3.22)mm2 vs.(67.62±4.85)mm2,P = 0.009)],提示HFD组小鼠胰岛素抵抗明显;给予干预8周后,与HFD组相比,HFD+Lira组90、120 min时的血糖相对0 min时的血糖下降幅度小,曲线下面积减少[(71.79±3.55)mm2 vs.(86.80±3.22)mm2,P = 0.013)],提示给予利拉鲁肽干预后由高脂饮食诱导的胰岛素抵抗明显改善,见图1B。
三、利拉鲁肽改善高脂饮食喂养的C57BL/6小鼠尿蛋白
高脂饮食诱导20周后,HFD组小鼠尿蛋白水平较对照组高[(5.13±0.65)μg/ml vs. (2.47±0.35)μg/ml,P = 0.010];给予干预8周后,3组小鼠的尿蛋白比较差异有统计学意义(F = 9.579,P = 0.003),HFD+Lira组小鼠尿蛋白水平较HFD组低[(2.29±0.22)μg/m vs. (5.13±0.65)μg/ml,P = 0.006],见图2。
四、利拉鲁肽改善高脂饮食喂养的C57BL/6小鼠肾损害
肾脏组织HE染色结果显示,对照组小鼠肾小球、肾小管结构正常;HFD组肾小管区域大量空泡形成,肾小球囊腔扩大;与HFD组相比,HFD+Lira组肾小管区域空泡减少,扩大的肾小球囊腔得以改善。肾脏组织油红O染色结果显示,与对照组相比,HFD组小鼠肾小管、肾小球区域大量脂质沉积;HFD+Lira组小鼠肾小管、肾小球区域的脂质沉积较HFD组改善,见图3。
五、利拉鲁肽对高脂喂养的C57BL/6小鼠肾脏组织ERS通路的影响
蛋白免疫印迹结果显示,给予干预8周后,3组小鼠肾脏组织的GRP78蛋白表达水平比较差异有统计学意义(F = 9.297,P = 0.008),HFD组GRP78蛋白表达水平较对照组高(2.14±0.24 vs. 1.00±0.099,P = 0.011),見图4A。给予干预8周后,3组小鼠肾脏组织的XBP1s蛋白表达水平比较差异有统计学意义(F = 10.452,P = 0.002),HFD组XBP1s蛋白表达水平较对照组高(2.173±0.252 vs. 1.000±0.254,P = 0.009),HFD+Lira组XBP1s表达水平较HFD组低(1.176 ±0.092 vs. 2.173±0.252,P = 0.003),见图4B。
讨论
DN是糖尿病常见的并发症,其病理过程主要包括由足细胞损伤等引起的微量蛋白尿,肾小球系膜扩张及肾小球和肾小管肥大增生,进一步进展为肾小球硬化和肾脏组织纤维化[1]。目前的降糖、降压、ACEI/ARB等DN治疗方案虽能降低尿蛋白与尿肌酐比值,但仍远远不够。LEADER研究显示利拉鲁肽除了降低体质量、改善糖脂代谢外,还有独立于降血糖效应的显著肾脏保护作用,但利拉鲁肽改善DN的具体分子机制仍未清楚。研究表明,DN动物模型表现出尿蛋白升高和肾脏组织病理结构改变,比如系膜扩张、K-W结节等,高脂喂养的C56BL/6小鼠表现出DN的早期表现,即尿蛋白升高[14]。本课题组通过高脂饮食喂养C57BL/6小鼠模拟T2DM早期DN模型,再给予利拉鲁肽腹腔注射治疗,进而探讨利拉鲁肽改善DN的分子机制。本研究结果表明,高脂饮食喂养后,C56BL/6小鼠体质量增加、空腹血糖升高、腹腔内注射葡萄糖耐量受损和腹腔内注射胰岛素抵抗明显;尿蛋白明显升高、肾小管区域大量空泡形成,肾小球囊腔扩大,肾脏组织脂质沉积等,表明我们在C57BL/6小鼠上成功构建了早期DN模型。我们发现利拉鲁肽在调节血糖稳态和保护肾脏方面有独特作用,利拉鲁肽降低了高脂喂养C56BL/6小鼠的体质量、空腹血糖,改善了腹腔内注射葡萄糖耐量和腹腔内注射胰岛素耐量,降低了尿蛋白,改善肾脏组织的脂质沉积、减少肾小管区域的空泡和改善增大的肾小球囊腔。
既往研究显示DN患者和小鼠肾组织中ERS标志蛋白GRP78、XBP1s等的表达增加,DN中存在ERS,ERS参与了DN的发生发展,ERS相关的细胞凋亡和肾脏损伤是导致DN的原因之一[8]。ERS对于DN而言是双刃剑,早期的高血糖和蛋白尿,ERS作为一种适应性反应对肾小管上皮细胞起保护作用,但持续的高血糖和蛋白尿最终会导致肾小管上皮细胞凋亡[8]。此外,ERS还介导了足细胞损伤,参与了肾小球系膜细胞损伤及细胞外基质增生等。Hotamisligil等(2010年)的研究表明GLP-1可以通过抑制ERS在糖脂代谢疾病中发挥重要调节作用。Yusta等(2006年)提出GLP-1受体激动剂Exendin-4通过抑制胰岛β细胞的ERS通路进而改善糖尿病小鼠胰岛β细胞的功能和抑制胰岛β细胞的凋亡。Zheng等(2017年)的研究表明Exenatide干预能逆转高脂毒性所致的C57BL/6小鼠和改善棕榈酸诱导的肝脏HepG2细胞的ERS,进而发挥保护肝脏功能的作用。利拉鲁肽能保护肥胖和胰岛素抵抗小鼠模型的脂肪细胞免受ERS的损害。以上均提示,GLP-1受体激动剂改善糖尿病患者肾功能可能与改善过度激活的ERS有关。本研究显示,利拉鲁肽能抑制高脂饮食喂养C57BL/6小鼠肾脏组织ERS通路的激活。因此,利拉鲁肽可能通过抑制ERS通路进而改善高脂饮食喂养所致的DN肾损害。但是,本研究尚未能阐述利拉鲁肽是如何介导改善肾脏组织ERS进而改善DN的结局,此疑问还有待进一步开展转基因小鼠实验、体外细胞实验等以进一步探讨相关的分子机制。
参 考 文 献
[1] Kato M, Natarajan R. Epigenetics and epigenomics in diabetic kidney disease and metabolic memory. Nat Rev Nephrol, 2019, 15(6):327-345.
[2] Thomas MC, Brownlee M,Susztak K,Sharma K, Jan-deleit-Dahm KA, Zoungas S, Rossing P, Groop PH, Cooper ME. Diabetic kidney disease. Nat Rev Dis Primers, 2015,1:15018.
[3] Mann JFE, ?rsted DD, Brown-Frandsen K, Marso SP, Poulter NR, Rasmussen S, Torn?e K, Zinman B, Buse JB; LEADER Steering Committee and Investigators. Committee,investigators, liraglutide and renal outcomes in type 2 diabetes. N Engl J Med, 2017, 377(9):839-848.
[4] 黄蓉, 黄建青,陈彤. 利拉鲁肽简化肥胖2型糖尿病患者降糖治疗方案的临床观察. 新医学, 2016, 47(6):388-392.
[5] Walter P, Ron D. The unfolded protein response: from stress pathway to homeostaticregulation. Science,2011,334(6059):1081-1086.
[6] Dehdashtian E, Mehrzadi S, Yousefi B, Hosseinzadeh A, Reiter RJ, Safa M, Ghaznavi H, Naseripour M. Diabetic retinopathy pathogenesis and the ameliorating effects of melatonin; invo-lvement of autophagy, inflammation and oxidative stress. Life Sci, 2018, 193:20-33.
[7] Kim MJ, Kim MN, Min SH, Ham DS, Kim JW, Yoon KH, Park KS, Jung HS. Specific PERK inhibitors enhanced glucose-stimulated insulin secretion in a mouse model of type 2 diabetes. Metabolism,2019,97:87-91.
[8] Lindenmeyer MT, Rastaldi MP, Ikehata M, Neusser MA, Kretzler M, Cohen CD, Schl?ndorff D. Proteinuria and hype-rglycemia induce endoplasmic reticulum stress. J Am Soc Nep-hrol, 2008, 19(11):2225-2236.
[9] Kato M, Wang M, Chen Z, Bhatt K, Oh HJ, Lanting L, Deshpande S, Jia Y, Lai JY, OConnor CL, Wu Y, Hodgin JB, Nelson RG, Bitzer M, Natarajan R. An endoplasmic reticulum stress-regulated lncRNA hosting a microRNA mega-cluster induces early features of diabetic nephropathy. Nat Commun, 2016, 7: 12864.
[10] Lee J, Sun C, Zhou Y, Lee J, Gokalp D, Herrema H, Park SW, Davis RJ, Ozcan U. p38 MAPK-mediated regulation of Xbp1s is crucial for glucosehomeostasis. Nat Med, 2011, 17(10):1251-1260.
[11] Williams KW, Liu T, Kong X, Fukuda M, Deng Y, Berglund ED, Deng Z, Gao Y, Liu T, Sohn JW, Jia L, Fujikawa T, Kohno D, Scott MM, Lee S, Lee CE, Sun K, Chang Y, Scherer PE, Elmquist JK. Xbp1s in Pomc neurons connects ER stress with energy balance and glucose homeostasis. Cell Metab, 2014, 20(3):471-482.
[12] Amin-Wetzel N, Saunders RA, Kamphuis MJ, Rato C, Preissler S, Harding HP, Ron D. A J-protein co-chaperone recruits BiP to monomerize IRE1 and repress the unfolded protein response. Cell, 2017, 171(7):1625-1637.
[13] Grkovic S, OReilly VC, Han S, Hong M, Baxter RC, Firth SM. IGFBP-3 binds GRP78, stimulates autophagy and pro-motes the survival of breast cancer cells exposed to adverse microenvironments. Oncogene, 2013, 32(19): 2412-2420.
[14] Azushima K, Gurley SB, Coffman TM. Modelling diabetic nephropathy in mice. Nat Rev Nephrol, 2018, 14(1): 48-56.
(收稿日期:2019-08-30)
(本文編辑:洪悦民)

