猴头菇β-葡聚糖的结构表征及其稀溶液性质
张三丰,王一非,冯 涛,*,庄海宁,宋诗清,姚凌云,孙 敏,徐志民
(1.上海应用技术大学香料香精技术与工程学院,上海 201418;2.上海市农业科学院食用菌研究所,农业部南方食用菌资源利用重点实验室,国家食用菌工程技术研究中心,国家食用菌加工技术研发分中心,上海 201403)
猴头菇(Hericium erinaceus)又名猴头菌、刺猬菌等,是一种大型真菌,属担子菌纲、多孔菌目、齿菌科、猴头属[1],是珍贵的药食两用菌,含有多糖、寡糖、甾醇类、萜类和酚类等多种活性物质,具有提高免疫力、抗肿瘤、抗衰老、降血脂等多种生理功能。多糖是猴头菇中重要的活性物质,具有降血糖、抗氧化、抗肿瘤、加速伤口的愈合等[2]功效。
不同多糖具有不同的分子质量、化学结构以及在水中的溶解度和分子链构象,这些都明显影响其生物活性。β-葡聚糖作为多糖研究领域中的一个重要分支,主要由β-1,3、β-1,4、β-1,6等葡聚糖组成[3],广泛分布于真菌、酵母和谷物中[4]。香菇β-葡聚糖[5]、燕麦β-葡聚糖[6]和青稞β-葡聚糖[7]由于其分子质量、糖苷键类型、分子链构象的不同,导致其在生物功能上差异很大。因此高效地提取和纯化多糖,并研究其化学结构和分子链构象是必要的。猴头菇β-葡聚糖(H. erinaceus β-glucan,HEBG)是猴头菇多糖中重要的活性成分,具有多种生物活性,特别是在抑制淀粉消化方面有显著功效[8]。但是目前对于HEBG的结构表征及其在溶液中的分子链构象的研究鲜见报道。
本实验通过水提醇沉法提取得到HEBG,采用多种方法对HEBG的一级结构进行表征,用扫描电子显微镜、原子力显微镜观察并分析溶液性质,对HEBG的分子链构象进行深入的研究。为进一步研究HEBG生物活性以及构效关系给出基础数据,为β-葡聚糖应用到食品和化妆品中提供理论参考。
1 材料与方法
1.1 材料与试剂
猴头菇子实体 上海百信生物科技有限公司。
葡萄糖标准品 北京拜尔迪生物公司;葡萄糖测定试剂盒 上海荣盛生物药业有限公司;氢氧化钠、高碘酸钠、碘酸钠、乙二醇、三氟乙酸、盐酸羟胺、吡啶、乙酸酐、硼氢化钠、乙醇、乙二醇、盐酸、乙酸、刚果红、浓硫酸、三氟乙酸、乙酸(均为分析纯) 国药集团化学试剂有限公司;甘油、赤藓醇、NaBH4(均为分析纯) 美国Sigma公司。
1.2 仪器与设备
DHG系列电热鼓风干燥箱、DKZ系列电热恒温振荡水槽 上海一恒科学仪器有限公司;TGL-16M台式离心机湖南湘仪实验仪器开发有限公司;UV2350紫外分光光度计 尤尼柯(上海)仪器有限公司;高效液相排阻色谱-多角度激光散射仪-示差折光仪联用系统(highperformance sizeexclusion chromatography coupled with multi-angle laser light scattering-refractive index,HPSECMALLS-RI)(Waters 2414示差检测器、Waters 2695高效液相色谱泵、Waters 717 plus自动进样器和八角度激光光散射检测器组成) 美国Wyatt公司;VERTEX-70傅里叶红外光谱分析仪 德国Bruker公司;6820气相色谱、GC6890-5973MS气相色谱-质谱联用仪 美国安捷伦公司;S-3400N扫描式电子显微镜 日立高新那珂事业所;Nano Scope IIIa原子力显微镜 美国Digital Instruments公司;AVANCE III 500 MHz核磁共振(nuclear magnetic resonance,NMR)波谱仪 瑞士Bruker公司。
1.3 方法
1.3.1 HEBG的制备
称取一定量猴头菇,按料液比1∶15(g/mL)加入蒸馏水,100 ℃提取2 h,提取2 次,过滤,合并滤液,滤液按浓缩比(子实体质量∶粗提液体积(g/mL))1∶3浓缩,25 ℃、12 840×g离心15 min,取离心后的上清液至4 ℃冰箱冷藏12 h,然后4 ℃、12 840×g离心15 min得到部分沉淀,沉淀用20%乙醇溶液反复醇洗,蒸馏水溶解后用3 500 Da透析袋透析3 d,透析液冷冻干燥即获得HEBG[9]。
1.3.2 HEBG的分子质量测定
1.3.2.1 色谱条件
TSK PWXL 3000和TSK PWXL 4000色谱柱;缓冲液流速0.5 mL/min,柱温(35±0.1)℃,进样量20 μL。
1.3.2.2 分子质量测定
精确称取葡聚糖标准品2 mg,溶于1 mL缓冲液中,缓冲液为0.05 mol/L的NaH2PO4·2H2O和0.15 mol/L的NaNO3混合溶液,配制成质量浓度5 mg/mL的溶液,12 840×g离心20 min后取上清液进行分析,进样体积20 μL。
1.3.3 HEBG单糖组成分析
1.3.3.1 色谱条件
CarboPac PA20阴离子交换分析柱(150 mm×3 mm);ED50A电化学检测器(金电极)、LC30柱温箱(30 ℃);淋洗程序:淋洗液2 mmol/L,流速0.45 mL/min,120 min。流动相:A为去离子水;B为0.25 mol/L氢氧化钠;C为1 mol/L NaAc。流速0.45 mL/min,上样量25 μL。
1.3.3.2 HEBG单糖组成分析
按照陈忠秋等[10]的方法,将HEBG进行酸水解后加入甲醇氮气吹干,然后超纯水溶解取25 μL用高效阴离子色谱检测。标准单糖为阿拉伯糖、半乳糖、葡萄糖、甘露糖、果糖混合标样。
1.3.4 HEBG一级结构的测定
1.3.4.1 傅里叶变换红外光谱测定
采用溴化钾压片法[11],将研磨好的多糖样品跟KBr混合均匀后压片,然后在400~4 000 cm-1波数范围内进行傅里叶变换红外光谱扫描,鉴定主要官能团。
1.3.4.2 高碘酸氧化实验
高碘酸钠消耗量标准曲线[12]绘制方法:将0.15 mo1/L的高碘酸钠和碘酸钠溶液以不同比例混合,取混合溶液0.2 mL,稀释到50 mL在223 nm波长处测吸光度,以混合后溶液中的高碘酸钠浓度为横坐标,吸光度为纵坐标,得高碘酸钠消耗量标准曲线。
精确称取多糖样品,加入0.015 mol/L的高碘酸钠溶液,置4 ℃反应,间或振荡,每隔24 h取样品0.1 mL,稀释至25 mL,以蒸馏水作空白,在223 nm波长处测定其吸光度,直至吸光度恒定,氧化反应结束,通过标准曲线计算HEBG的高碘酸钠消耗量;另取5 mL高碘酸氧化溶液,加乙二醇终止反应,以酚酞为指示试剂,用标定好氢氧化钠滴定甲酸的生成量。
1.3.4.3 Smith降解
将乙二醇处理后的透析液透析48 h,加入NaBH4暗处放置24 h;用50%的醋酸溶液调节反应液pH值至6~7,透析除去过量的NaBH4,冷冻干燥得到多糖醇产物[12]。将多糖醇产物采用糖腈乙酰化的方法处理后进行气相色谱分析。称取葡萄糖、赤藓醇、甘油作为标准品,同样糖腈乙酰化处理后进行气相色谱分析。
1.3.4.4 甲基化反应
HEBG的甲基化反应按3 步[5]进行:第1步,取5 mg HEBG完全溶解于无水二甲基亚砜(dimethyl sulfoxide,DMSO),与氢氧化钠和碘甲烷的混合溶液反应,反应液以蒸馏水萃取,流经Na2SO4柱,滤液用氮气吹干;第2步,将已经甲基化的HEBG以4 mol/L三氟乙酸水解,再以硼氘化钠还原3 h;第3步,加入0.5 mL乙酸酐于100 ℃进行衍生化反应,衍生物即为甲基化的多糖。甲基化的多糖以傅里叶红外光谱进行鉴定。羟基峰缺失可以证明多糖已完全甲基化。甲基化反应产物使用气相色谱-质谱进行分析。
1.3.4.513C NMR分析
参照文献[5]的方法,样品NMR通过质子去偶模式下25 ℃时测得,样品质量分数为9%,内标为四甲基硅烷,溶剂为DMSO-D6。
1.3.5 特性黏度的测定
采用乌氏毛细管黏度计(内径0.6~0.7 mm),测定多糖样品HEBG在蒸馏水中的特性黏度[η],温度控制在(25±0.1)℃。相对黏度(ηr)保持在1.2~2.2之内,使其所测黏度在牛顿流体范围内。特性黏度由Huggins和Kraemer方程求得[13]:

式中:K’为Huggins系数;K”为Kraemer常数;C为HEBG质量浓度/(mg/mL);ηr为相对黏度/(dL/g);ηsp为增比黏度(ηr-1)/(dL/g);特性黏度[η]为在无限稀释时的外推值/(dL/g)。以ηsp/C和lnηr/C分别为纵坐标,C为横坐标作图,得到两条直线,分别外推至C为0处,其截距就是特性黏度。
1.3.6 扫描电子显微镜观察
HEBG的固态表观形貌观察方法:取冷冻干燥好的大小厚度适合样品室要求的样品粘附于样品台上,置于离子溅射仪中镀一层导电金膜后,使用扫描电子显微镜于20 kV条件下观察[14],得到不同放大倍数下多糖的电镜照片。
1.3.7 原子力显微镜观察
参照文献[15]方法进行HEBG分析。将适量HEBG样品于蒸馏水中溶解,离心15 min,取上清液进行梯度稀释,配制成1 µg/mL的HEBG溶液。取样品溶液3.0 µL滴在新鲜解离的云母薄片上,室温下风干。采用Nano Scope IIIa原子力显微镜以轻敲模式室温下进行观察,接触作用力控制在3~4 nN之间,共振频率为2.0 kHz。
1.3.8 刚果红实验
参考文献[16]的方法,将HEBG和刚果红试剂配制成不同浓度氢氧化钠溶液混合,紫外分光光谱扫描,测量HEBG样品溶液的最大吸收波长。
1.4 数据分析
使用Microsoft Excel 2016和Origin 8.5对数据进行统计分析和图表绘制;采用MestReNova软件对NMR图谱进行分析和处理;采用Nano Scope Analysis软件对原子力显微镜图谱进行分析和处理。
2 结果与分析
2.1 HEBG分子质量

图1 HEBG高效液相色谱图Fig. 1 HPLC chromatogram of HEBG
由图1可知,高效液相图谱显示HEBG呈单一对称峰,HEBG的重均分子质量mw为7.504×105Da,数均分子质量mn为6.927×105Da,多分散系数mw/mn为1.083,表明分子质量分布均一且较为集中,说明水提醇沉法提取得到的HEBG为大分子质量且组分相对均一的多糖组分。
2.2 HEBG的单糖组成

图2 HEBG的离子色谱图Fig. 2 Ion chromatogram of HEBG
将混合单糖标样和水解后HEBG的产物经离子色谱分析,如图2所示,结果表明:HEBG完全由葡萄糖组成,是均一性葡聚糖。HEBG与黑木耳刚性链葡聚糖[17]和金钱菇β-葡聚糖[18]相同,完全酸水解后进行单糖检测,色谱图中只有葡萄糖吸收峰,为均一性葡聚糖。
2.3 HEBG傅里叶变换红外光谱

图3 HEBG傅里叶变换红外光谱图Fig. 3 Fourier transform infrared spectrum of HEBG
由图3可知,3 336.57 cm-1处的强吸收峰可归属为—OH的伸缩振动峰,说明HEBG存在分子间的氢键,而吡喃环内CH2对称伸缩振动峰以及—OH面内变形振动峰(1 424.31 cm-1)、CH2剪切振动峰(1 370.62 cm-1)、C—H变形振动峰和C—O键的伸缩振动峰(1 000~1 200 cm-1)的出现,表现出典型的吡喃糖傅里叶变换红外光谱图的吸收峰;出现在891.09 cm-1处的吸收峰为β构型多糖的异头碳伸缩振动峰,而且1 650~1 700 cm-1处没有羰基特征吸收峰,表明HEBG为中性吡喃糖。HEBG与桑黄[19]和黄伞菌多糖[20]红外图谱有很多相同之处,在890 cm-1左右均具有特征峰,说明含有β-吡喃糖苷键,且在1 400~1 200 cm-1附近都有吸收峰,说明其物质为糖类化合物,进一步表明HEBG为中性β-吡喃糖。
2.4 高碘酸氧化实验
将高碘酸钠和碘酸钠以不同比例混合后,在223 nm波长处测吸光度,得到高碘酸消耗量标准曲线:y=44.107x+0.283 7,R2=0.997 7。
将猴头菇多糖HEBG溶解于0.015 mol/L的高碘酸钠溶液中,从第1天开始测定吸光度,直至吸光度趋于稳定,反应达到平衡为止,将吸光度代入标准曲线,计算高碘酸的消耗量。结果表明:250 mg的HEBG样品反应10 d后测得高碘酸消耗量为437 mmol,生成甲酸的量为37.062 mmol。高碘酸氧化反应生成了少量的甲酸,说明结构中存在1→6位糖苷键,且高碘酸的消耗量远大于甲酸的生成量,表明结构中主要存在1→3位糖苷键。该结果与香菇β-葡聚糖[5]检测结果相同,都含有1→3位糖苷键和1→6位糖苷键;与杏鲍菇β-葡聚糖[12]主要含有1→4、1→6位糖苷键不同,原因可能是菌菇品种、提取方法的不同导致的。
2.5 Smith降解反应
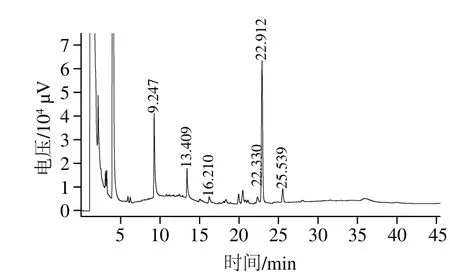
图4 HEBG Smith反应气相色谱图Fig. 4 GC chromatogram of the Smith reaction products of HEBG
经过高碘酸氧化后生成不同的产物,将氧化产物用硼氢化合物还原成稳定的多羟基化合物,再经过水解和乙酰化,经气相色谱分析产物结果如图4所示,出现在9.247、13.409 min和22.912 min的3 个峰分别为甘油、赤藓醇和葡萄糖。结果表明:HEBG组分气相色谱图中含有甘油峰和赤藓醇峰,说明结构中存在1→2或者1→4,1→6糖苷键,而高碘酸氧化实验中有甲酸生成,表明多糖中含有1→6糖苷键,因此HEBG结构中存在1→6位键合的糖基。产物中还检测到大量的葡萄糖,说明主要存在以1→3位键合的糖基,因此可以推断出HEBG主链由1,3-葡萄糖残基(1,3-Glu)组成,支链是由1,6-Glu组成。与HEBG结构不同,Peng Yanfei等[21]从黄芪中提取出一种水溶性β-葡聚糖GTM5,其主链由1,6-Glu组成,支链则是由1,3-Glu组成。
2.6 甲基化实验结果
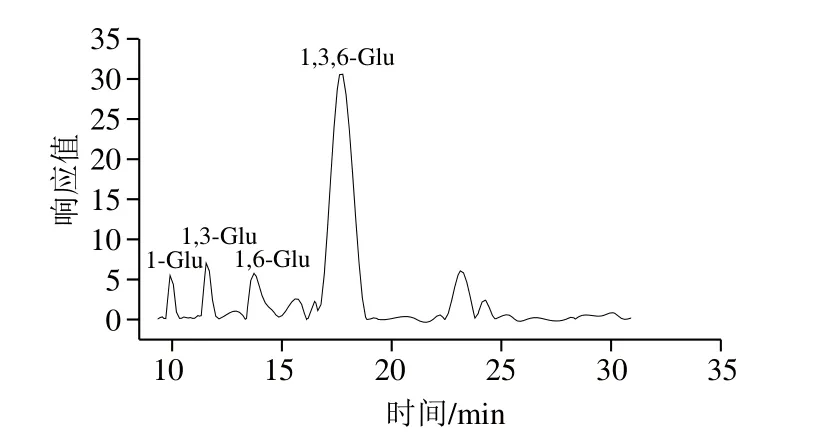
图5 甲基化反应后HEBG的气相色谱-质谱图Fig. 5 GC-MS chromatogram of methylated HEBG

表1 HEBG的甲基化分析结果Table 1 Analysis of methylated HEBG
甲基化的HEBG样品经酸水解、还原、乙酰化、气相色谱-质谱分析,结果如图5所示,统计结果见表1。甲基化产物主要由4 部分组成,分别对应与1-Glu、1,3-Glu、1,6-Glu和1,3,6-Glu。其中1-Glu为端基单元,1,3-Glu为主链线性连接单元,1,6-Glu为支化单元。而且1,3-Glu与1,6-Glu的含量比例约为1∶1,结合高碘酸氧化实验结果分析可推断HEBG组成为β-1,3-葡聚糖,并含β-1,6-Glu支链结构,约为每5 个β-1,3-Glu带有5 个β-1,6-Glu,即其物质的量比为1∶1。李盛等[5]对香菇β-葡聚糖进行甲基化研究,其结果表明每5 个β-1,3-Glu带有2 个β-1,6-Glu[22];Oliveira等[23]从真菌中分离出一种β-1,3-1,6-葡聚糖PEPS,每5 个β-1,3-Glu带有5 个β-1,6-Glu;甲基化分析结果与本实验都有很大相似之处,不过葡聚糖支链连接位点及糖苷键数目有不同之处。
2.7 NMR波谱分析
图6为HEBG的13C NMR谱,存在10 个强的位移峰,δ 103.43处的位移峰为异头碳(C-1)峰,通常β异头碳连接的多糖C-1峰高于δ 100而α异头碳连接的多糖C-1峰低于δ 100,表明HEBG不含α型多糖。HEBG在低场范围(δ 160~200)未出现位移峰,表明不存在羰基峰,进一步证明HEBG为中性多糖,这与傅里叶红外光谱分析结果相吻合。

图6 HEBG的13C NMR谱图Fig. 6 13C NMR spectrum of HEBG

图7 HEBG的HMQC谱图Fig. 7 HMQC spectrum of HEBG in DMSO-d6
HEBG的1H-13C异核多量子相关(heteronuclear multiple quantum correlation,HMQC)光谱包含6 个交叉峰,表明HEBG是一种线性葡聚糖;HEBG在δ 103.1存在低场位异构碳,表明HEBG由β-吡喃葡萄糖单元组成,证明HEBG是线性葡聚糖组成的多糖,这与傅里叶变换红外光谱结果一致。如图7所示,在δ 103.1、86.3、76.6、73.1、68.6、61.1有6个交叉峰,这些C的位置分别为C-1、C-3、C-5、C-2、C-4和C-6,也说明HEBG是一种线性1→3为主键连接的β-葡聚糖;HMQC谱图中C-1对应的H1位移峰位置为δ 4.19,是β异头碳上的H原子,证明HEBG为β型葡聚糖;出现在61.1(C-6)的两个交叉峰是由于β-D-Glu单元携带6-O取代产生的化学位移导致的,说明HEBG中存在1→6位糖苷键,与高碘酸和Smith实验结果相吻合。综合以上分析结果可以看出HEBG主链由1,3-Glu组成,支链是由β-1,6-D-Glu组成。Kagimura[24]、Nitschke[25]等分别从真菌和食用菌中分离出均不含α型多糖[26]的β-1,6-葡聚糖和β-1,3-1,6-葡聚糖,并通过NMR仪进行结构鉴定,对葡聚糖中碳和氢峰位置进行归属,其结果与HEBG有很多共同之处。
综上所述,HEBG的主链重复单元可能为:

2.8 HEBG刚果红实验结果

图8 氢氧化钠浓度对HEBG与刚果红络合物最大吸光度波长的影响Fig. 8 Effect of NaOH concentration on maximum absorption wavelength of Congo red-BCP complex
刚果红溶液可以与具有三螺旋构象的多糖形成络合物,络合物的最大吸收波长发生红移,即在低浓度氢氧化钠范围内出现亚稳区,多糖-刚果红络合物的最大吸收波长较刚果红明显增大,根据这种变化可以判断多糖是否存在螺旋结构。HEBG在不同浓度氢氧化钠溶液条件下与刚果红试剂反应,最大吸收波长的变化如图8所示。HEBG在氢氧化钠浓度为0~0.3 mol/L范围内产生红移,说明HEBG与刚果红形成了络合物,证明HEBG中存在三螺旋结构。研究表明酵母β-葡聚糖[16]、香菇β-葡聚糖[5]在溶液中呈三股螺旋结构,并且在刚果红溶液中都发生特征性红移,本实验中HEBG也发生了红移,也表明HEBG在溶液中存在三股螺旋结构。
2.9 特性黏度的测定结果

图9 HEBG在水溶液中的Huggins和Kraemer直线Fig. 9 Typical Huggins and Kraemer plots of HEBG in aqueous solution
由图9可知,Huggins和Kraemer方程外推到零浓度,即可得到多糖组分HEBG在水溶液中的特性黏度3.02 dL/g。Huggins常数K′反映了在溶液中多糖分子之间的相互作用,通常认为,聚合物在良溶剂内,K’在0.3~0.4范围内,当K’大于0.8,大分子聚合物很可能产生聚集[27]。在本实验中,HEBG在蒸馏水溶液中的Huggins常数为1.54,远大于0.8,因此葡聚糖分子间发生了聚集。与香菇葡聚糖[5]、燕麦葡聚糖[6]在水溶液中均以无规线团状存在相比较,HEBG在水溶液中的特性黏度与香菇和燕麦葡聚糖相差不大,因此HEBG分子在水溶液也是以无规则线团缠绕的构象存在[28]。
2.10 显微结构分析
2.10.1 扫描电子显微镜观察结果

图10 HEBG的扫描电子显微镜图Fig. 10 SEM image of HEBG
由图10可看出,HEBG呈卷曲、折叠形状,并伴随丝状结构以及无规线团状结构,结构致密,形成了不规则聚合体,并且会形成薄膜状结构。从图10可以观察到线性的多糖链以及多条链的聚集体,链聚集体的直径约为2 μm,远大于单链直径的理论值0.1~1.0 nm,说明葡聚糖分子间存在较强的相互作用,在固体状态下多以较大的聚集缠绕态存在。该结果与燕麦β-葡聚糖在高倍镜下形成的具有一定规整性的细微网络结构[14]不同,造成这种差异的原因可能是分子质量的不同以及分子链间作用力[29]的强弱不同。
2.10.2 原子力显微镜观察结果
从图11可以观察到大小不均一并且形状不同的多糖聚合体,且HEBG均匀的分布在云母片上,其组分宽度大概在1.9 nm,分子链直径为(0.55±0.11)nm,与理论上多糖单链直径理论值0.1~1.0 nm相符。并且HEBG呈现出明显的链状、网状,且具有分支结构,这种现象可能是由于多糖分子间氢键的相互作用使得多糖链之间呈聚集状态。HEBG分子链尺寸与燕麦β-葡聚糖宽5~10 nm,高2~3 nm[14]相差很大,造成这种差异的原因可能是多次乙醇醇洗沉淀使得多糖聚合体把卷曲的链打开,一些小分子的多糖被释放出来,从而在水中的溶解性、分散性较好。

图11 HEBG的原子力显微镜图像Fig. 11 AFM image of HEBG
3 结 论
本实验采用高效液相色谱对猴头菇多糖HEBG分子质量进行测定,结果表明HEBG重均相对分子质量为7.504×105,单糖分析和傅里叶变换红外光谱分析表明HEBG完全由β-D-葡萄糖组成。高碘酸氧化、Smith降解、甲基化反应以及NMR波谱分析表明:HEBG的化学结构为β-1,3-D-葡聚糖,并含有β-1,6-D-Glu的支链,且1,3-Glu与1,6-Glu的物质的量比为1∶1。HEBG的特性黏度和刚果红实验表明HEBG分子在水溶液中以三股螺旋结构和无规则线团结构两种构象存在。通过扫描电子显微镜和原子力显微镜观察,直观地观察到多糖在固态下无规线团聚集形态和极稀溶液下的链状分支结构。通过对HEBG的结构和分子链构象的研究,为进一步研究HEBG生物活性以及构效关系提供参考基础,同时也为HEBG应用到食品和化妆品中提供理论依据。

