不同PRRS弱毒苗免疫血清对FcγRIIb介导ADE效应的影响
余建国 曾容愚
(1.金华职业技术学院 浙江金华 321007;2.天康生物股份有限公司 乌鲁木齐 832003)
猪繁殖与呼吸综合征(PRRS)是由PRRSV引起的猪的一种繁殖障碍和呼吸道传染病。临床以商品猪表现呼吸障碍,怀孕母猪表现死胎、木乃伊胎、弱胎。该病于1987年在美国首次被报道[1],德国、英国、荷兰、西班牙等欧洲国家相继报道了该病的发生,进而在全球的养猪国家暴发了该病。该病病原为PRRS病毒(PRRSV),荷兰学者首次分离到欧洲型PRRSV代表毒株,北美学者相继分离到北美型PRRSV代表毒株ATCC-VR2332。郭宝清等于1996年在我国首次分离到该病毒。
抗体依赖性增强作用 (Antibody-dependent enhancement,ADE)是指某些病毒以对应特异抗体处理后,病毒复制或感染能力显著增强的现象。宿主被病毒感染后,免疫系统可以产生相应的免疫应答反应。此时产生的针对病毒表面蛋白的特异性抗体常常可以阻止病毒粘附于宿主细胞表面,使其失去感染细胞的能力。然而在有些情况下,抗体在病毒感染过程中却发挥相反的作用,它们协助病毒进入靶细胞,提高感染率,这一现象就是抗体依赖性增强(ADE)作用,在用肺泡巨噬细胞培养PRRSV时,加入少量血清可显著提高病毒复制水平[2]。对蓝耳病病毒的ADE现象发现相对较晚,病毒大多表现为嗜好在巨噬细胞中繁殖和容易引发宿主的持续性感染,用常规疫苗免疫来防控这类具有ADE效应的病毒病时常常难以奏效,一般认为:ADE作用是影响PRRS疫苗效果的主要障碍和研发疫苗必须考虑的主要因素。
ADE现象最早由Hawkes在20世纪60年代报道[3]。仇华吉等研究指出,注射亚水平的PRRSV中和血清滴度,比注射中和水平的IgG更容易诱发猪发生病毒血症[4];田克恭等研究了血清对感染PRRSV的巨噬细胞中病毒颗粒增殖数量影响,结果表明含有亚中和水平PRRS抗体的抗体处理组与PRRS抗体阴性血清处理组相比差异极显著,即当PRRS抗体低水平存在时,病毒的增殖显著增强[5]。一般认为:Fc受体(FcR)介导的ADE作用被认为是最常见的ADE作用机制[6]。此外,病毒-抗体-补体复合物通过与靶细胞上的CR2作用增强了粘附;病毒粒子上补体成分的沉积有助于病毒囊膜与细胞膜的融合;通过FcR或CR,使补体活化产物和细胞内的信号转导对靶细胞产生刺激效应 (例如增强胞吞作用),抗体或可溶性CD4在中和浓度以下时可以使gp120活化,促进病毒囊膜与细胞膜的融合。当血清不能完全中和病毒时,抗原抗体复合物通过FcγR介导,病毒对宿主细胞的侵入能力增强,从而表现低抗体水平时,发病率增加。
PRRS弱毒苗诱导抗体依赖性增强作用(ADE)效应,被认为是影响疫苗效果的障碍之一。猪群受到PRRSV野生毒株感染后,群体内免疫水平参差不齐,不同个体的ADE差别很大;另外,通过母源抗体获得对PRRS被动免疫的仔猪,一旦抗体水平下降至保护性水平以下(亚中和水平),PRRSV就会表现ADE活性,从而增加动物感染和发病的危险。PRRSV的ADE效应与感染细胞表面的Fc受体(FcγRIIb)介导有关,杨青原等研究证实:用 FcγRIIb多抗能够弱化ADE效应[7]。但该研究未确认临床常用疫苗与Fc受体介导的关联性,也未提示不同疫苗抗体在弱化效果中是否存在差异性。
PRRSV具有严格的细胞嗜性,肺泡巨噬细胞(Pulmonary alveolar macrophage,PAM) 为其天然靶细胞。本试验拟以三种不同蓝耳病弱毒苗为对象,以PAM细胞感染为载体,研究不同抗体免疫复合物对FcγRⅡb受体介导ADE效应的影响,并探索其机制。
1 材料与方法
1.1 材料
1.1.1 毒株与试验动物 HP-PRRSV田间分离株(ZJ-2014株,TCID50为 105.0/0.1mL)由上海兽医研究所惠赠;PRRSV双阴性25日龄健康仔猪45头,购自金华某猪场。
1.1.2 疫苗及抗体 HP-PRRS弱毒苗兰特威(TJM-F92株,北京某公司生产);蓝克清(R98株,南京某生物技术公司生产);蓝定抗(CH-1R株,福建某公司生产,市购)。IgG、兔抗猪IgG、PRRSV特异性抗体 IgG、兔抗猪FcγRⅡ血清,均由上海兽医研究所兽医微生物研究室惠赠。
1.1.3 主要试剂 DNTPs、GraphPad Prism5软件等市购;新生犊牛血清为上海快灵生物工程有限公司产品。
1.2 试验方法
1.2.1 PAM细胞制备 选25日龄健康仔猪,放血致死后无菌摘取猪肺脏,在肺器官侧壁剪开一个端口,止血钳夹住端口稍下位置,用含2 000 IU青霉素、链霉素的1640营养液清洗肺脏,灌洗时注入约100 mL1640(以灭菌纱布包裹血管口,以防血液进入收集瓶),连续多次,直至洗出的1640液透明清亮。将灌洗液2 000 r/min离心20 min,用1640液重悬洗涤PAM细胞2次,最后加入含10%新生牛血清的RPMI1640培养液中,调整细胞浓度至106个/mL,加入24孔细胞培养板中,0.5 mL/孔,37℃约6 h,弃去未贴壁的细胞,用DPBS洗板1次,加入新的营养液置于37℃培养。培养2 h后从细胞培养箱中取出细胞板,弃掉旧培养液,用PBS轻轻润洗2次,加入新的RPMI1640完全培养液。以后每24 h更换1次新鲜培养液,连续培养20 d。
将培养皿中的细胞培养液弃掉,用PBS冲洗2遍后,加入0.25%胰酶消化4 min后加入完全培养基终止反应,将细胞悬液移至15 mL离心管中,1 000 r/min,离心5 min,弃去上清,将4℃预冷的冻存液加入15 mL离心管中,吹打使细胞重悬于冻存液中,分装于细胞冻存管中(1 mL/管)并标记,使用前经解冻复苏备用。
1.2.2 疫苗免疫血清复合物的制备 将2.68 mg/mL猪 PRRSV阳性 IgG作倍比 (21~24)稀释后,与200 TCID50/100μL病毒液等体积混合均匀,在37℃孵育60 min,制成三种不同浓度的疫苗免疫复合物。
1.2.3 不同浓度特异性抗体PRRSV增殖影响试验将上述1.2.2方法中倍比稀释的三种疫苗血清复合物接种到PAM 细胞上,每孔200 μL。并设置接毒细胞对照(对照组加阴性血清),接毒细胞加入200个TCID50的 PRRSV(ZJ-2014 株)病毒液 200 μL。每个稀释度做3孔平行对照。37℃吸附1 h后弃去上清,用灭菌PBS液漂洗1次,而后加入含10%血清的RPMI1640 培养液,0.5 mL/孔,5%CO2、37 ℃细胞培养箱中培养。补加含10%新生牛血清的RPMI1640细胞营养液各0.3 mL,置37℃、5%CO2培养箱中分别培养24 h和48 h后取出细胞培养板,-20℃冻存。裂解PAM细胞后提取细胞RNA,用段二珍等建立的PRRSV实时定量PCR检测方法,检测PRRSV拷贝数[8]。
1.2.4 PRRSV在不同时间段的增殖 将浓度为1.30 mg/mL的三种疫苗血清免疫复合物分别处理PAM细胞,并设置接毒细胞对照(对照组以阴性血清处理PAM细胞),接毒细胞加入200个TCID50的PRRSV(ZJ-2014 株)病毒液 200 μL。
1.2.5 FcγRⅡb多抗阻断Fc介导ADE作用试验用含10%新生牛血清的1640培养基将PAM细胞稀释至106个/mL,按500 μL/孔接种到24孔细胞培养板中,置37℃、5%CO2细胞培养箱中培养过夜。待细胞贴壁牢固,吸去培养基,用无菌PBS轻轻漂洗2次。向试验组每孔加入1:100倍稀释的兔抗猪FcγRⅡ血清 (经56℃、30 min以消除补体作用,其余孔加无血清1640培养液,500 uL/孔,37℃下作用1 h后倒掉血清和培养基,用PRRSV(ZJ-2014株)病毒 104.8TCID50与 1:128稀释的抗 PRRSV阳性血清混合(每种疫苗血清做三个平行对照),37℃下孵育1 h,加入细胞板中,每孔500 uL。
设病毒感染对照,37℃、5%CO2条件下培养 1 h后,弃掉病毒与抗体复合物,加入含2%新生牛血清的培养基作为维持液。感染24 h后收毒,用PAM细胞测定病毒的TCID50,计算收获病毒量的差异,检测兔抗猪FcγRⅡ血清对ADE的阻断效果。
1.2.6 数据处理方法 PRRSV拷贝数通过建立的标准曲线进行进行绝对定量检测。数据运用GraphPad Prism5软件进行处理。
2 结果与分析
2.1 不同浓度疫苗血清对PRRSV增殖的影响 以PRRSV实时定量PCR方法,分别检测感染各组PRRSV的RNA水平。参照说明书推荐的25 μL反应体系:SYBRPremix Ex Taq (Tli RNaseH Plus)12.5 μL、上下游引物(10 pmol/μL)各 0.5 μL、cDNA 2 μL,加ddH2O补至25 μL。 每个样品做3个重复,并选择3孔不加样品只加水作为阴性对照。各管充分混匀置于Eppendorf Mastercycler ep realplex 4荧光定量PCR仪中。反应条件:95℃预变性30 s;95℃变性5 s;60℃退火34 s,共40个循环。mRNA的相对表达水平采用2-△△Ct计算分析。
当免疫复合物作1:4稀释时,PRRSV在PAM细胞中的增殖数量明显增多,当浓度为0.68 g/L时,PRRSV增殖速度比纯病毒感染PAM细胞显著提高,病毒含量相差约20.5倍。试验提示:一定浓度的疫苗抗体能够显著增强PRRSV的增殖(见图1)。
2.2 PRRSV在不同时间段的增殖情况 同一稀释度下 (0.68 g/L),疫苗免疫复合物在PRRSV感染PAM 细胞的不同时间(12、24、36 、48 h)内,能促进PRRSV的增殖,在感染48 h时PAM细胞中的病毒含量较无感染性免疫复合物组高18.47~87.25倍,在感染36 h时PAM细胞中的病毒含量较无感染性免疫复合物组PRRSV增殖差异最大达到88.25倍,说明质量浓度为0.68 g/L感染性免疫复合物在48 h内能够增强PRRSV的增殖,在36 h时作用最强(见图 2)。

图1 不同浓度疫苗血清对PRRSV增殖的影响
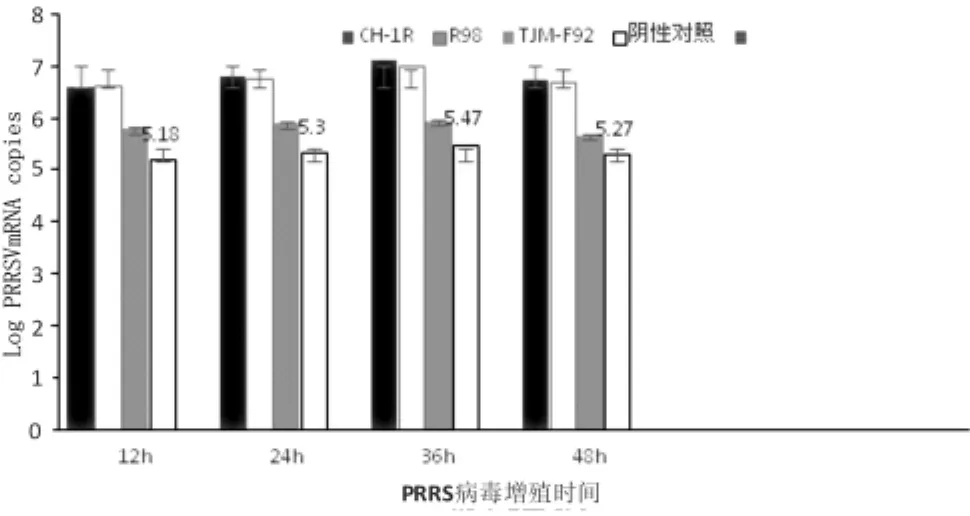
图2 不同时间段PRRSV增殖情况
2.3 FcγRⅡb多抗阻断PAM介导ADE作用结果FcγRⅡb多抗对三种疫苗免疫复合物诱发的ADE效应都有一定的弱化作用,其中TJM-F92株免疫血清的ADE效应最弱,可能是该毒株疫苗结构片段与FcγRⅡb的结合能力有关。
图3 三种疫苗血清对ADE效应的弱化作用
3 讨论与小结
1)据报道,PRRSV只在表达的FcγRⅡ细胞才发生ADE现象,本试验在选取试验材料时充分考虑了这一观点。研究发现,免疫血清能通过FcγR介导增强靶细胞的吞噬作用,使得抗原-抗体复合物更易进入胞内[9]。IgG能激活巨噬细胞表面的Fc段IgG受体并与其结合,从而增加PRRSV进入巨噬细胞的机会,增强巨噬细胞的易感性。试验结果提示,三种疫苗血清均能影响FcγRⅡb多抗处理过的病毒增殖反应,弱化ADE效应,说明三种疫苗血清IgG均存在FC受体活性片段,这与上述研究结论是一致的。
2)TJM-F92疫苗株(NSP2基因缺失)免疫猪体后,能较好地刺激机体产生IL-12,从而抑制野毒在患猪体内的复制。PRRSV感染后的PAM细胞,炎性因子IL-12的生长会受到抑制。IL-12是促进细胞介导免疫应答的细胞因子,同时还可以调节T细胞和巨噬细胞的分化,实现对体内PRRSV复制的抑制效应。研究发现:PRRSV抑制宿主机体产生IL-12,用重组猪IL-12体外刺激感染PRRSV的猪肺泡巨噬细胞(PAMS)后,细胞中IFN-γ水平升高,猪肺泡巨噬细胞中PRRSV滴度降低[10]。
3)本试验中TJM-F92株疫苗血清对ADE效应表现出较好的弱化效果,推测是该疫苗在刺激抗体产生的同时,一方面它对机体产生IL-12的活性作用较强;另一方面在该疫苗刺激下影响调控信号通路。有报道认为,NSP2基因缺失会降低TLR2和TLR4的分泌,从而使猪体内FcγRⅡ受体蛋白表达增强,因此表现了超强的ADE弱化效应。是否还存在其他机制,有待进一步研究。

