脑缺血再灌注后内质网应激对听皮层的损伤作用及机制
吕哲 张颖 时美娟 孟晴 宋永周
(河北医科大学第二医院 1耳鼻咽喉科,河北 石家庄 050000,2骨科)
脑缺血再灌注可导致神经细胞缺氧、酸中毒、大量自由基蓄积及能量耗竭,从而引发内质网应激(ERS)〔1,2〕。但是持久的ERS会激活凋亡通路,细胞凋亡产生,形成恶性循环。作为听觉系统的最高级中枢,听皮层属于大脑皮质的一个亚皮质区域。在临床工作中许多脑卒中患者会出现听力缺失〔3〕。由于神经细胞的退行性变和凋亡,很多患者会出现对声音的处理、认知力下降。在以前的研究中,脑缺血再灌注后听力损伤研究焦点多数都集中于耳蜗组织学改变,而对中枢系统的改变则研究甚少〔4~6〕。本研究建立局灶性脑缺血再灌注模型,观察ERS相关因子天冬氨酸特异性半胱氨酸蛋白酶(Caspase)-12、葡萄糖调节蛋白(GRP)78在听皮层的表达变化,探讨脑缺血再灌注对ERS及其诱导的凋亡导致听功能损害的机制。
1 材料与方法
1.1动物分组 将30只健康雄性SD大鼠随机分为Sham组,缺血再灌注组,每组15只,体重250 g左右,无噪声暴露史,标准饲料喂养。
1.2试剂和仪器 兔多克隆抗GRP78及Caspase-12抗体(Santa Cruz公司),2,3,5-三苯基四唑氮红(TTC,美国Sigma公司),TUNEL法原位检测细胞凋亡试剂盒、免疫组化检测试剂盒(博士德生物工程公司),羊抗兔IgG抗体(美国Abcam公司),听性脑干反应(ABR)电位仪(美国TDT公司)。
1.3方法
1.3.1动物模型制备 大鼠麻醉后,仰卧位固定于手术台上,备皮消毒后,于颈部正中行1 cm切口,钝性分离后显露胸锁乳突肌,分离颈总动脉、颈外、颈内动脉,结扎颈外动脉,于距颈总动脉分叉处2 mm剪一小口,插入线拴,进线长度为(18.5±0.5)mm。当感到进线有轻微阻力时停止。扎紧固定插线。阻断60 min后轻柔拔出线栓。缺血再灌注24 h后进行检测并处死、取材。Sham组只分离颈部血管,不插入线栓。
1.3.2神经功能缺损评分 采用单盲6级5分法。正常为0分,垂直提尾时对侧前肢不能完全伸展为1分;2分:垂直提尾时屈曲对侧前肢;3分:行走时轻度向瘫痪侧转圈;4分:行走时严重向瘫痪侧转圈;5分:不能自主行走,向对侧跌倒。
1.3.3ABR检测 大鼠麻醉后置于隔声屏蔽室内,参考、接地电极置于两侧乳突皮下,记录电极刺入颅顶皮下。选用10 ms短纯音作为诱发ABR的刺激信号,上升下降时间为5 ms,重复率21.1次/s〔7〕。从90 dB声压(SPL)开始, 5 dB SPL下降一档。以Ⅲ波反应阈作为ABR听阈。检测时间为造模前及造模后24 h。
1.3.4脑梗死体积测定 每组取5只大鼠,断头处死后,完整取出脑组织,将大脑沿冠状面切成5片后置入TTC溶液中,37℃细胞培养箱中温育30 min。注意每5~8 min将切片翻面使两面着色均匀。待显色完全后放入4%多聚甲醛中固定24 h。正常组织表现为均匀红色,梗死区表现为苍白区。数码单反相机拍照,图像分析软件测定脑梗死体积。
1.3.5听皮层组织学改变观察 大鼠以4%多聚甲醛快速灌注后取脑,切取听皮层后石蜡包埋切片。后经脱蜡,苏木素染核,盐酸酒精分化,伊红复染胞质,封片后观察组织学改变。
1.3.6TUNEL检测凋亡神经细胞 将上述步骤制作的脑组织切片脱蜡至水化,0.3%过氧化物氢封闭内源性过氧化酶活性, 加入蛋白酶K室温孵育30 min,滴加50 μl TUNEL反应混合液,37℃避光孵育1 h,磷酸盐缓冲液(PBS)冲洗3次,加入50 μl酶标记抗荧光素抗体,37℃避光孵育1 h。然后加入100 μl二氨基联苯胺(DAB)底物溶液,苏木素复染,常规封片观察。400倍光镜下随机取5个不重复视野观察,计算神经细胞凋亡指数(AI)=(凋亡细胞数/总细胞数)×100%。
1.3.7免疫组化法测定Caspase-12、GRP78表达 大鼠麻醉后断头取脑,置于4%多聚甲醛固定,酒精梯度脱水,二甲苯透明后石蜡包埋切片。采用免疫组化ABC法染色,DAB显色,苏木素复染,封片、镜检,采用Image-Pro Plus6.0软件进行图像分析。
1.3.8Western印迹检测 麻醉后迅速取梗死侧听皮层,提取蛋白并测定浓度。每孔加入80 μg总蛋白,经电泳分离,转膜封闭后加入Caspase-12、GRP78抗体,37℃反应1 h。TBST洗膜,加入羊抗兔IgG抗体,37℃反应1 h ,凝胶成像仪扫描并进行灰度分析,计算各目的条带相对表达量。
1.4统计学方法 采用SPSS16.0软件进行单因素方差分析。
2 结 果
2.1神经功能评分、TTC染色 Sham组行动自如,反应敏捷,饮食正常。缺血再灌注组大鼠食欲差,精神萎靡,出现对侧肢体瘫痪,转圈及不同程度的前肢屈曲等症状。两组神经功能评分差异有统计学意义(P<0.01),表明缺血再灌注后出现明显的神经功能障碍。Sham组TTC染色无梗死灶,缺血再灌注组则可见明显梗死灶,两组梗死体积差异有统计学意义(P<0.01),见表1、图1。

表1 两组神经功能评分、脑梗死体积、AI比较

图1 两组脑组织TTC染色
2.2ABR检测 Sham组造模前反应阈为(24.83±4.05)dB SPL,造模后为(26.40±5.25)dB SPL,差异无统计学意义(t=-1.143 8,P>0.05)。缺血再灌注组造模前为(24.88±3.80)dB SPL,造模后为(54.60±3.26)dB SPL,差异有统计学意义(t=-23.273 5,P<0.010)。造模前两组差异无统计学意义(t=-0.333 4,P>0.05)。造模后两组比较差异有统计学意义(t=-17.608 3,P<0.001)。
2.3HE染色观察 Sham组细胞形态大致正常(细胞核大而圆,核染色质均匀清楚,核仁明显),仅表现为极少量异形细胞(细胞排列稀疏,胞核固缩碎裂,胞质浓缩)。与Sham组相比,缺血再灌注组异形细胞数目增多(图2)。
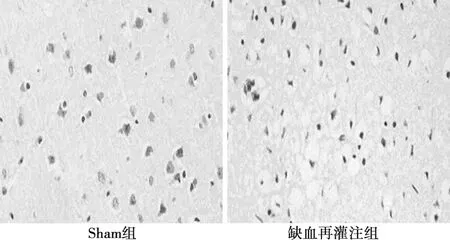
图2 听皮层神经细胞HE染色(×200)
2.4TUNEL染色检测细胞凋亡比较 TUNEL染色显示,Sham组偶见凋亡细胞,缺血再灌注组细胞核浓缩深染,可见凋亡小体、DNA片段化,提示缺血再灌注组诱导了细胞凋亡发生。两组AI比较,差异有统计学意义(P<0.01),见图3,表1。
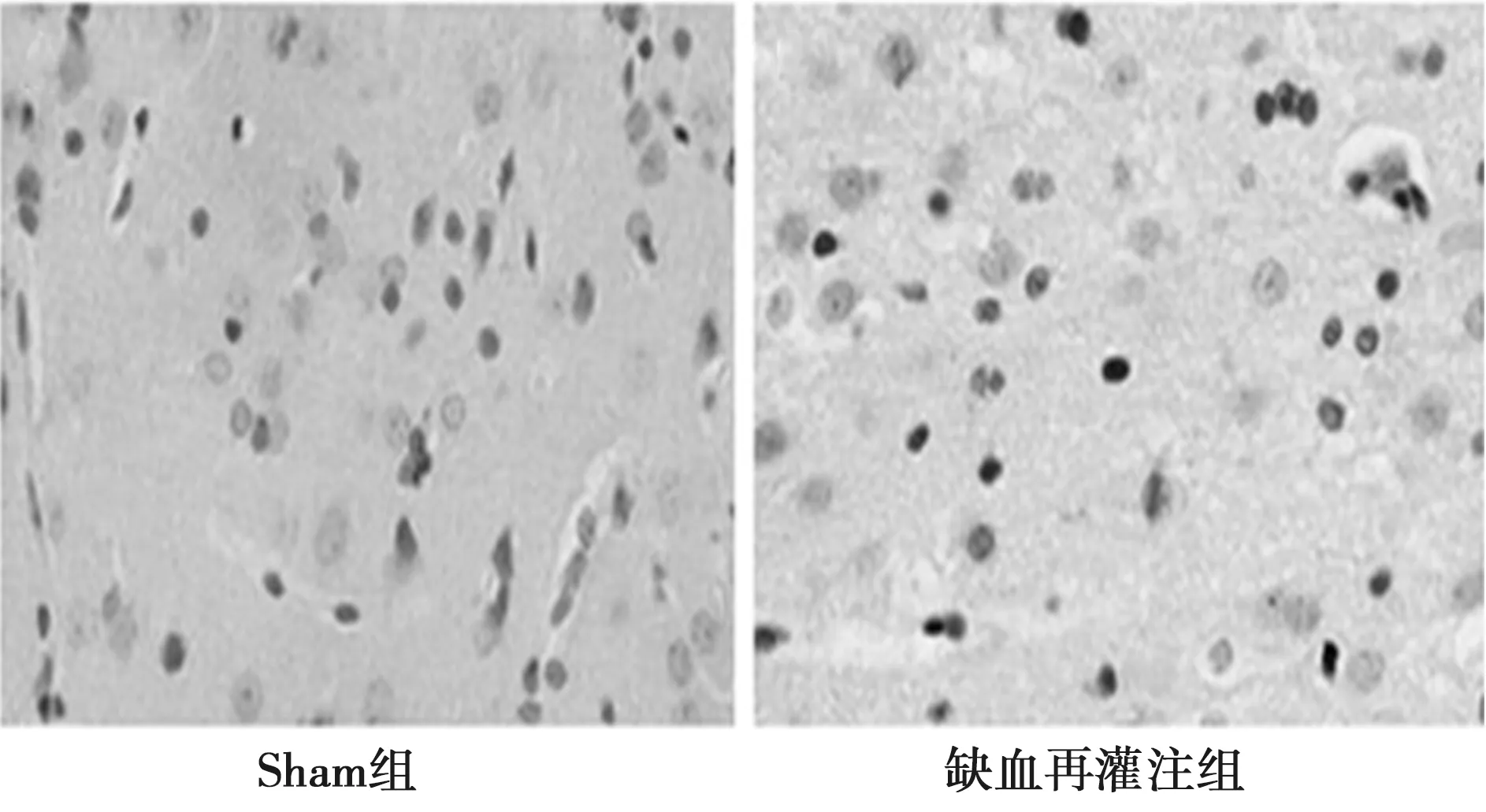
图3 听皮层神经细胞TUNEL染色(×200)
2.5免疫组化染色检测Caspase-12、GRP78表达 光镜下观察Caspase-12免疫组化染色结果,染色阳性细胞呈深棕色,胞质表达为主。与Sham组比较,缺血再灌注组阳性细胞明显增多,表达上调(P<0.01)。GRP78抗原阳性细胞呈棕黄色,多数细胞形态有改变。缺血再灌注组表达较Sham组明显上调(P<0.01),见图4、图5,表2。
2.6Western印迹检测 Sham组大鼠Caspase-12、GRP78蛋白微弱表达,条带较弱,缺血再灌注组则表达明显升高,两组表达差异比较均有统计学意义(P<0.01),见图6,表2。

图4 听皮层神经细胞GRP78免疫组化染色结果(×200)
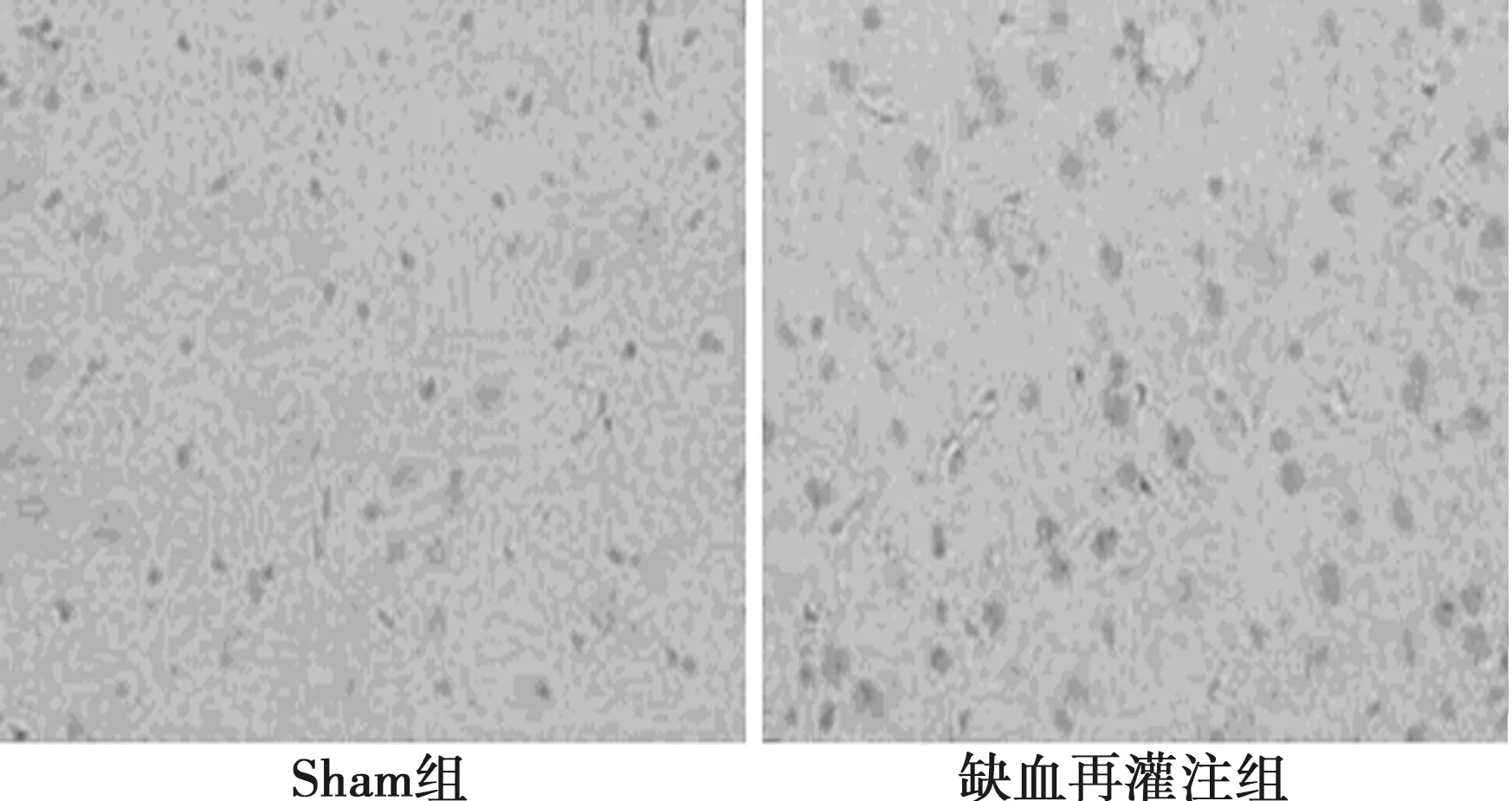
图5 听皮层神经细胞Caspase-12免疫组化染色结果(×200)
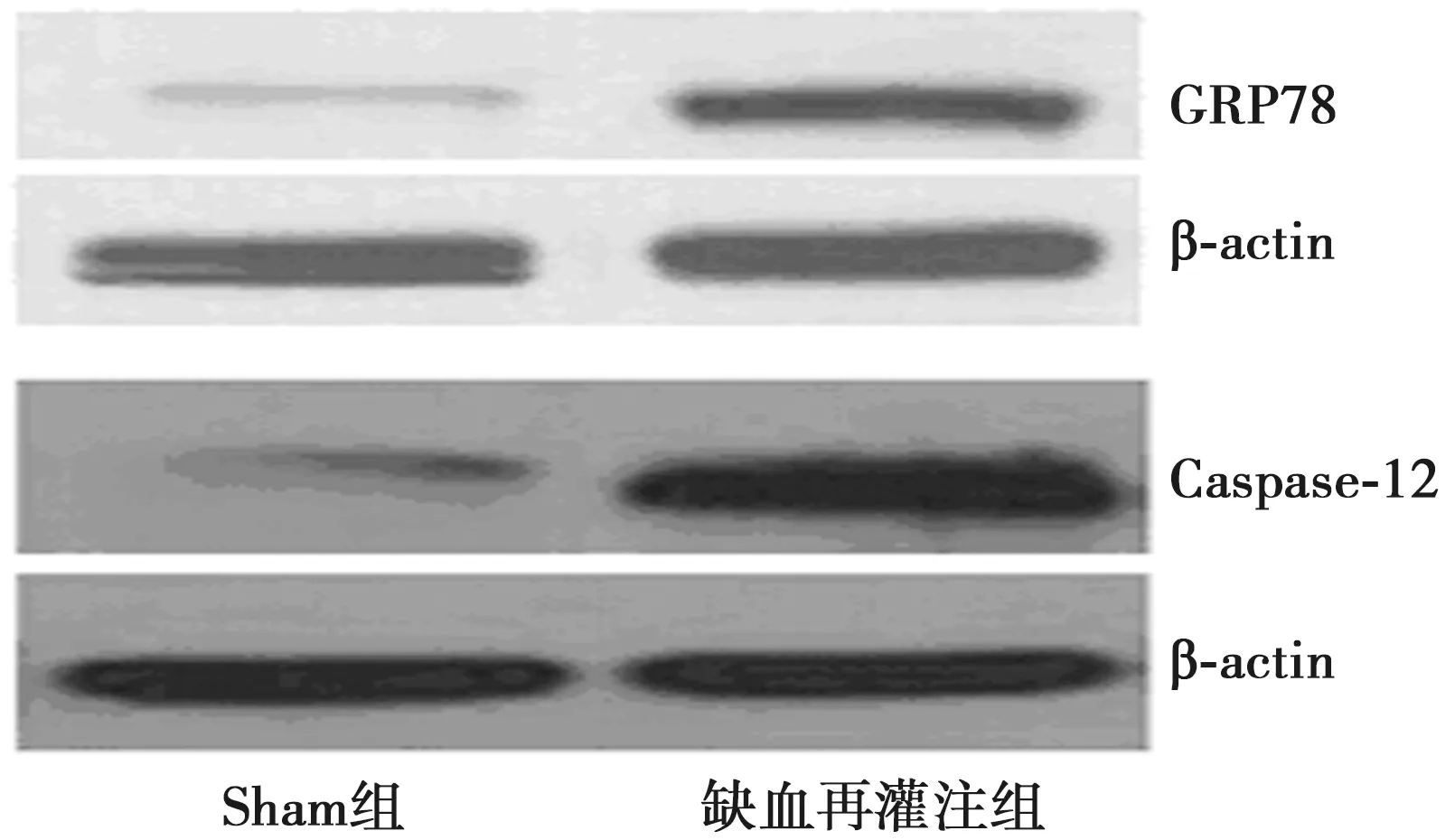
图6 Western印迹检测GRP78和Caspase-12蛋白表达
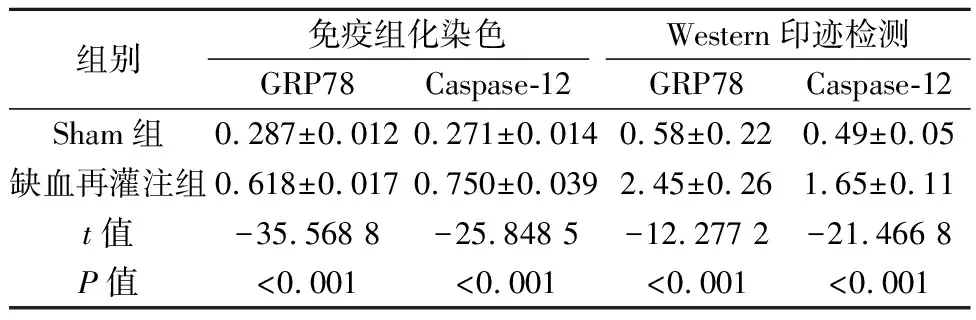
组别免疫组化染色GRP78Caspase-12Western印迹检测GRP78Caspase-12Sham组0.287±0.0120.271±0.0140.58±0.220.49±0.05缺血再灌注组0.618±0.0170.750±0.0392.45±0.261.65±0.11t值-35.568 8-25.848 5-12.277 2-21.466 8P值<0.001<0.001<0.001<0.001
3 讨 论
脑缺血后损伤内质网,导致ERS,通过多种途径导致神经元凋亡。当缺血再灌注损伤累及听皮层时,听皮层内质网会发生一系列反应而诱发ERS及细胞凋亡,最终影响听力〔8〕。
课题组研究人员在前期工作中观察了ERS及相关因子在全脑缺血后听皮层的表达变化〔7,9〕,为了更进一步贴近临床实际,更好模拟人类大脑中动脉局灶性脑缺血状态,改进了实验方法,采用了操作更简便,创伤更小的局灶性缺血再灌注损伤模型。同时通过神经评分、TTC染色和形态学观察证实模型成功。通过ABR证实缺血再灌注后患耳出现了听力损害。因此我们推测是由于缺血致听觉中枢的神经元损害进而导致听力受损。
内质网对维持细胞正常功能非常重要,对各种异常刺激如氧化应激、缺血缺氧及钙超载等非常敏感,可导致内质网应激,引起细胞内钙离子紊乱,未正确折叠或错误折叠蛋白大量堆积。但时间过长或严重的ERS则引起细胞凋亡,因此ERS是缺血再灌注损伤的关键环节〔10~14〕。
GRP78是ERS的经典标志蛋白,能够检测内质网稳态变化,正常情况下处于失活状态。当内质网稳态失衡时,大量未折叠蛋白聚集,GRP78随即被激活,促进未折叠蛋白的正确折叠。我们发现在全脑缺血再灌注12 h后即有GRP78蛋白表达最多,后逐渐下降。随着再灌注时间延长,内质网功能受到破坏,GRP78表达下降,提示缺血再灌注12 h内对细胞内ERS是比较合适的〔5〕。Caspase-12是内质网途径诱导凋亡途径特有的关键分子。当ERS发生时,Caspase-12被激活,进一步激活Caspase-9、Caspase-3,导致细胞凋亡〔15~17〕。我们发现造模后听皮层GRP78及Caspase-12蛋白表达明显增高,提示缺血再灌注启动了ERS过程及下游凋亡信号分子,最终导致听皮层神经元凋亡。
因此,ERS及其介导的凋亡在脑局灶性缺血再灌注后听功能损伤中发挥着重要作用,基于ERS凋亡通路的相关分子可以进行相应阻断,将是未来治疗伴有脑血管基础疾病的突发性耳聋患者的新的研究方向。

