Survivin shRNA-APC双基因对结肠癌细胞中P21和FHIT表达的影响
袁喜先,袁晓岚,陈鸿,张玉健,张书娟,张蒙蒙
(1.佳木斯大学附属第一医院 消化二科,黑龙江 佳木斯 154003;2.佳木斯大学临床 医学院,黑龙江 佳木斯 154003;3.中国人民武装警察部队福建省总队医院,福建 福州 350003)
细胞周期限制点的异常将导致细胞失控性增殖,这与肿瘤的发生、发展关系密切[1]。因此,细胞周期限制点的关键调控因子对结肠癌靶向治疗已成为研究热点。前期证实双基因可以抑制Survivin 的表达,并抑制细胞增殖[2]。然而,双基因联合对细胞周期限制点的调控作用未见报道。基于前期实验,本研究以P21 和FHIT 作为研究对象,观察双基因对细胞周期限制点调控因子P21 和FHIT 的影响,为结肠癌细胞周期限制点靶基因的治疗提供依据[2-4]。
1 材料与方法
1.1 主要试剂
Survivin shRNA-APC双基因稳转株:Survivin 干扰片段与APC基因补偿片段两者构成的双基因共表达慢病毒载体转染到HT-29 结肠癌细胞中,筛选出稳转株;Survivin shRNA 稳转株:Survivin shRNA 慢病毒载体转染HT-29 结肠癌细胞后筛选出稳转株;APC(aal020-1698)稳转株:APC 慢病毒载体转染HT-29 结肠癌细胞后筛选出稳转株;空载稳转株:单纯慢病毒载体转染HT-29 结肠癌细胞后筛选出稳转株,以上均由本课题组前期实验成功构建并筛选[3]。人HT-29 结肠癌细胞(中国科学院上海研究所)。兔抗人P21、FHIT 免疫组织化学试剂盒、链霉抗生物素蛋白-生物素-过氧化物酶复合物(streptavidinbiotin-peroxidase complex method,SABC)试剂盒、二氨基联苯胺显色剂均购自武汉博士德生物公司。
1.2 方法
1.2.1 细胞培养 将Survivin shRNA-APC双基因稳转株、Survivin shRNA 稳转株、APC 稳转株、空载稳转株及HT-29 结肠癌细胞分别在10%胎牛血清的DMEM 培养基中培养。将培养基置于培养箱中定期换液。当各组细胞生长至对数期时备用。
1.2.2 实验动物分组 45 只雌性SPF 级裸鼠,4 周龄,体重(20.0±1.5)g,购自北京维通利华实验动物技术有限公司。相同条件下饲养2 周后,选取35 只无病态、发育正常、营养良好的裸鼠。根据随机数字表法分为阴性对照组、空载组、Survivin shRNA 组、APC 组及双基因组,每组7 只。
1.2.3 动物模型的复制 将各组稳转株及结肠癌细胞重悬于PBS 中至浓度为2×106个/ml。阴性对照组接种HT-29 结肠癌细胞,空载组接种空载稳转株,Survivin shRNA 组接种Survivin shRNA 稳转株,APC组接种APC 稳转株,双基因组接种Survivin shRNAAPC双基因共表达稳转株,均为右腋下接种0.2 ml。相同条件下饲养裸鼠,观察肿瘤形成情况,于接种7周后全部处死,取下移植瘤,测量每组瘤重、计算瘤重抑制率。将移植瘤组织用中性甲醛固定,石蜡包埋切片,采用免疫组织化学法检测确定P21 和FHIT 蛋白表达情况。
1.2.4 组织细胞中P21 和FHIT 蛋白的表达 根据免疫组织化学试剂盒说明书进行实验。以PBS 代替一抗作为空白对照。P21 蛋白表达主要定位于细胞核。FHIT 蛋白主要定位于细胞质中。呈棕黄色或棕褐色为阳性表达。
应用半定量积分法计算:①根据切片中癌细胞染色强度统计,棕褐色为3 分,棕黄色为2 分,淡黄色为1 分,无染色为0 分;②根据着色细胞占细胞总数的百分比计分,选取5 个不同视野在高倍显微镜下(200 倍)计数。≥76%为4 分、51%~75%为3 分、26%~50%为2 分、≤25%为1 分、无阳性细胞表达为0 分。①与②的乘积计算出每个标本积分。蛋白表达指数是每组7 只裸鼠移植瘤切片中P21、FHIT蛋白表达强度的总平均值。
1.2.5 瘤重及瘤重抑制率 测量各组肿瘤重量,计算瘤重抑制率。瘤重抑制率=(1-阴性对照组移植瘤的瘤重/空载组移植瘤的瘤重)×100%。
1.3 统计学方法
数据分析采用SPSS 20.0 统计软件,计量资料以均数±标准差(±s)表示,比较用单因素方差分析,进一步的两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组移植瘤平均瘤重及瘤重抑制率比较
各组平均瘤重比较,差异有统计学意义(P<0.05)。APC 组、Survivin shRNA 组、双基因组低于阴性对照组和空载组(P<0.05),双基因组低于APC 组、Survivin shRNA 组(P<0.05)。空载组、APC组、Survivin shRNA 组及双基因组的瘤重抑制率分别为(0.00±0.00)%、(35.51±1.38)%、(35.11±1.30)%和(69.25±0.13)%,差异有统计学意义(χ2=6 201.530,P=0.000)。APC 组、Survivin shRNA 组、双基因组高于空载组(P<0.05),双基因组瘤高于APC 组、Survivin shRNA 组(P<0.05)。见表1。
2.2 各组P21、FHIT 蛋白表达水平比较
各组P21、FHIT 蛋白表达水平比较,差异有统计学意义(P<0.05)。APC 组、Survivin shRNA 组、双基因组高于阴性对照组和空载组(P<0.05),双基因组高于APC 组、Survivin shRNA 组(P<0.05)。见 表1。
表1 各组瘤重、P21、FHIT 蛋白表达水平比较 (n=7,±s)
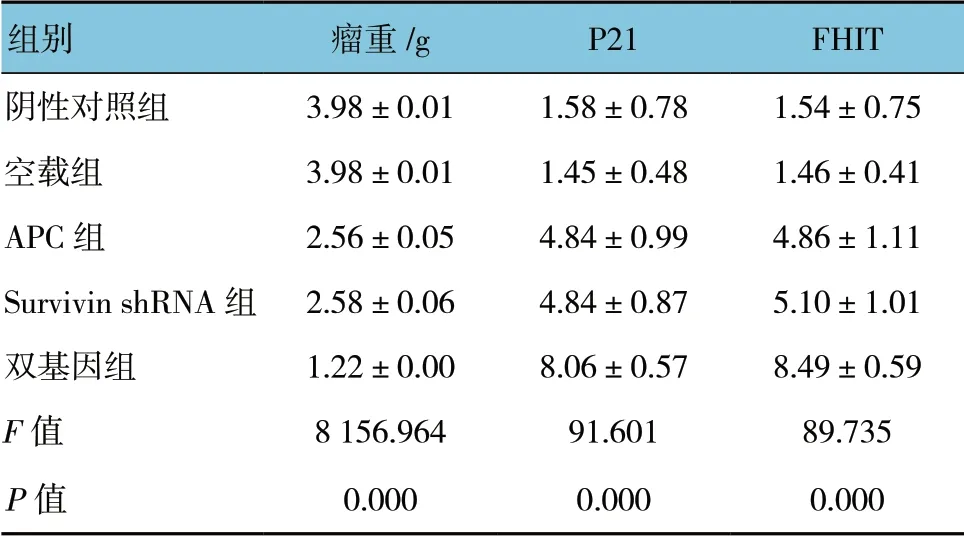
表1 各组瘤重、P21、FHIT 蛋白表达水平比较 (n=7,±s)
组别 瘤重/g P21 FHIT阴性对照组 3.98±0.01 1.58±0.78 1.54±0.75空载组 3.98±0.01 1.45±0.48 1.46±0.41 APC 组 2.56±0.05 4.84±0.99 4.86±1.11 Survivin shRNA 组 2.58±0.06 4.84±0.87 5.10±1.01双基因组 1.22±0.00 8.06±0.57 8.49±0.59 F 值 8 156.964 91.601 89.735 P 值 0.000 0.000 0.000
2.3 各组免疫组织化学染色结果
阴性对照组及空载组中P21、FHIT 蛋白呈较少的淡黄色颗粒。双基因组中P21、FHIT 蛋白呈现较多棕黄色及棕褐色颗粒。APC 组、Survivin shRNA 组P21、FHIT 蛋白表达量及着色强度居中。见图1、2。

图1 各组移植瘤P21 蛋白表达 (SABC×200)
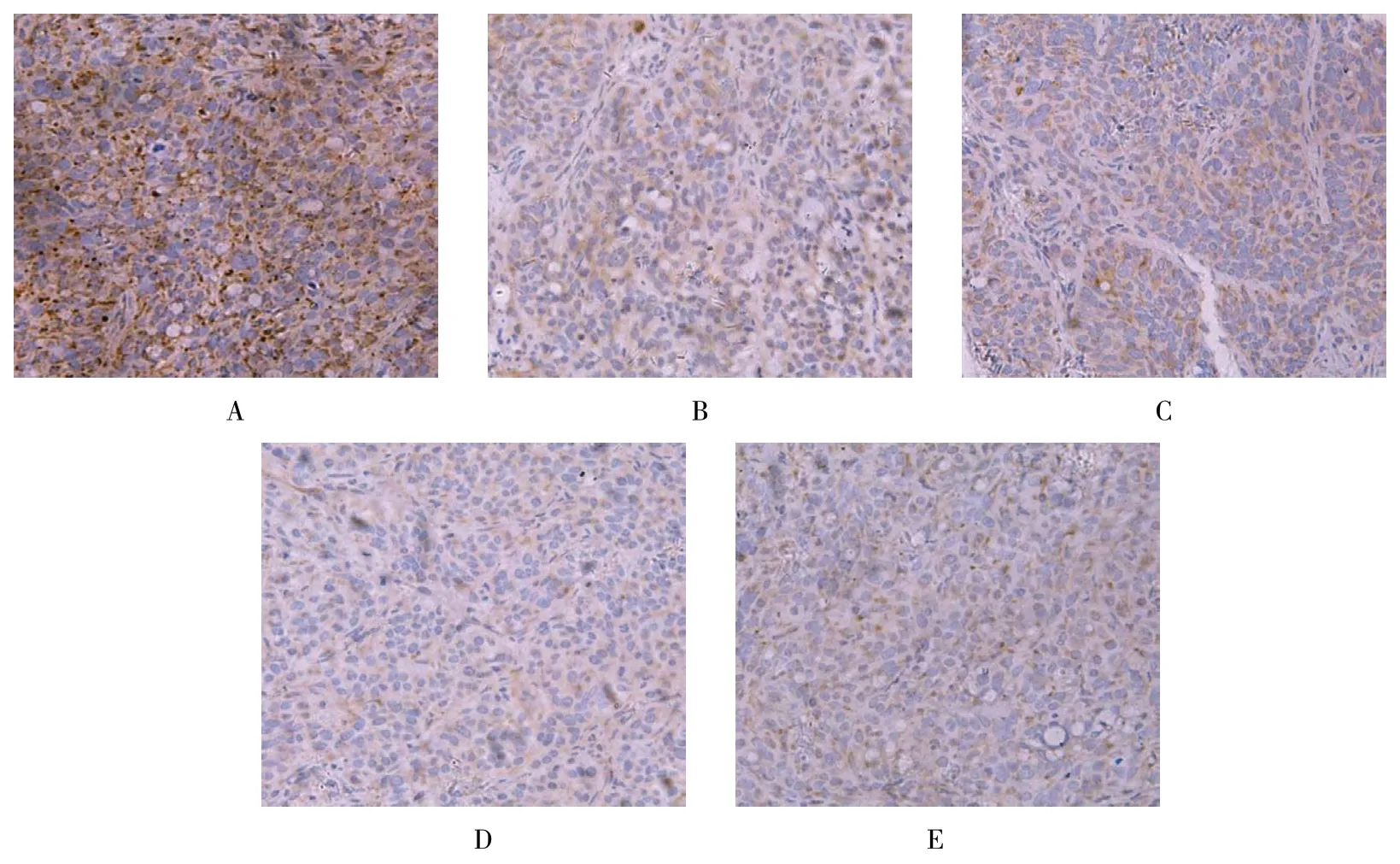
图2 各组移植瘤FHIT 的蛋白表达 (SABC×200)
3 讨论
细胞周期的调控异常将导致细胞增殖过多或凋亡过少[5]。组织细胞主要通过G1/S 和G2/M 2 个限制点来维持细胞周期的正常进行,而G1/S 期和/或G2/M 期转换异常,细胞周期的转换将会失去时序性调控,发展为细胞增殖过度或凋亡受阻,导致肿瘤的发生、发展[6-8]。有研究显示通过影响细胞周期限制点相关因子,可阻滞细胞周期,阻止肿瘤的发生、发展[9-11]。因此,细胞周期限制点异常可能在结直肠肿瘤发生、发展中起重要作用。
P21 是一种细胞周期蛋白依赖性激酶抑制蛋白,对细胞周期起负调控作用[12-13]。P21 蛋白作为G1/S 期限制点的调节因子,抑制细胞周期G1 至S 期的转化,细胞生长停滞在G1 期[13-14]。另有研究发现,P21 还可以阻断G2/M 期限制点,导致细胞生长受抑制,但其机制尚不明确[15]。FHIT是抑癌基因,FHIT 蛋白可抑制细胞通过G1/S 限制点,并能激活Caspase-8 产生的Caspase 酶介导的凋亡级联反应[16-17]。因此,P21 和FHIT 可作为细胞周期限制点负性调控的重要因子。
梁素美[18]、孟茜[19]和王佩飞等[20]研究显示Survivin 可能抑制P21、FHIT 的表达,缩短细胞周期,抑制细胞凋亡,促进癌细胞增殖。其机制可能是由于Survivin基因高表达下调结肠癌细胞中细胞周期调控因子P21 和FHIT 的表达,引起细胞周期转换异常、凋亡受抑,失去了对肿瘤细胞的监控,是肿瘤进展的重要机制之一。
课题组在之前实验中成功构建和挑选出稳定表达的Survivin shRNA-APC双基因共表达稳转株,即干扰异常表达的Survivin基因和补偿APC 的异常失活相结合,并分别在体内和体外均证实双基因共表达稳转株有效抑制HT-29 结肠癌细胞中Survivin 的表达,Survivin基因下调,可有效促进肿瘤细胞凋亡,抑制肿瘤细胞增殖[2-4]。然而,尚未见Survivin shRNA-APC双基因对细胞周期限制点的调控作用研究的有关报道。笔者复制HT-29结肠癌细胞裸鼠皮下移植瘤模型,选择细胞周期相关因子P21、FHIT 作为研究对象,探究Survivin shRNA-APC双基因共表达稳转株对细胞周期限制点关键调控因子的影响。
本实验成功复制HT-29 结肠癌细胞裸鼠皮下移植瘤模型。实验结果显示,在蛋白水平上Survivin shRNA-APC双基因共表达稳转株对移植瘤组织细胞中P21、FHIT 表达的抑制作用减小,且效果优于APC及Survivin shRNA单基因稳转株。Survivin shRNAAPC双基因组中P21、FHIT 的蛋白表达水平最高,瘤重最小,瘤重抑制率最高,均优于其余组。结果提示双基因组较其余组升高细胞周期限制点调控因子P21、FHIT 的表达水平,并且对肿瘤生长的抑制作用最强。
综上所述,Survivin shRNA-APC双基因可能通过下调Survivin基因表达,上调P21、FHIT 在移植瘤组织中的表达,从而在抑制细胞周期限制点的过度转化、抑制结肠癌移植瘤的生长及促进细胞凋亡等方面发挥作用。并且双基因比单基因作用效果更好。因此,联合检测P21、FHIT 的表达水平可能有利于判断结肠癌的预后。Survivin shRNA-APC双基因对细胞周期相关因子P21、FHIT 调控机制的研究可能为结肠癌细胞周期限制点靶向治疗提供新思路。

