STAT3在妊娠期肝内胆汁淤积症孕妇胎盘中的表达及意义*
叶云飞,蒙文霞,陈 滢,周一萍,李文怡,陈柏秀
(广西科技大学附属柳州市人民医院产科 545006)
妊娠期肝内胆汁淤积症(intrahepatic cholestasis of pregnancy,ICP)是妊娠中晚期最常见的特发性肝脏功能紊乱性疾病。临床上以皮肤瘙痒及血清总胆汁酸水平升高为特点,发病率为0.2%~2.0%[1-2]。ICP是严重威胁母婴健康的妊娠期并发症,可导致早产、胎儿宫内窘迫、新生儿窒息、羊水胎粪污染等,使围生儿病死率明显增高[3]。ICP的发病机制非常复杂,其病因学仍不清楚。多数研究认为是遗传变异、内分泌、免疫功能失常及环境因素等多因素共同作用的结果[4]。曹丽琼等[5]研究报道细胞因子信号传导负调控因子3(SOCS3)参与了ICP的发病。而对信号转导和转录活化因子3(STAT3)在ICP患者胎盘中的表达尚无文献报道。本研究通过检测重度ICP孕妇和健康孕妇胎盘组织中STAT3、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)的表达水平,初步探讨STAT3在ICP发病中的作用。
1 资料与方法
1.1一般资料 选择2016年1月至2017年12月在柳州市人民医院产科住院治疗、资料完整的剖宫产分娩的重度ICP孕妇25例为试验组。根据中华医学会妇产科学分会2015年公布的ICP诊疗指南[6],重度ICP的纳入标准:(1)血清总胆汁酸水平大于或等于40 μmol/L;(2)瘙痒严重伴或不伴有黄疸、皮肤抓痕;(3)复发性ICP。排除标准:排除肝炎病毒、EB病毒、巨细胞病毒感染。试验组年龄29.3岁(27~37岁),孕周37+3周(36~40周)。选择同期健康顺产孕妇30例为对照组,年龄28.5岁(24~36岁),孕周39+3周(37~41周)。两组孕妇年龄比较,差异无统计学意义(P>0.05),孕周比较,差异有统计学意义(P<0.05)。两组孕妇既往均无高血压、心脏病、肾脏疾病、糖尿病及甲状腺功能异常等基础病史,无输血及免疫治疗史。本研究经柳州市人民医院伦理委员会讨论并批准,并经所有孕妇知情同意。
1.2方法
1.2.1标本收集及处理 胎盘娩出后10 min内,于脐根正对面,避开淤血、坏死及钙化区迅速剪取绒毛组织(无蜕膜组织及羊膜)2块约1 cm×1 cm×1 cm,其中1块用生理盐水冲洗并擦干,放入10%甲醛中固定24~48 h后用乙醇梯度脱水,二甲苯透明,石蜡包埋进行免疫组织化学检测。另1块迅速置于10%甲醛中,用于蛋白印迹法检测。
1.2.2免疫组织化学法检测胎盘组织中STAT3、IL-6和TNF-α的表达 采用免疫组织化学链霉素抗生物素蛋白-过氧化物酶链接法(SP法)测定胎盘组织中STAT3、IL-6和TNF-α的表达水平,免疫组织化学试剂盒购自武汉博士德生物工程有限公司。STAT3、IL-6和TNF-α抗体试剂盒均购自上海生工生物工程股份有限公司。操作按说明书上步骤进行。结果判定:染色结果分别由2位病理学专业医师独立评估。STAT3、IL-6、TNF-α阳性信号为细胞内呈现棕黄色颗粒。按阳性细胞百分率评分:0%~<5%为0分,5%~<25%为1分,25%~<75%为2分,≥75%为3分。按细胞质或胞核着色程度评分:未着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分,将两项得分相乘,<2分判为阴性(-),≥2分为阳性(+)。
1.2.3平均光密度值测定 采用美国Media cybernetics 公司生产的Imagepro-plus 6.0专业图像分析软件对免疫组织化学照片进行光密度分析。每张切片选取3张400倍照片做光密度分析,
1.2.4蛋白印迹法检测STAT3蛋白表达水平 组织裂解、离心后得到蛋白样本,测定总蛋白浓度,上样电泳。电泳后转移至聚偏二氟乙烯膜(PVDF),加入小牛血清蛋白封闭液封闭。加入STAT3一抗(兔抗人单克隆抗体 1∶10 000稀释),β-actin抗体(1∶800稀释),4 ℃过夜,分别加入二抗(1∶10 000稀释),室温孵育。ECL显影、曝光。扫描曝光片后,应用Quantity图像分析系统分析目的条带,记录条带灰度值。蛋白印迹条带的灰度值与内参β-actin条带灰度值的比值作为STAT3蛋白的表达水平。

2 结 果
2.1STAT3、IL-6、TNF-α在胎盘组织中的定位及表达 STAT3在两组孕妇胎盘组织中均有表达,STAT3定位在滋养层细胞的胞质和胞核;呈现浅黄色、棕黄色或褐色染色颗粒,STAT3在试验组孕妇胎盘滋养层细胞中呈强阳性表达;在对照组孕妇胎盘滋养层细胞中呈弱阳性表达。IL-6定位在滋养层细胞的胞质; TNF-α定位在合体滋养层细胞胞核。STAT3、IL-6和TNF-α在试验组中的表达明显高于对照组。试验组孕妇胎盘滋养层细胞中STAT3、IL-6、TNF-α平均光密度值明显高于对照组(P<0.05),见图1~3。
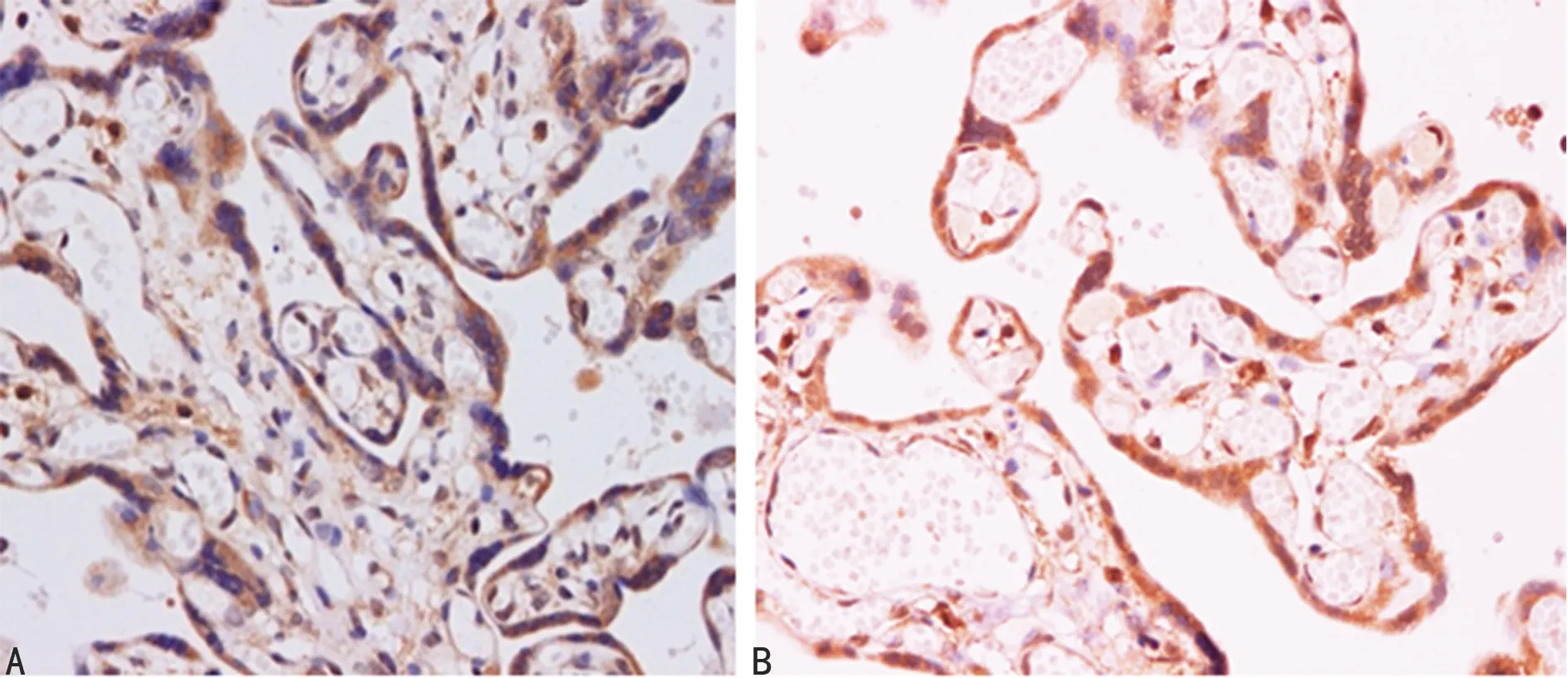
A:对照组;B:试验组
图1两组STAT3的表达(SP×400)

A:对照组;B:试验组
图2两组IL-6的表达(SP×400)
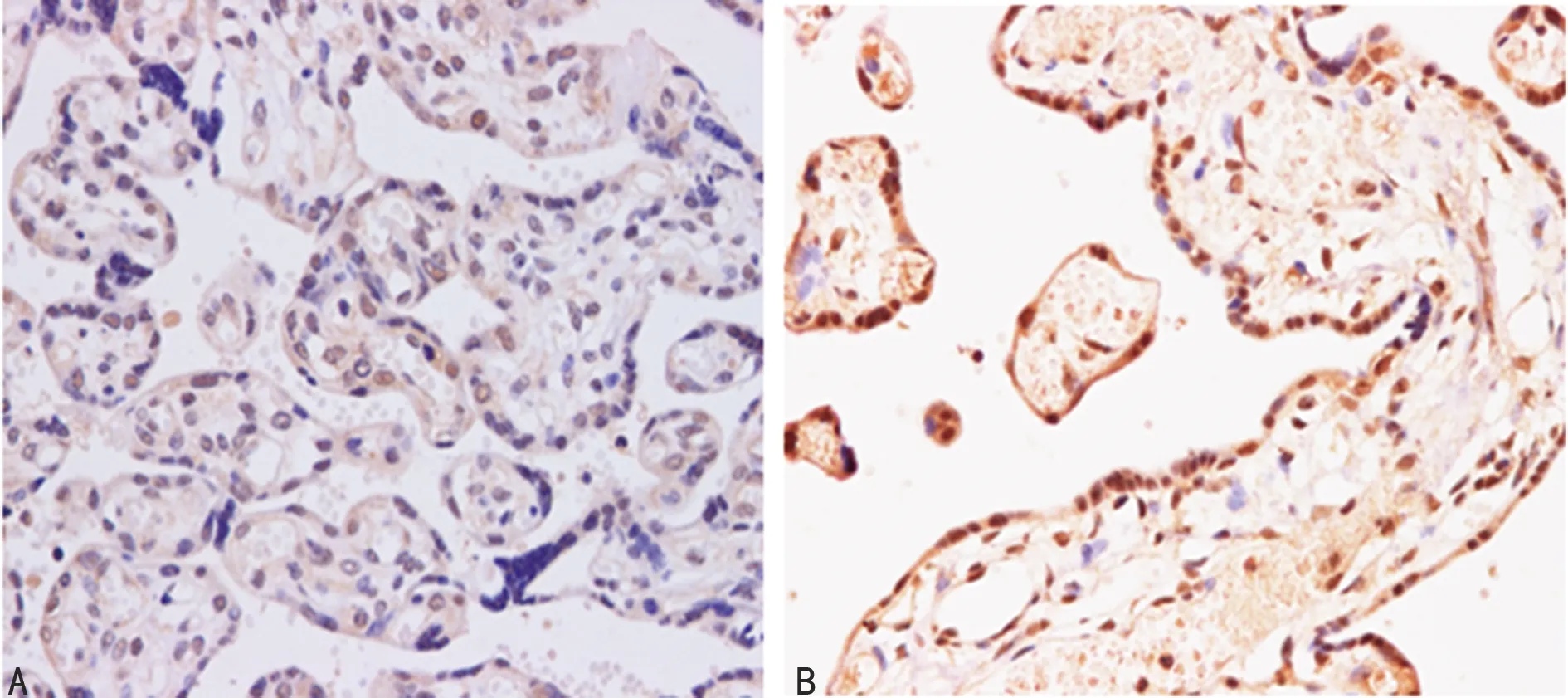
A:对照组;B:试验组
图3两组TNF-α的表达(SP×400)

表1 两组中STAT3、IL-6、TNF-α细胞阳性率及平均光密度值
2.2孕妇胎盘滋养层细胞中STAT3阳性细胞率及平均光密度值 试验组孕妇胎盘滋养层细胞中STAT3阳性细胞率明显高于对照组(P<0.05);试验组孕妇胎盘滋养层细胞中STAT3平均光密度值明显高于对照组(P<0.05);试验组孕妇胎盘滋养层细胞中IL-6、TNF-α阳性细胞率明显高于对照组(P<0.05);试验组孕妇胎盘滋养层细胞中IL-6、TNF-α平均光密度值明显高于对照组,两组比较,差异均有统计学意义(P<0.05),见表1。
2.3STAT3在胎盘组织中的表达定量 免疫印迹检测显示,对照组、试验组孕妇胎盘组织中均可检测到STAT3蛋白的表达,试验组STAT3表达水平(1.05±0.10)明显高于对照组(0.38±0.07)。两组间比较差异有统计学意义(P<0.05),见图4。

图4 各组胎盘组织STAT3蛋白表达免疫印迹图
2.4试验组孕妇胎盘滋养层细胞中STAT3与IL-6、TNF-α的相关性分析 试验组中STAT3表达强度与IL-6、TNF-α的表达强度呈显著正相关(r=0.687,r=0.891,P<0.05),见表2。

表2 试验组STAT3与IL-6、TNF-α的相关性
3 讨 论
3.1STAT3在ICP母胎界面的变化 JAK/STAT信号通路目前已成为研究细胞膜到细胞核信号传递中的经典信号途径。而信号转导及转录激活因子(STAT)通路是JAK/STAT信号通路研究的热点之一。STAT3能被许多细胞因子、生长因子和其他刺激因素所激活发挥作用,激活的STAT3(P-STAT3)可以调节其他细胞因子表达,并可介导细胞的增殖、凋亡、分化等重要生理活性。FITZGERALD等[7-8]研究显示STAT3转录因子的活性与绒毛外滋养细胞的凋亡、迁移和侵袭相关。曹丽琼等[5]研究报道SOCS3参与了ICP的发病。本研究对ICP孕妇和健康孕妇胎盘组织中STAT3的表达进行分析,免疫组织化学结果显示:STAT3定位在胎盘组织滋养层细胞的胞质和胞核;ICP时胎盘中STAT3表达水平显著高于健康孕妇。免疫印迹实验显示:两组孕妇胎盘组织中均可检测到STAT3蛋白的表达,试验组(1.05±0.10)明显高于对照组(0.38±0.07),差异有统计学意义(P<0.05)。故无论是定性实验还是定量实验均提示:ICP时胎盘中STAT3表达水平显著高于健康孕妇。ICP患者的母胎界面STAT3表达增高,提示STAT3可能参与了ICP的发病。
3.2IL-6、TNF-α在胎盘中的定位及表达 近年研究发现,对一些细胞因子如IL-6、TNF-α、血管内皮生长因子(VEGF)等进行早期监测对ICP具有重要意义。IL-6是由淋巴细胞及单核巨噬细胞分泌的炎性细胞因子,有广泛的生物学作用,可诱导B细胞分化并产生免疫球蛋白,促进T细胞增殖、生长等。IL-6在妊娠、分娩及胎儿生长发育过程中均发挥重要作用。研究[7]发现ICP患者血清中IL-6的表达明显高于正常妊娠,且随着病情的加重该指标值不断升高,IL-6还可诱导内皮细胞合成和分泌黏附分子进而发挥损伤作用,据此通过监测血清中IL-6的水平可以了解ICP患者病情的严重程度。研究[9-10]显示,人类子宫内膜和胎盘组织中存在大量的巨噬细胞,这些巨噬细胞在接受同种异型胎儿抗原刺激后可分泌TNF-α,适量的TNF-α可调节胎儿与胎盘组织的生长,促进滋养层细胞的合成,刺激孕酮和绒毛膜促性腺激素(HCG)的分泌,防止母体对胎儿产生排斥反应。BULL等[11]研究发现ICP患者胎盘中细胞因子TNF-α的表达明显增加,诱发ICP发病。TNF-α诱导ICP胎盘绒毛滋养细胞凋亡,使黏附分子的表达上调,ICP患者发生体内免疫损伤和免疫排斥,TNF-α可以促进雌激素在胎盘的合成和分泌,加重ICP。TNF-α具有双重生物学效应,生理状态下参与机体免疫防护,病理状态下大量TNF-α造成机体免疫损伤。从免疫学观点来看,TNF-α属于Th1型细胞因子[11-12]。已有研究[13-14]表明免疫功能失衡可能会破坏孕妇免疫微环境,导致孕妇出现各种病理性妊娠反应。ICP孕妇的Th1/Th2型细胞因子的平衡发生变化,Th1的表达更明显。本研究结果显示,ICP患者的IL-6、TNF-α表达水平比健康孕妇异常增高。这一结果与文献[9-10]的研究结果相符合。本研究提示,IL-6、TNF-α表达的异常增高与ICP患者病理性妊娠反应有着极为密切的关系,并且可能导致胎儿不良妊娠结局的发生。
3.3STAT3与IL-6、TNF-α相关性 王斯南等[15]通过免疫组织化学法评价胆酸对IL-6/STAT3通路的激活情况。结果显示:胆酸可通过诱导肠道低度炎性反应激活IL-6/STAT3通路。NGUYEN等[16]研究发现:STAT3是IL-6的核心效应分子。细胞因子TNF-α是体内重要的早期促炎因子,TNF-α的mRNA上有STAT3的结合位点,活化后的STAT3可以入核与TNF-α的mRNA上S1Ⅺ3的结合位点结合,增强TNF-α的转录,导致TNF-α的大量释放;而细胞因子受体与相应的细胞因子结合后又可进一步促进JAK/STAT通路的活化,从而对JAK/STAT通路进行“正反馈”调节,使炎症级联反应不断放大。
LUO等[17]在构建妊娠高血压大鼠模型实验中发现,STAT3可以改善妊娠高血压大鼠血管内皮细胞功能,STAT3与TNF-α、IL-6的表达具有正相关性。本研究结果发现:无论是定量还是定性实验均发现STAT3的表达与胎盘组织中IL-6、TNF-α水平呈正相关。说明IL-6对TNF-α的调控,可能是通过STAT3信号通路完成。IL-6高表达激活了STAT3表达,活化后的STAT3进入细胞核与TNF-α结合,导致TNF-α的大量释放,从而使TNF-α表达异常增高,打破了Th1/Th2平衡,Th1表达明显,从而导致ICP的发病最终导致ICP发病。是否可以通过阻断该通路达到一定的治疗作用,减少患者及新生儿的不良结局的发生,进而对准确及详细分析ICP患者提供一定的参考,值得进一步研究。
综上所述,本研究表明,通过对STAT3的检测并结合TNF-α、IL-6的表达情况能从信号通路这一方面更深入了解ICP疾病的发病情况,开拓了ICP发病机制的新思路。而孕期通过检测IL-6、STAT3和TNF-α水平可了解胎儿宫内环境,对临床终止妊娠时机的选择提供了理论依据。目前,对ICP病理生理过程认识较局限,STAT3信号通路的研究为ICP的发病提供了新的思路,而对其药物治疗提供了重要的研究方向,可针对该通路选择对胎儿影响小,更有效的药物进行治疗,或能成为治疗ICP的一条新的路径。

