杨梅素通过激活AKT信号通路抑制心肌梗死后心脏重构的研究
邵 玲,周梦桥,熊涛,邓长金
(湖北省荆门市第一人民医院心血管内科 448000)
心肌梗死是冠状动脉疾病发病和死亡的主要原因。在急性心肌梗死后,心肌细胞大量死亡,触发一系列的分子和细胞重构反应包括炎性反应、心肌细胞肥大反应、纤维化增生和胶原疤痕的形成[1]。在早期上述重构过程能够保持心脏的完整性和维持心脏功能,然而持续的梗死后重构将最终导致左室扩张、心功能不全,最终发展成为心力衰竭[2]。目前临床上的药物并不能抑制甚至逆转重构的心脏[3],因此心力衰竭患者的发病率逐年升高。为此,寻找新的药物靶点迫在眉睫。
杨梅素是药物化学的重要天然产品之一,已有研究报道杨梅素具有多种功效:抗菌、抗病毒、抗癌、抗炎、抗氧化应激和降糖活性[4-6]。在心脏中的研究表明,杨梅素可以减轻大鼠心脏急性缺血再灌注损伤,可减少盐敏感性大鼠心脏损伤[7]。此外,杨梅素还可减轻异丙肾上腺素诱导的大鼠心肌损伤[8]。上述研究均提示杨梅素可能对心肌损伤后重构具有抑制作用。本研究采用心肌梗死模型,旨在探讨杨梅素对心肌梗死后心脏重构的影响和具体机制。
1 材料与方法
1.1实验动物 8~10周龄雄性C57BL/6J小鼠(SPF级),饲养于隔离屏障设施的环境中;购买于南京医科大学实验室动物中心,动物合格证号:SCXK(苏)-2015-0132;动物生产许可证号:SCXK(苏)2014-0131,体质量 23.5~27.5 g,采用随机数字表法分为4组:对照组(n=10);模型组(n=20);低浓度杨梅素组(n=20):100 mg·kg-1·d-1杨梅素灌胃处理,术后3 d开始,持续到术后4周;高浓度杨梅素组(n=20):300 mg·kg-1·d-1杨梅素灌胃处理,术后3 d开始,持续到术后4周。
1.2试剂 杨梅素(纯度大于 98%,上海融禾生物有限公司);P-PI3K抗体(4228S),T-PI3K抗体(4257),P-AKT抗体(4060),T-AKT抗体(4691),P-mTOR抗体(2971),T-mTOR抗体(2983),GAPDH抗体(2118)均购自Cell Signaling Technology公司。
1.3心肌梗死模型制备 采用冠状动脉左前降支结扎术建立心肌梗死模型。用3%戊巴比妥钠腹腔注射麻醉小鼠后,在胸骨左缘纵行切开皮肤暴露心脏,在左心耳下缘2~3 mm处用8-0的聚丙烯缝线结扎冠状动脉,以心电图ST段抬高确定心肌缺血形成,对照组以相同的方法挂线,但是不结扎。迅速将心脏送回胸腔,缝合胸壁。术后3 d开始喂药处理。
1.4超声心动图检测 采用小动物超声系统检测小鼠心功能。收集的数据包括:左室收缩末期内径(LVESd),左室舒张末期内径(LVEDd),左室射血分数(LVEF),左室短轴缩短率(LVFS)。
1.5心肌梗死面积的计算 术后4周,取小鼠心脏,采用中性甲醛固定,石蜡包埋切片,进行HE染色,用Iimage J1.44软件计算心肌梗死面积。
1.6HE、天狼星红(PSR)和免疫组化染色 采用苏木素和伊红进行HE染色;采用PSR进行胶原染色;采用免疫组化染色CD45和CD68,DAB显色法进行炎症细胞浸润标记。
1.7RT-qPCR检测 采用TRIzol(Invitrogen公司)提取心脏的总RNA;采用罗氏公司的反转录试剂盒将RNA反转录为cDNA。采用罗氏Light Cycler 480 SYBR Green荧光定量PCR仪进行PCR扩增。所有目标基因的转录结果与内参基因GPADH进行对比。
1.8Western blot检测 采用裂解法提取小鼠心脏总蛋白,采用BCA试剂进行蛋白定量。采用10%的SDS-PAGE进行凝胶电泳。所用一抗包括:磷酸化和总的PI3K、AKT、mTOR和内参蛋白GAPDH(均购买于CST公司)。采用化学发光法进行显色,每组磷酸化蛋白的表达水平用其相应的总蛋白表达校准。

2 结 果
2.1杨梅素提高心肌梗死后小鼠存活率,改善心功能,减小心肌梗死面积 低浓度和高浓度杨梅素处理后的小鼠存活率明显高于模型组(P<0.05)。且两种浓度的杨梅素处理组小鼠心肌梗死面积明显缩小(P<0.05),其心脏重量显著低于模型组(P<0.05)。此外,超声心动图结果提示低浓度和高浓度杨梅素能明显改善心肌梗死后4周小鼠的心功能:LVESd和LVEDd明显小于模型组,而LVEF和LVFS明显高于模型组(P<0.05)。两种浓度的杨梅素处理组间差异无统计学意义(P>0.05),见表1。
2.2杨梅素降低心肌肥厚程度 心肌梗死4周后,模型组小鼠心肌肥厚程度明显增高;心肌肥厚相关基因A型利钠肽(ANP)、B型利钠肽(BNP)和肌球蛋白重链β(β-MHC)的转录水平显著增加;低浓度和高浓度杨梅素处理组均能显著抑制心肌肥厚程度,降低心肌肥厚相关基因的转录(P<0.05)。高浓度杨梅素处理组效果优于低浓度处理组(P<0.05),见图1,表2。

表1 各组小鼠生存率、梗死面积以及心功能的比较
*:P<0.05,与对照相组比较;#:P<0.05 ,与模型组比较
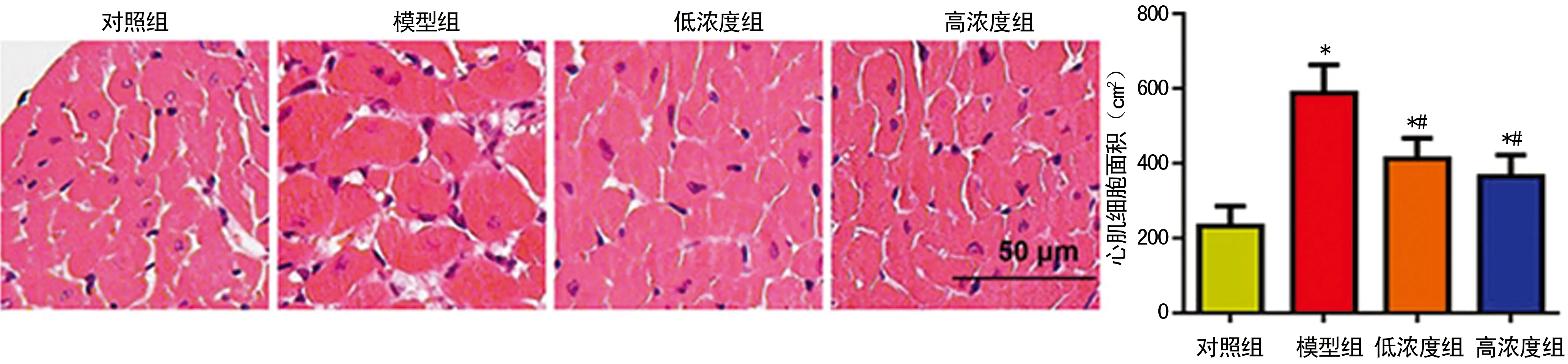
图1 各组HE染色心肌肥厚程度
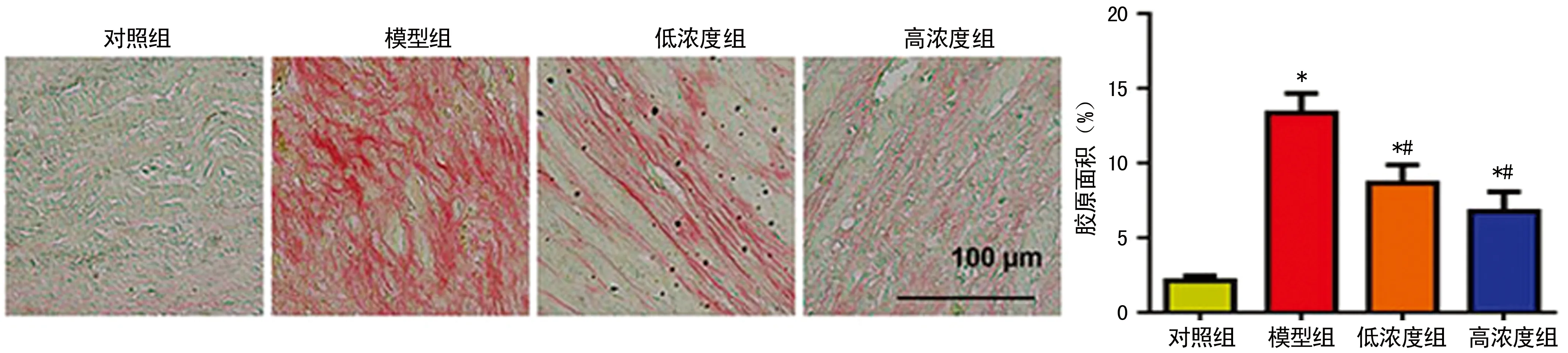
图2 各组PSR染色心肌纤维化程度

项目对照组模型组低浓度组高浓度组ANP0.32±0.013.24±0.03∗1.55±0.01∗#1.07±0.02∗#BNP0.27±0.022.98±0.01∗1.43±0.03∗#1.19±0.02∗#β-MHC0.14±0.023.22±0.01 ∗1.09±0.02∗#0.88±0.02∗#Collgen Ⅰ(×10-2)1.09±0.1213.43±1.11∗8.12±0.13∗#6.99±0.18∗#Collgen Ⅲ(×10-2)1.14±0.7614.34±1.21∗8.55±1.99∗#6.67±1.09∗#CTGF(×10-3)2.09±1.1115.43±2.12∗7.43±1.23∗#5.21±1.87∗#TGF-β(×10-4)1.98±0.1212.28±2.24∗8.34±1.34∗#6.28±1.11∗#
*:P<0.05,与对照组比较;#:P<0.05,与模型组比较

表3 各组小鼠心脏心肌炎症和氧化应激水平
*:P<0.05,与对照组比较;#:P<0.05,与模型组比较
2.3杨梅素降低心肌纤维化水平 心肌梗死4周后,模型组小鼠心肌纤维化及相关基因的转录水平显著增加:Ⅰ型胶原蛋白(CollagenⅠ),Ⅲ型胶原蛋白(CollagenⅢ),结缔组织生长因子(CTGF)和转化生长因子-β(TGF-β)。低浓度和高浓度杨梅素处理组均能显著抑制心肌纤维化水平;减少纤维化相关基因的转录(P<0.05)。高浓度杨梅素处理组效果优于低浓度处理组(P<0.05),见图2,表2。
2.4杨梅素降低心肌炎性反应 心肌梗死4周后,模型组小鼠CD45和CD68阳性的炎症细胞浸润明显增多,炎症相关基因[白细胞介素-1(IL-1),白细胞介素-6(IL-6),肿瘤坏死因子(TNF-α)]的转录水平显著增加;低浓度和高浓度杨梅素处理组均能显著减少CD45和CD68阳性的炎症细胞浸润;减少IL-1、IL-6、TNF-α的转录(P<0.05)。不同浓度杨梅素处理组间差异无统计学意义(P>0.05),见表3、图3。
2.5杨梅素降低心肌氧化应激水平 心肌梗死4周后,模型组小鼠还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶亚基gp91和P67的转录水平明显增强,抗氧化酶超氧化物歧化酶(SOD)活性明显降低,小鼠心脏脂质过氧化中间代谢产物丙二醛(MDA)明显增多;低浓度和高浓度杨梅素处理组均能显著减少gp91和P67的转录水平;增加SOD活性,减少MDA产生(P<0.05)。不同浓度杨梅素处理组间差异无统计学意义(P>0.05),见表3。

图3各组CD45和CD68阳性炎症细胞浸润数量

表4 各组心脏AKT信号蛋白的相对表达
*:P<0.05,与对照组比较;#:P<0.05,与模型组比较

图4 各组AKT信号通路的改变
2.3杨梅素激活AKT信号通路 模型组小鼠心脏AKT活化程度明显降低(P<0.05),且其上游PI3K和下游蛋白mTOR磷酸化水平降低(P<0.05)。低浓度和高浓度杨梅素处理后AKT信号通路蛋白PI3K,AKT和mTOR的磷酸化水平明显提高(P<0.05)。不同浓度处理组间差异无统计学意义(P>0.05),见表4、图4。
3 讨 论
以往的研究表明杨梅素通过抑制P38信号通路减轻大鼠心脏急性缺血再灌注损伤[4]。杨梅素可减少盐敏感性大鼠心脏损伤[7]。杨梅素还可减轻异丙肾上腺素诱导的大鼠心肌损伤[8]。上述研究均侧重于杨梅素对抗心肌的急性损伤作用。而本研究采用心肌梗死模型,杨梅素给予处理至术后4周,探讨杨梅素对心肌梗死后心脏重构的影响,结果提示杨梅素能够减少小鼠心肌梗死后4周的死亡率,减少心肌梗死面积,改善梗死4周后的心功能。
心肌梗死后的心脏重构是一个复杂的病理过程。在心肌梗死早期(梗死后1~2周),坏死和凋亡的心肌细胞诱导一系列炎性反应。适当的炎性反应促进死亡的心肌细胞清除[9];炎症细胞分泌的促炎症因子可诱导成纤维细胞的激活和分泌,促进心肌纤维化[10]。在疾病早期,上述重构有助于维持心脏的完整性和功能。随着重构的持续(梗死后3~4周),梗死周边区域残余的心肌细胞为满足心脏的做功要求,发生肥厚性增生,在此过程中胚胎基因过度激活(ANP、BNP、β-MHC),成为心脏重构的标志物[11];此外,纤维化过度增生导致左室僵硬度增加,心室顺应性降低,影响心脏的舒张功能[11]。本研究发现杨梅素能够显著减少心脏重量和心脏重构标志物ANP、BNP、β-MHC的表达;减少纤维化标志物Ⅰ型collagen Ⅰ、collagen Ⅲ和促纤维化因子CTGF、TGF-β的转录。提示杨梅素能够阻止心肌梗死后心脏重构的发展。
在心肌梗死后期,过度的炎性反应造成促纤维化因子大量分泌,刺激成纤维细胞增殖分化和分泌,促进心肌纤维化;此外,过多的炎性反应导致心肌细胞损伤凋亡增多,心肌细胞数量减少,影响心脏收缩功能[12]。氧化应激在心肌梗死后心脏重构中发挥重要作用。在生理条件下,ROS作为第二信使发挥重要的信号传递功能;然而在病理条件下ROS产生和清除失衡,导致心肌细胞氧化应激损伤。一方面氧化应激引起细胞蛋白质和DNA损伤;另一方面氧化应激激活多种炎症和心脏重构相关通路,刺激心脏重构的发生发展[13]。本研究发现,杨梅素能够减少心肌梗死后CD45和CD68炎症细胞的浸润,减少促炎症因子的合成;减少氧化酶NADPH的表达,而增加抗氧化酶SOD的活性。提示杨梅素能够阻止心肌梗死后心肌炎症和氧化应激反应。
PI3K/AKT是胰岛素受体被激活后的重要的信号通路,在调节细胞代谢、葡萄糖摄取、细胞增殖和蛋白质合成方面发挥核心作用[14]。在心肌细胞中,AKT信号通路还参与细胞存活、血管生成、炎性反应和氧化应激。在受到胰岛素信号刺激后,PI3K磷酸化激活,促进下游的AKT蛋白磷酸化激活,后者可刺激多种下游分子[15]。其中mTOR通过mTORC1复合体激活后促进细胞蛋白质合成、生长和存活[16]。本研究发现小鼠心肌梗死4周AKT信号通路蛋白明显失活,而低浓度和高浓度杨梅素处理能够重新激活PI3K/AKT信号通路,促进心肌细胞存活,降低小鼠死亡,抑制心脏重构的发展。
综上所述,杨梅素能够通过激活PI3K/AKT信号通路,阻断心肌梗死后的心脏重构。杨梅素可能成为治疗心脏重构的新思路。

