微小RNA-181a-5p、320a及其靶基因TGF-β1在食管鳞癌中的表达*
李彦桦,李雨珊,张仁静,周雪梅,何欣蓉
637000 四川 南充,川北医学院附属医院 病理科(李彦桦、周雪梅、何欣蓉);610000成都,航空工业363医院 病理科(李彦桦);637000 四川 南充,川北医学院 病理教研室(李雨珊、张仁静、周雪梅、何欣蓉)
我国食管癌的发病率和死亡率均居世界之首,占全球的50%[1]。食管癌高发于四川省北部的阆中市、盐亭县、西充县,居当地癌症发病率的第一位,而且发病率有逐年上升的趋向[2]。食管癌的病理类型较多,我国90%的患者为食管鳞状细胞癌(简称食管鳞癌)。近年来,关于微小RNA(microRNA,miRNA)功能的研究已成恶性肿瘤发生发展机制研究中的热点。miRNA是一类长度在19~25个核苷酸的内源性单链小分子非编码RNA,广泛存在于真核生物细胞内, 具有重要的基因调节作用。越来越多的研究表明,多种miRNA在恶性肿瘤中表达异常[3-5]。在食管癌组织中,已发现上调的miRNA 有miR-21、miR-let-7c、miR-16、miR-25、miR-155、miR-208、miR-223等;已发现低表达的miRNA有miR-133a、miR-200b、miR-203、miR-375、miR-625 等[6-9]。本研究通过miRNA芯片技术方法筛选食管鳞癌相关的miRNA,利用生物信息学技术预测差异显著的miRNA的靶基因,通过实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,qRT-PCR)验证食管鳞癌中miR-181a-5p、miR-320a和TGF-β1mRNA的表达情况,探索其与食管鳞癌发生发展的关系。
1 材 料
1.1 miRNA芯片杂交标本来源
收集川北医学院附属医院病理科经病理确诊的食管鳞癌蜡块及相应的瘤旁正常组织(距离肿瘤边缘﹥5cm)蜡块各3例,所有患者术前均未接受放化疗治疗。本研究由川北医学院附属医院伦理委员会批准[编号:2016ER(A)024]。
1.2 qRT-PCR标本来源
纳入2016年于川北医学院附属医院接受食管癌根治性手术的患者22例,收集切除的新鲜癌组织及相应的瘤旁正常组织(距离肿瘤边缘>5cm)。22例患者均为男性,年龄50~74岁;其中,高分化10例,中分化11例,低分化1例(由于低分化组数量太少,分组比较时将其与中分化组合并);淋巴结转移阳性10例,淋巴结转移阴性12例。所有患者术前均未接受放化疗治疗;术后肿瘤组织病理诊断均为食管鳞状细胞癌,切缘均未被累及。组织用生理盐水清洗,以100g为单位分装于冻存管,装在冰冻盒中并于-80℃冰箱保存。
2 方 法
2.1 miRNA芯片杂交
实验样品RNA采用Agilent miRNA芯片配套的试剂盒,miRNA Complete Labeling and Hyb Kit(Cat#5190- 0456, Agilent technologies, Santa Clara, CA, US),按照标准操作流程的标记部分对样品中的miRNA分子进行荧光标记。miRNA芯片检测、杂交扫描和数据分析均由上海伯豪生物技术有限公司完成。
2.2 qRT-PCR
2.2.1 总RNA的提取 应用Trizol等试剂提取食管鳞癌及对照正常组织的总RNA,紫外分光光度计测定RNA浓度后于-80℃保存(D260nm/D280nm在1.8~2.0之间)。
2.2.2 逆转录及qRT-PCR检测目的miRNA的表达量 使用All-in-One-miRNA qRT-PCR Detection Kit试剂盒将组织中提取的RNA逆转率成cDNA,反应条件为37℃ 60min,85℃ 5min, cDNA于-20℃冰箱保存;将cDNA稀释后根据All-in-One-miRNA qRT-PCR Detection Kit试剂盒说明书进行实时荧光定量PCR操作,反应条件为95℃ 10 sec, Tm-2℃ 20 sec, 72℃ 10sec,40个循环。以U6作为内参,计算CT值,所有反应均设有3个复孔。miR-320a的正向引物序列为5′-TATTCGCACTGGATACGACTCCAGC-3′,反向引物序列为5′-GTCGTATCCAGTGCAGGGTCCGAGG-3′;miR-181a的正向引物序列为5′-GCGGTAACATTCAACGCTGTCG-3′,反向引物序列为5′-GTGCAGGGTCCGAGGT-3′;TGF-β1的正向引物序列为5′-AATACGTCAGACTTCGGGAAGCA-3′,反向引物序列为5′-GTCAATGTACAGCTGCCGTACACA-3′;U6的正向引物序列为5′-CGCTTCGGCAGCACATATA-3′,反向引物序列为5′-TTCACGAATTTGCGTGTCAT-3′。
2.3 数据分析
2.3.1 芯片数据分析 (1)差异表达miRNA的筛选:杂交后的芯片经过统计分析及处理以后,癌组织与对照正常组织进行对比, 以差异倍数在两倍或者两倍以上为标准,将满足差异倍数大于2的miRNA识别为差异表达的miRNA;(2)miRNA靶基因预测:采用数据库TargetScan、miRBase进行靶基因预测;(3)miRNA靶基因的功能和通路富集分析:分别使用Gene Ontology(GO)数据库和KEGG PATHWAY数据库对差异表达miRNA调控的靶基因进行GO功能和KEGG通路富集分析,利用Fisher精确检验和多重比较检验计算每个功能的显著性水平(P值),显著性的GO和通路条目的筛选的标准为校正后的P值小于0.05。
2.3.2 qRT-PCR数据分析 根据Livak法计算表达倍数:2-[CT肿瘤组(目的基因-内参基因)-CT对照正常组织组(目的基因-内参基因)]
2.4 统计方法
所有统计学数据均用SPSS 17.0软件分析完成。以P﹤0.05为具有统计学意义。组间比较采用t检验。
3 结 果
3.1 miRNA芯片检测结果
杂交后的芯片经过统计分析及处理后,共筛选出22种miRNA存在差异表达。其中上调大于2倍的miRNA有6种:miR-181a-5p、miR-21-3p、miR-370-3p、miR- 4746-3p、miR-664b-5p、miR-6807-5p。下调差异的miRNA有16种:miR-1260a、miR-133a-3p、miR-30a-3p、miR-30e-3p、miR-320a、miR-320b、miR-320d、miR-320e、miR-338-3p、miR-361-5p、miR-378a-3p、miR-378i、miR- 4328、miR- 4770、miR- 497-5p、miR-551b-3p(表1)。
表1 食管鳞癌中表达差异的miRNAs
Table 1. Differentially Expressed miRNAs in Esophageal Squamous Cell Carcinoma
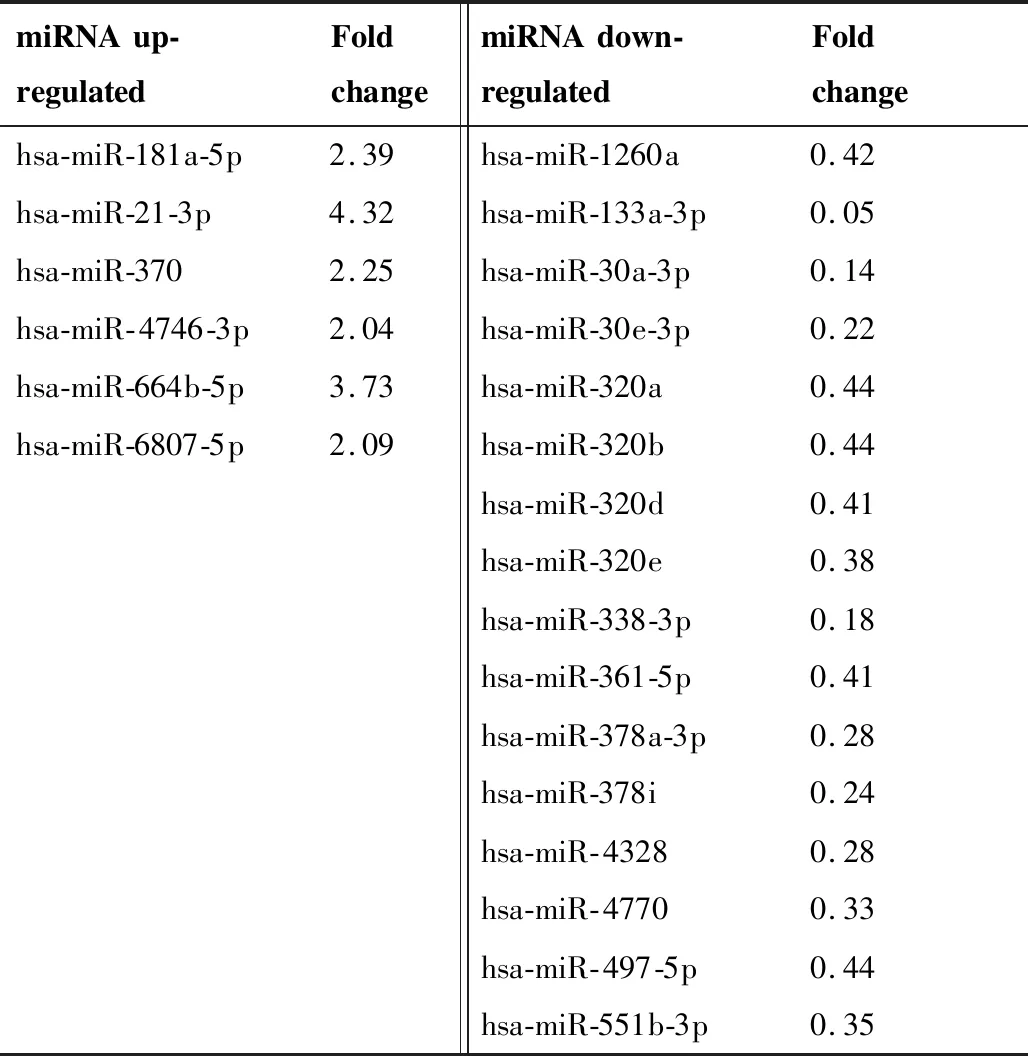
miRNAup-regulatedFoldchangemiRNAdown-regulatedFoldchangehsa-miR-181a-5p2.39hsa-miR-1260a0.42hsa-miR-21-3p4.32hsa-miR-133a-3p0.05hsa-miR-3702.25hsa-miR-30a-3p0.14hsa-miR-4746-3p2.04hsa-miR-30e-3p0.22hsa-miR-664b-5p3.73hsa-miR-320a0.44hsa-miR-6807-5p2.09hsa-miR-320b0.44hsa-miR-320d0.41hsa-miR-320e0.38hsa-miR-338-3p0.18hsa-miR-361-5p0.41hsa-miR-378a-3p0.28hsa-miR-378i0.24hsa-miR-43280.28hsa-miR-47700.33hsa-miR-497-5p0.44hsa-miR-551b-3p0.35
3.2 差异表达miRNA的靶基因预测
通过数据库TargetScan、miRBase发现,每种差异表达的miRNA都参与了多个预测靶基因的调控(表2)。这些结果表明食管鳞癌相关miRNA作用靶点广泛,且多个miRNA可共同调控部分靶基因。
表2 差异表达miRNAs的靶基因预测数
Table 2. Number of Differentially Expressed miRNA-regulated Target Genes

miRNANumberofpredictedtargetgeneshsa-miR-181a-5p679hsa-miR-21-3p469hsa-miR-37024hsa-miR-4746-3p592hsa-miR-664b-5p1224hsa-miR-6807-5p547hsa-miR-1260a1777hsa-miR-133a-3p16hsa-miR-30a-3p587hsa-miR-30e-3p203hsa-miR-320a563hsa-miR-320b94hsa-miR-320d29hsa-miR-320e1303hsa-miR-338-3p1149hsa-miR-361-5p903hsa-miR-378a-3p383hsa-miR-378i8hsa-miR-4328816hsa-miR-4770405hsa-miR-497-5p229hsa-miR-551b-3p29
3.3 差异表达miRNA的靶基因的生物学功能分析
为了进一步了解差异表达miRNA的生物学意义,对预测得到的靶基因进行GO功能分析和KEGG通路富集分析,发现激酶功能、受体功能、转录因子功能等是最显著富集的基因功能(图1),Toll样受体信号通路、多能干细胞调控信号通路、TGF-β信号通路、泛素介导的蛋白质降解等信号通路是富集最显著的信号通路(图2)。
3.4 qRT-PCR检测结果
3.4.1 miR-181a-5p、miR-320a的表达 从差异表达的miRNA中,即表达升高和下降中各挑选1个miRNA(miR-181a-5p、miR-320a)行qRT-PCR检验,其结果与芯片结果相符合:miR-181a-5p在癌组织中表达比对照正常组织高,miR-320a在癌组织中表达比对照正常组织低,差异均具有统计学意义(P<0.05)(图3)。
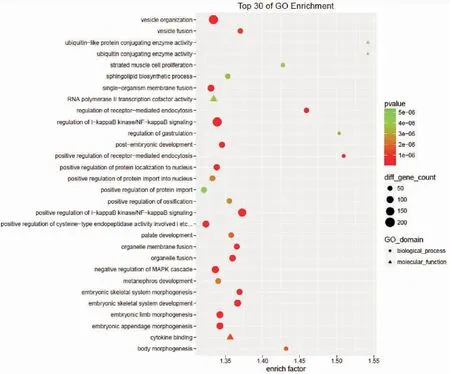
图1 靶基因功能富集的前30种
Figure 1. Top 30 GO Enrichment
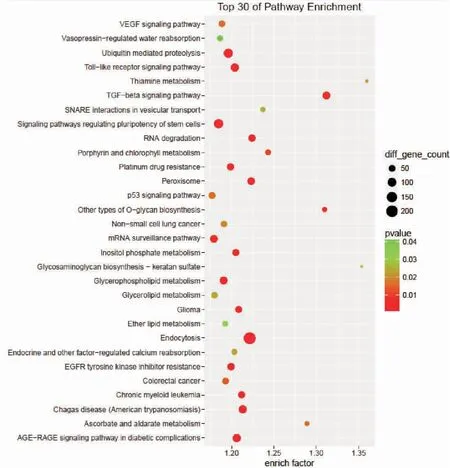
图2 靶基因富集信号通路的前30种
Figure 2. Top 30 Pathways Enrichment

图3 miR-181a-5p、miR-320a在癌组织和正常组织中的相对表达倍数
Figure 3. Expression of miR-181a-5p and miR-320a in Normal Tissue and Cancer Tissue
3.4.2 TGF-β1mRNA的表达 在对miR-181a-5p、miR-320a的靶基因和信号通路的预测中,发现TGF-β可能是两者共同的目标通路,因此采用qRT-PCR检测TGF-β1,发现TGF-β1mRNA在食管鳞癌中表达较对照正常组织中稍升高,但差异无统计学意义(P=0.067)(图4)。使用线性相关分析,发现miR-181a-5p与TGF-β1mRNA之间、miR-320a与TGF-β1mRNA之间不存在线性关系(P=0.451,P=0.173)。
3.4.3 miR-181a-5p、miR-320a表达与食管鳞癌临床病理特征中的关系 22例食管鳞癌根据年龄、有无淋巴结转移、分化程度、浸润深度、临床分期进行分组,分析miR-181a-5p、miR-320a与年龄、淋巴结转移、分化程度、浸润深度、临床分期的关系。统计学结果表明miR-181a-5p的表达与淋巴结转移的相关性有统计学意义(P=0.026),有淋巴结转移的患者miR-181a-5p的表达更高,说明高表达的患者淋巴结转移的几率更大;但miR-181a-5p的表达与分化程度、年龄、浸润深度、临床分期均无关(P﹥0.05)。miR-320a的表达与淋巴结转移、分化程度、年龄、浸润深度、临床分期均无关(P﹥0.05)(表3)。

图4 TGF-β1 mRNA在癌组织和对照正常组织的表达倍数
Figure 4. Expression of TGF-β1 in Normal Tissue and Cancer Tissue
表3 miR-181a-5p、miR-320a与临床病理特征的相关性
Table 3. Correlation between miR-181-5p/miR-320a and Clinicopathological Features
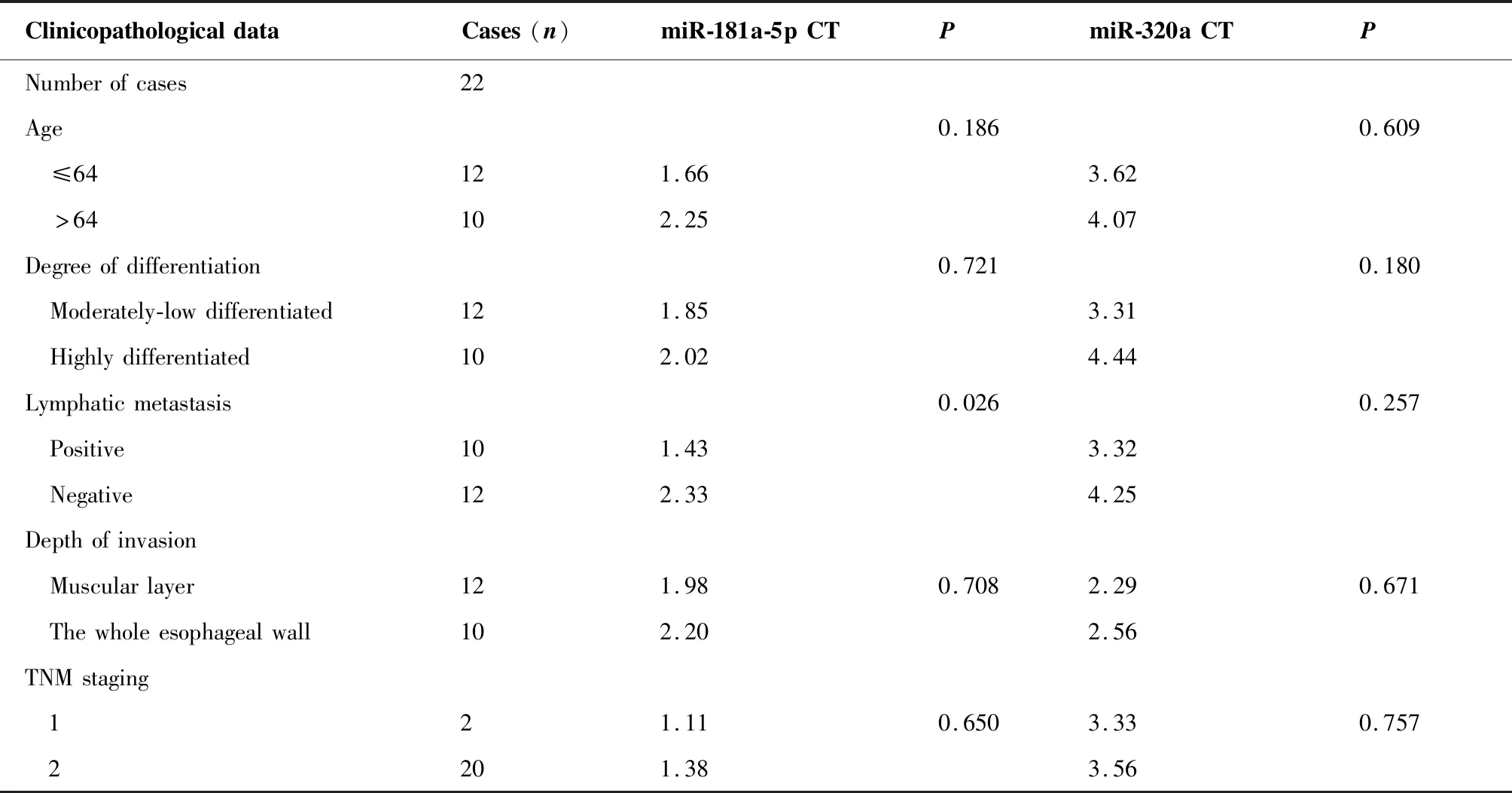
ClinicopathologicaldataCases(n)miR-181a-5pCTPmiR-320aCTPNumberofcases22Age0.1860.609 ≤64121.663.62 >64102.254.07Degreeofdifferentiation0.7210.180 Moderately-lowdifferentiated121.853.31 Highlydifferentiated102.024.44Lymphaticmetastasis0.0260.257 Positive101.433.32 Negative122.334.25Depthofinvasion Muscularlayer121.980.7082.290.671 Thewholeesophagealwall102.202.56TNMstaging 121.110.6503.330.757 2201.383.56
4 讨 论
目前食管癌的诊断主要依靠内镜与病理活检,检出率虽高,但食管癌本身症状隐匿,并且内镜存在适应范围限制,80%以上患者确诊时已进入中晚期,5年生存率仅为10%~30%[10]。miRNA主要通过与靶mRNA 的 3’UTR 序列互补结合而抑制靶mRNA的转录和翻译,调节细胞内的蛋白质表达。相比蛋白质表达,miRNA表达作为标记物更为灵敏,而且具有高度保守性、时序性和组织特异性,使其成为最具希望的潜在分子诊断和治疗靶标。
miRNA芯片技术是近年来发展起来的一种快速有效的分析miRNA表达谱的方法,本研究先应用miRNA芯片技术对食管癌组织的miRNA表达谱进行研究,发现了22个差异表达的miRNA,其中6个显著上调,16个显著下调。
Komatsu等[11]研究在食管鳞癌患者血浆中发现两种miRNA的联合检测比单一miRNA检测率高。Lou等[12]研究发现,通过溶瘤腺病毒共表达miR-34a及IL-24能够发挥协同抗肿瘤活性。已有研究发现,miR-181a-5p在食管癌、胃癌、前列腺癌、多发性骨髓瘤等多种肿瘤中表达升高[13-17],miR-320a在口腔癌、结直肠癌、膀胱癌、鼻咽癌、乳腺癌等多种肿瘤中表达下降[18-22],但miR-181a-5p和miR-320a在食管癌中的同时表达情况目前没有报道,故本研究将其作为进一步研究目标。miRNA芯片特异性及灵敏度不高,因此本研究采用具有较高的灵敏度及特异性qRT-PCR实验进行验证。研究发现癌组织中miR-181a-5p高于对照正常组织,癌组织中miR-320a低于对照正常组织,与芯片结果相符合,说明miR-181a-5p及miR-320a的异常表达可能与食管鳞癌的发生发展有着密切的关系。结合病例分析,miR-181a-5p的表达与淋巴结转移有关,并且高表达的患者淋巴结转移的几率更高,但与分化程度、年龄、浸润深度、临床分期的关系均无统计学意义(P>0.05)。miR-320a的表达与淋巴结转移、分化程度、年龄、浸润深度、临床分期的关系均无统计学意义(P>0.05)。以后的实验中将扩大样本量以及采用分子生物学技术,研究miR-181a对食管癌转移的影响。
近年来,越来越多的研究表明,miRNA通过控制肿瘤抑制基因或致癌基因的表达,调控着肿瘤细胞的增殖和转移[23-25],但所涉及的关键基因和信号通路目前还不清楚。本文应用生物信息学技术预测差异显著的miR-181a-5p和miR-320a的靶基因和信号通路,发现转化生长因子β可能是两者共同作用的目标通路。本研究采用qRT-PCR对其进行了初步分析,发现TGF-β1mRNA在食管鳞癌中升高,提示TGF-β1可能为miR-181a-5p和miR-320a调控的靶基因,但其癌组织与癌旁正常组织中的表达差异并无统计学意义(P=0.067)。分析原因可能有以下3点:1.miR-181a和miR-320a影响TGF-β1翻译,对于TGF-β1mRNA无明显影响;2.病例数较少,统计数据欠准确;3.miR-181a-5p、miR-320a与TGF-β1无直接相关,但通过其它基因和信号通路相互作用,导致肿瘤的发生发展。在以后的研究中,拟采用双荧光素酶报告基因验证TGF-β1是否为miR-181a-5p和miR-320a共同的靶基因,在细胞实验中采用分子生物学技术研究miR-181a-5p和miR-320a功能及机制,为食管癌的发病机制与诊断研究提供新的思路。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
- 肿瘤预防与治疗的其它文章
- 基于公共数据库分析脯氨酸羟化酶3在非小细胞肺癌中的表达及预后价值
- 肿瘤体积及瘤体缩减率在同步放化疗的宫颈癌患者预后中的价值*
- ADC值评估早期宫颈癌淋巴管侵犯的价值*
- 中性粒细胞/淋巴细胞比值对早期原发乳腺弥漫大B细胞淋巴瘤的临床特征及预后的影响*
- 1989~2014年中国胃癌发病率与统计年鉴指标的相关性分析*
- Clinical Benefit of Epidermal Growth Factor Receptor-Tyrosine Kinase Inhibitors Plus Radiotherapy for Epidermal Growth Factor Receptor-Mutated Metastatic Non-Small Cell Lung Cancer: A Retrospective Analysis on Real World Data

