益生菌发酵山楂浆工艺优化及品质分析
王昊宇,黄艳,李坤,朱传合
益生菌发酵山楂浆工艺优化及品质分析
王昊宇,黄艳,李坤,朱传合*
山东农业大学 食品科学和工程学院, 山东 泰安 271018
本研究以活菌数及产酸量为指标,研究耐酸驯化对植物乳杆菌、嗜酸乳杆菌和干酪乳杆菌驯化影响及山楂浆乳酸发酵最佳工艺,并对发酵前后山楂浆品质变化进行研究。研究表明,植物乳杆菌(7.25 lg (cfu/mL))、嗜酸乳杆菌(7.90 lg (cfu/mL))及干酪乳杆菌(7.45 lg (cfu/mL))经驯化均可达到乳酸菌的驯化标准(≥7.00 lg (cfu/mL))。通过单因素实验以及响应面实验确定了山楂益生发酵的最佳发酵工艺:发酵时间为12 h,料水比为1:15,发酵温度为37 ℃,接种量为12%,在此条件下,乳酸菌的产酸量为2.87 g/kg。乳酸发酵能够降低氨基态氮、电导率显著增加,还原糖含量、可溶性固形物、离心沉淀率及总色差减小。活性成分(游离态酚和黄酮、总酚和总酮)显著增加。
山楂果胶; 工艺优化; 品质
山楂(Bunge)属于蔷薇科,多分布在北温带地区,至今已有1700余年的栽培历史[1]。山楂是卫生部批准的药食两用水果,含有黄酮、有机酸、糖类、维生素、果胶、矿物质等多种营养成分,具有促进消化、降压、降脂、降糖、抗菌消炎、抗氧化等多种保健功效[2,3]。由于山楂鲜果口感酸涩,仅少部分用于鲜食。山楂加工产品山楂糖串、山楂罐头、山楂蜜饯、山楂果酱和果丹皮等又因含糖量高导致其存在很大市场局限[4]。因此,亟需一种新型山楂加工技术。
发酵果蔬汁饮料是指饮料原料(水果或蔬菜)通过乳酸菌、酵母菌或其他允许使用的菌种发酵后调配而成,酒精含量在1%(体积分数)以下的饮料[5]。果蔬益生发酵不仅能提高提高果蔬汁的营养价值、感官风味及保藏性能,还具有人体调节肠道菌群平衡作用[6-9]。不同原料其所采用发酵菌种及发酵工艺不同。因此,本文山楂片加工残次品为原料,研究山楂浆的发酵工艺、乳酸菌发酵对山楂浆品质的影响,不仅可以为工业生产山楂浆发酵提供理论基础,还可以充分利用山楂加工副产物。
1 材料与方法
1.1 实验材料与培养基
1.1.1 实验材料山楂碎肉干:莱芜万邦食品有限公司提供;乳酸菌(CICC 20265、CICC 20248和CICC 20241):购自中国工业微生物菌种保藏管理中心。
1.1.2 主要培养基MRS液体培养基:蛋白胨10.0 g、牛肉粉5.0 g、酵母粉4.0 g、葡萄糖20.0 g、吐温80 l.0 mL、K2HPO4·7H2O 2.0 g、CH3COONa·3H2O 5.0 g、柠檬酸三铵2.0 g、MgSO4·7H2O 0.2 g、MnSO4·4H2O 0.05 g,pH 6.2。将上述成分加入到1000 mL蒸馏水中,加热溶解,调节pH,分装后121 ℃高压灭菌15~20 min;MRS固体培养基:向MRS液体培养基中加1.5%琼脂;改良MRS培养基:向MRS固体培养基中加入1%碳酸钙;种子培养基:山楂:水=1:15(煮汁)。
1.2 仪器与设备
气相色谱-质谱联用仪(GC/MS- TQ8040),PB153-S分析天平,METTLER TOLEDO;HH-6数显恒温水浴锅,国华电器有限公司;TDZ5-WS台式低速离心机,湘仪离心机仪器有限公司;N-1300旋转蒸发仪,上海爱朗仪器有限公司;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司;ALPHA 1-2 LD plus冷冻干燥机,德国CHRIST。
1.3 实验方法
1.3.1 山楂浆的制备用打浆机将山楂干按照料水比1:15的比例打浆10 min,将山楂浆分装到250 mL的锥形瓶中,于高压灭菌锅中灭菌,121 ℃,20 min。
1.3.2 驯化培养基的制备将山楂浆与MRS液体培养基按体积比20:80,40:60,60:40,80:20,100:0混合,然后分装到250 mL三角瓶中,依次标记为1~5,于高压蒸汽灭菌锅中,121 ℃灭菌15 min。冷却至42~45 ℃得到驯化培养基备用。
1.3.3 逐步驯化法驯化乳酸菌按照山楂浆比例由低到高的驯化培养基进行菌株的传代培养,使这三株乳酸菌逐步适应山楂浆的培养条件。37 ℃条件下厌氧培养24 h。每代驯化次数大约在5~8次,直到能够达到试验所要求的菌落总数≥107个/mL,则认定菌种驯化成功[10]。记录各驯化培养基的活菌数和pH,验证菌种是否驯化成功。
1.3.4 生长曲线的测定采用刘丽娜等及郦金龙等报道方法进行测定[11,12]。
1.3.5 山楂浆的发酵工艺研究
1.3.5.1 单因素实验乳酸菌CICC 20265、CICC 20248和CICC 20241按照1:1:1进行复配,选取料水比1:13,1:14,1:15,1:16,1:17,1:18,发酵温度20 ℃、24 ℃、28 ℃、32 ℃、36 ℃、40 ℃,接种量2%、4%、6%、8%、10%、12%。以活菌数、还原糖含量、产酸量为指标,通过控制其他条件不变,改变其中一个因素的水平研究其对发酵山楂浆的影响。
1.3.5.2 响应面优化实验在单因素实验的基础上,以料水比(A:1:14、1:15、1:16)、发酵温度(B:32 ℃、36 ℃、40 ℃)、接种量(C:8%、10%、12%)为考察因素,根据Box-Behnken实验设计原理,采用三因素三水平的响应面分析方法。
1.3.6 乳酸菌发酵对山楂浆的基本理化指标的影响按照前面的发酵工艺优化出的最佳发酵工艺进行乳酸菌发酵山楂浆前后基本理化指标的测定。将发酵山楂浆的总酸、还原糖、可溶性固形物、氨基态氮、离心沉淀率、电导率和色度值与发酵前相比较。研究山楂浆发酵前后其基本理化指标的变化。
1.4 分析方法
1.4.1 成分测定参考GB 4789.35-2016食品微生物实验乳酸菌检验;参考GB5009.7-2016食品安全国家标准食品中还原糖的测定;采用GB/T 12456-20008 pH电位法(以乳酸计)测定总酸含量;可溶性固形物使用LH-T90型折光仪测定样品的可溶性固形物含量,参考GB/T 12143-2008的方法进行测定;氨基态氮的测定参考GB/T 12143-2008中果蔬汁饮料中氨基态氮的测定方法(甲醛值法);通过DDS-IIA型电导率仪测量样品的电导率。
1.4.2 离心沉淀率离心沉降速率的测量根据吴等人描述的方法进行[13]。稍作修改。称量约40 g的样品并以3336×g离心15 min,然后弃去上清液并称重。计算方法如下:
(%)=/"×100 %;式中::样品的离心沉淀率(%);:离心样品后沉淀物的质量(g);:离心样品前的质量(g)。
1.4.3 色度值用DC-P3全自动测色色差计测定样品的色度值(L*、a*、b*和∆E)。其中,L*表示黑白,也有说亮暗,+表示偏白,-表示偏暗;a*表示红绿,+表示偏红,-表示偏绿;b*表示黄蓝,+表示偏黄,-表示偏蓝;△E为总色差,△E数值越大,说明色差越大。
1.4.4 游离态酚类物质的提取参考Paiva方法[14],并略加修改,进行游离态酚类物质的提取。将10 g样品置于100 mL离心管中,加入10 mL 80%冷冻丙酮溶液,在500 W超声波冷水浴中超声处理60 min。然后以5000 r/min离心10 min,取出上清液。残余物再按照上述方法提取一次,两次的上清液合并、过滤,在45 ℃下蒸干,用超纯水定容至50 mL。提取样品于-20 ℃条件下保存。
1.4.5 结合态酚类物质的提取将1.4.4中残留的沉淀物加入40 mL的4 mol/L NaOH溶液中,充入氮气,密封振动反应3 h,加入6 mol/L HCl溶液调节pH值至1,通过抽滤除去残留物。滤液用2倍体积的乙酸乙酯萃取5次,在45 ℃下蒸干,残渣用超纯水溶解,定容至10 mL,并将提取物置于-20 ℃冰箱中储存备用。
1.4.6 总酚类物质含量采用Folin-Ciocalteu比色法测定总酚含量[15]。建立标准曲线,得回归方程(),=8.8631-0.0018,2=0.9997。
样品测定:准确量取1 mL样品提取稀释液,按照上述标准曲线的测定步骤测定样品的吸光值,并利用标准曲线计算样品的总酚含量。样品的总酚含量以mg GAE/100 g FW表示。
1.4.7 总黄酮含量的测定采用硝酸铝-亚硝酸钠比色法测定黄酮含量[16]。建立芦丁标准曲线,得回归方程(),=12.741-0.0059,2=0.999。
样品测定:准确吸取1 mL样品提取液,按照硝酸铝-亚硝酸钠比色法测定样品的吸光值,并利用标准曲线计算样品的总黄酮含量。样品的总黄酮含量以mg RE/100 g FW表示。
1.5 数据分析
在实验过程中利用Excel 2010、SPSS 21.0和Origin 8.0进行实验设计及数据分析,并结合方差分析进行总体比较,每个实验均做3次平行,实验结果以均值±标准差表示。
2 结果与分析
2.1 乳酸菌的驯化
2.1.1菌株驯化对活菌数的影响驯化后的培养基,分别培养3种乳酸菌,测定不同山楂浆浓度梯度的驯化培养基中3种乳酸菌的活菌数(图1)。
乳酸菌的活菌数可以直接反应驯化的成功与否。一般认为经过驯化后,乳酸菌的活菌数在达到7.00 lg (cfu/mL)以上时,便可认为驯化成功[10]。图1显示了嗜酸乳杆菌、植物乳杆菌和干酪乳杆菌在驯化前后活菌数的变化。在山楂浆含量为100%的培养基里,嗜酸乳杆菌在纯山楂浆里的活菌数仅为4.97 lg (cfu/mL)、植物乳杆菌的活菌数为4.77 lg (cfu/mL)、干酪乳杆菌仅为4.79 lg (cfu/mL)。经逐步驯化后,嗜酸乳杆菌在纯山楂浆里的活菌数可达到7.90 lg (cfu/mL)、植物乳杆菌的活菌数为7.25 lg (cfu/mL)、干酪乳杆菌的活菌数为7.45 lg (cfu/mL)。均已达到了乳酸菌的驯化标准(≥7.00 lg (cfu/mL))。

图 1 菌株驯化对活菌数的影响

图 2 菌株驯化对pH的影响
2.1.2 菌株驯化对pH的影响由图2可知,随着山楂浆比例的增加,驯化前和驯化后的pH值都逐渐降低,且驯化后的驯化培养基的pH比驯化前的pH要低。在山楂浆含量为100%的培养基里,嗜酸乳杆菌在驯化后的pH为2.74,相比驯化前的pH降低了6.78%、植物乳杆菌在驯化后的pH为2.82,相比驯化前的pH降低了6%、干酪乳杆菌在驯化后的pH为2.79,相比驯化前的pH降低了4.78 %。由此可见,说明三种乳酸菌在纯山楂浆中的生存活力增强,可以很好的适应山楂浆的酸性环境。
2.1.3 菌株驯化后的生长曲线测定乳酸菌的生长曲线,可以了解到乳酸菌在基质中的生长状况。生长曲线一般包括延滞期、对数期、稳定期和衰退期四个时期。通常根据在某时刻下乳酸菌活菌数达到最大值,选择乳酸菌的培养时间[6]。
图3显示了驯化成功的三种乳酸菌的生长曲线。由图3可以看出,三种菌均有一定的延滞期,这是因为乳酸菌在转移到新的环境中,会有短暂的适应阶段[17]。适应新的生长基质后就进入对数生长期。嗜酸乳杆菌在培养18 h后,OD值达到最大,植物乳杆菌在培养22 h后,OD值达到最大,干酪乳杆菌在培养14 h后,OD值达到最大。说明此时培养液中菌数最多。后期OD值缓慢降低,说明菌数开始减少。
2.2 山楂浆混菌发酵的工艺研究
2.2.1 发酵曲线实验发酵曲线的测定,可以确定发酵的时间。通常以在某一时刻时,活菌数达到最大值,作为最佳发酵时间。由图4可知,随着发酵时间的增加,山楂浆中的乳酸菌的活菌数逐渐增加,在发酵12 h时,乳酸菌活菌数达到最大,之后逐渐下降。因此,确定最佳发酵时间为12 h。
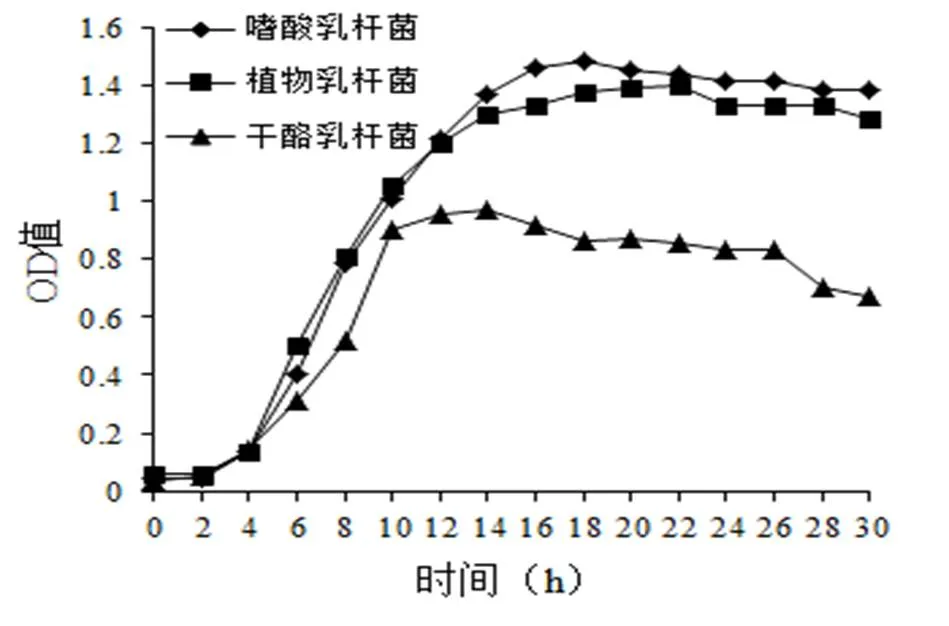
图 3 菌株驯化后的生长曲线
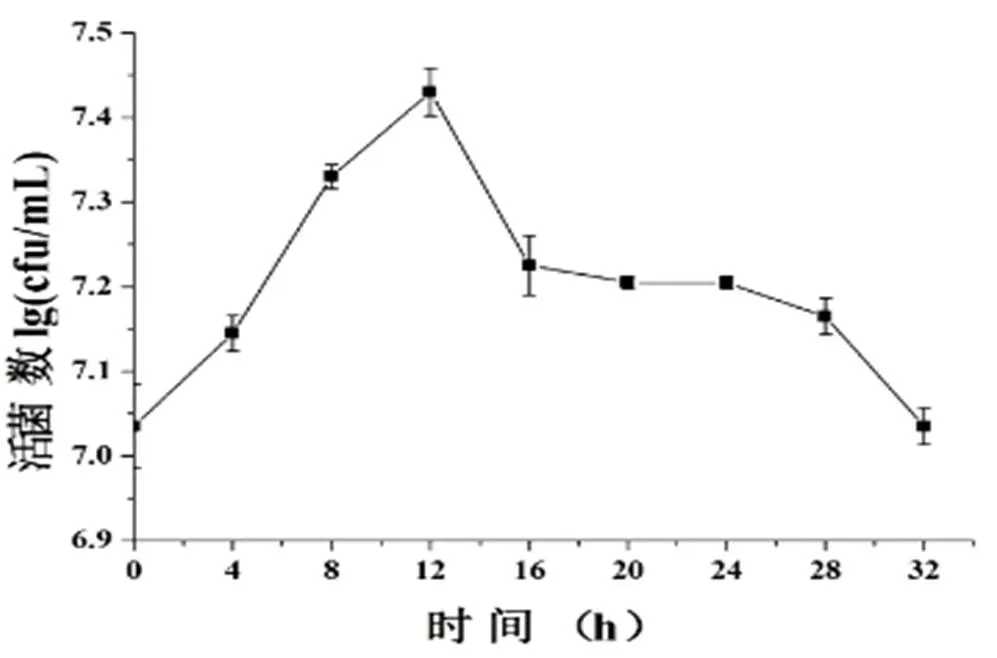
图 4 发酵曲线
2.2.2 单因素实验
2.2.2.1 料水比对山楂乳酸菌发酵的影响固定接种量10%、发酵温度36 ℃,以活菌数、产酸量和还原糖含量为指标,不同料水比(1:13、1:14、1:15、1:16、1:17、1:18)对山楂益生发酵的影响(图5)。
由图5可知,料水比对发酵山楂浆中活菌数、产酸量和还原糖含量均有显著的影响(<0.05)。随着料水比的增大,活菌数和产酸量呈现先增大后减小的趋势,而还原糖含量则呈现先减小就增大的趋势。当料水比较低时,山楂浆中的活菌数生长缓慢、产酸量较低,还原糖的含量仍较高。料水比为1:15时,山楂浆中的乳酸菌活菌数最多,产酸量最多,还原糖含量达到最低。
2.2.2.2 温度对山楂乳酸菌发酵的影响固定料水比1:15,接种量10%,,以活菌数、产酸量和还原糖含量为指标,不同料水比(20 ℃、24 ℃、28 ℃、32 ℃、36 ℃、40 ℃)对山楂益生发酵的影响(图6)。

图 5 料水比对活菌数、产酸量和还原糖含量的影响

图 6 温度对活菌数、产酸量和还原糖含量的影响
由图6可以看出,不同的发酵温度下,乳酸菌活菌数、产酸量和还原糖含量不同。随着发酵温度的升高,活菌数、产酸量先增大后减少,而还原糖含量则先减小后增大。在发酵温度为36 ℃时,山楂浆中的活菌数、产酸量达到最高,还原糖含量最低。故暂定发酵温度为36 ℃。
2.2.2.3 接种量对山楂乳酸菌发酵的影响固定料水比1:15,温度36 ℃,以活菌数、产酸量和还原糖含量为指标,研究不同接种量(2%、4%、6%、8%、10%、12%)对山楂益生发酵的影响(图7)。
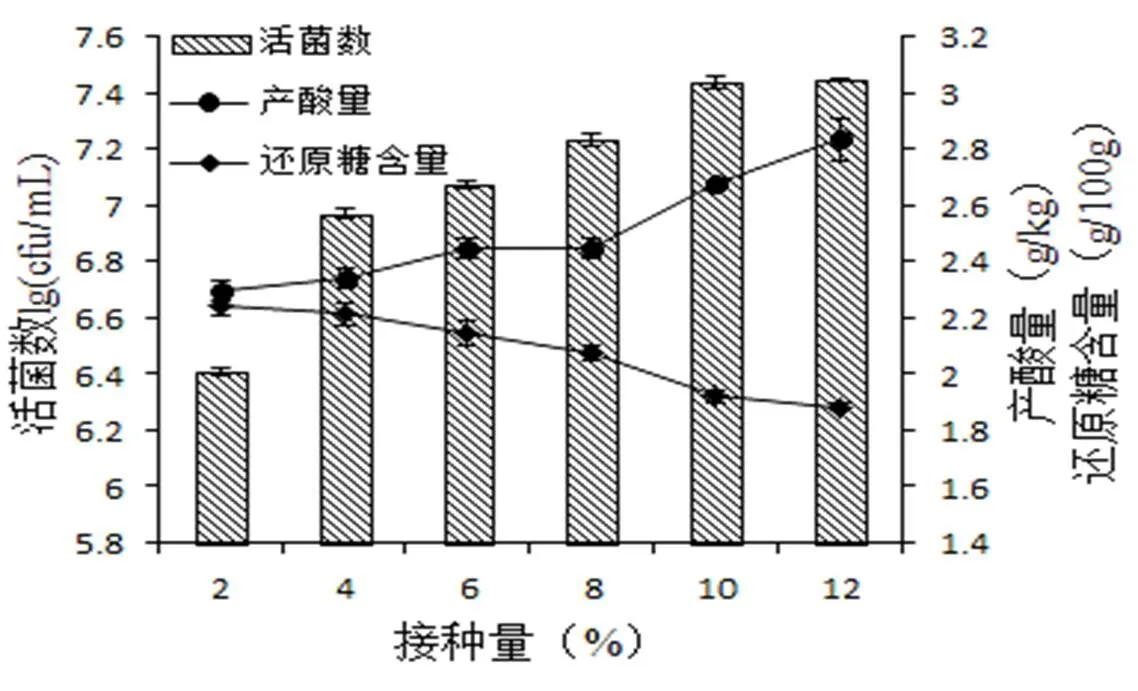
图 7 接种量对活菌数、产酸量和还原糖含量的影响
由图7所示,随着乳酸菌接种量的增加,使得乳酸菌活菌基数增加,导致乳酸菌快速增加,产酸量增加,还原糖含量降低。但是,在乳酸菌接种量为10%和12%时,乳酸菌活菌数、产酸量和还原糖含量无明显差异(>0.05)。接种量太低,导致发酵缓慢,延长发酵时间,且容易染菌;接种量太高,不仅增加成本,而且容易导致菌体自溶,影响产品的营养和口感。所以,综合考虑,暂定接种量为10%。
2.2.3 响应面优化实验(BB实验)利用Design-Expert 8对表1中的数据,进行二次线性回归拟合,得到的数学模型为:=2.44-3.750-003+0.2-0.6+0.075+7.500-003+0.1-0.422-0.682-0.22对模型进行二次线性回归拟合。

表1 BB试验设计及结果
2.2.3.1 回归模型分析用Design-Expert8.0 软件对表1中的实验结果进行回归模型分析,其分析结果见表2。由表2可知,模型为极显著(<0.01),因变量与自变量之间的线性关系显著(2=0.9945),模型调整确定系数2Adj=0.9874,说明该模型能解释98.74%响应值的变化,拟合程度较好,失拟项不显著(>0.05),表明该模型与实际情况的拟合程度较高,试验误差较小,可以用该模型预测和分析产酸量。而较低的C.V值(3.88)说明实验的可靠性及精确性。一次项、及二次项2、2、2对响应值的影响是极显著的,交互项对响应值的影响是显著的。而一次项和交互项、对响应值的影响不显著。
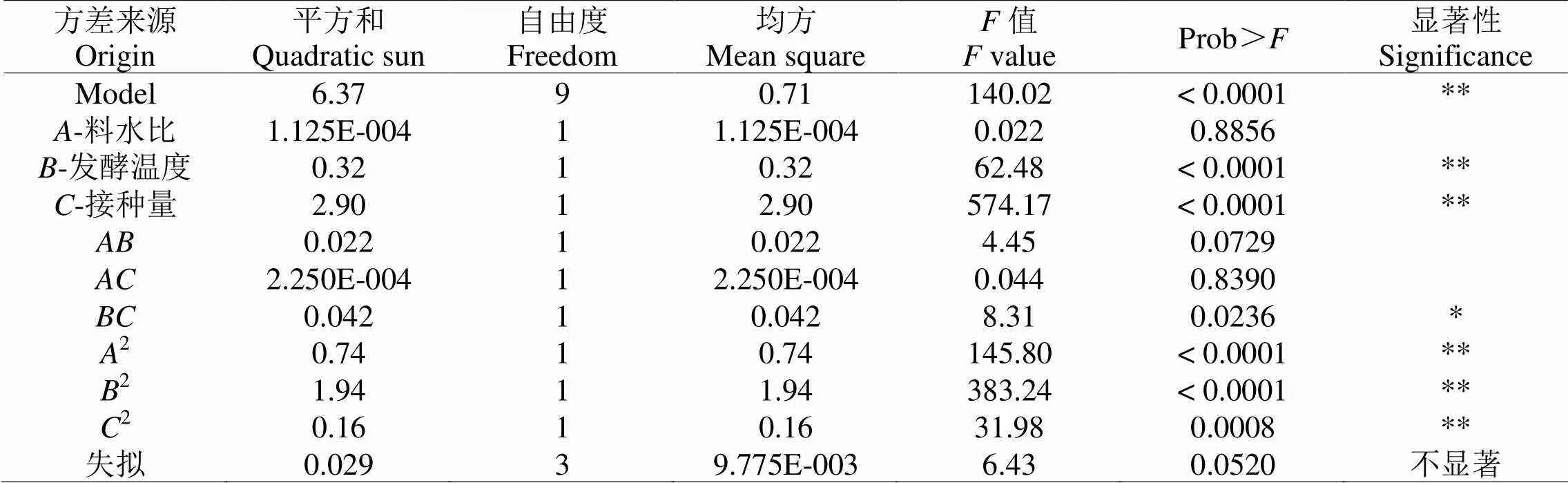
表2 回归模型的方差分析
2=99.45%,C.V. =3.88。**为差异极显著(<0.01);*为差异显著(<0.05)。
2.2.3.2 响应面曲面分析由图8可以看出,从曲面图可以看出,曲线图坡度最大,表明发酵温度和接种量对乳酸菌产酸量的影响最大。从等高线图可以看出,发酵温度()与接种量()更接近椭圆形,说明之间的交互作用更显著。其次为料水比()和发酵温度()对乳酸菌的产酸量的影响较大,之间的交互作用较显著。

图 8 三因素相互影响的响应面
2.2.3.3 最佳工艺参数和验证试验使用 design expert 8.0.6 软件的 Box-Behnken 中心设计方案对产酸量进行最大值优化,得到山楂浆的最佳发酵工艺经调整后为:料水比1:15,发酵温度37 ℃,接种量12%。验证实验产酸量平均值为2.87 g/kg,与理论预测值基本接近(>0.05)。说明响应面优化得到的乳酸菌发酵条件具有一定的可行性。
2.3 乳酸菌发酵对山楂浆的品质的影响

表3 乳酸菌发酵对山楂浆的主要理化指标的影响
*每列中字母相同者表示差异未达显著水平(>0.05),字母不同者表示差异达显著水平(<0.05)。
*showed that the differences were not significant level at>0.05 when the same letters were noted in a row, there was a significant level in different letters.
乳酸菌发酵前后山楂浆的基本理化指标会有所变化,总酸、还原糖含量、可溶性固形物、氨基态氮和电导率反映了山楂浆中乳酸菌的代谢能力以及山楂浆的品质,而山楂乳酸菌发酵前后的离心沉淀率和色泽的变化,直接影响山楂浆的品质。乳酸菌发酵对山楂浆的抗氧化能力及生物活性物质的影响乳酸菌在发酵过程中会产生多种酶,能使糖苷键和酯键等与酚酸发生分解和酸化,从而将结合的酚释放成游离酚,而游离酚的抗氧化活性要比结合酚的抗氧化活性要高[18]。由表3可知,经过乳酸菌的发酵,山楂浆中的总酸含量显著升高(<0.05),增加了30.60%,还原糖含量和可溶性固形物含量显著降低(<0.05),分别降低了10.16%和47.58%。发酵后,山楂浆中的氨基态氮含量显著升高(<0.05)。发酵后,离心沉降率显着下降(<0.05),表明山楂浆的稳定性增加。发酵前电导率也显着增加(<0.05)。色泽是影响消费者对产品接受性最重要的因素之一。发酵山楂浆的L*值较发酵前山楂浆增大,a*值和b*值较发酵前山楂浆减小,表明山楂浆发酵后偏向亮黄色。而且∆E较发酵前减小,说明经乳酸菌发酵后,山楂浆的总色差减小。经过乳酸菌混菌发酵后,游离态酚和黄酮含量显著增加(<0.05),分别增加了34.14%和53.15%。结合态酚和黄酮含量则显著下降(<0.05),分别降低了26.68%和38%。
3 结 论
通过耐酸逐步驯化,植物乳杆菌、嗜酸乳杆菌及干酪乳杆菌进行驯化均可达到乳酸菌的驯化标准(≥7.00 lg (cfu/mL))。在单因素实验的基础上,响应面实验表明发酵温度和接种量对乳酸菌产酸量的影响显著,且存在显著的交互作用。山楂益生发酵的最佳发酵工艺:发酵时间为12 h,料水比为1:15,发酵温度为37 ℃,接种量为12%。验证试验表明乳酸菌的产酸量为2.87 g/kg。与理论预测值基本接近。说明响应面优化得到的乳酸菌发酵条件具有一定的可行性。乳酸发酵能够降低氨基态氮、电导率显著增加,还原糖含量、可溶性固形物、离心沉淀率及总色差减小。活性成分(游离态酚和黄酮、总酚和总酮)显著增加。
[1] Guo QB, Du JH, Jiang Y,Pectic polysaccharides from hawthorn: Physicochemical and partial structural characterization[J]. Food Hydrocolloids, 2019,90:146-153
[2] 刘鲲,刘娜,张玉珂.山楂免疫和保健作用研究[J].光明中医,2017,32(18):2727-2730
[3] Wu JQ, Peng W, Qin RX,Crataegus pinnatifida: chemical constituents, pharmacology, and potential applications[J]. Molecules (Basel, Switzerland), 2014,19(2):1685-1712
[4] 宁苓.浅谈山楂发展现状及前景[J].新农业,2018(11):30-32
[5] 王磊,陈宇飞,刘长姣.发酵饮料的开发现状及研究前景[J].食品工业科技,2015,36(10):379-382
[6] 杨华.山楂酒糟益生发酵饮料加工工艺研究[D].泰安:山东农业大学,2017
[7] 李印.乳酸菌发酵果蔬汁在加工和贮藏过程中的品质变化与控制[D].广州:华南理工大学,2017
[8] Muñoz R, de Las Rivas B, López De Felipe F,. Chapter 4 - Biotransformation of Phenolics byin Fermented Foods[J/OL].Fermented Foods in Health and Disease Prevention, 2017,63-83. https://doi.org/10.1016/B978-0-12-802309-9.00004-2
[9] Lu YY, Putra SD, Liu SQ. A novel non-dairy beverage from durian pulp fermented with selected probiotics and yeast [J]. International Journal of Food Microbiology, 2018,265:1-8
[10] 张宏志,马艳弘,李亚辉,等.菊芋乳酸菌饮料生产工艺及稳定性研究[J].江苏农业科学,2015,43(12):291-294
[11] 刘丽娜,李顺峰,田广瑞,等.产GABA乳酸菌菌种筛选及其谷氨酸脱羧酶的酶学性质研究[J].食品科技,2018,43(6):8-12
[12] 郦金龙,师雨梦,滕超,等.老面中乳酸菌产酸性能优化及对馒头品质的影响[J].中国食品学报,2018,18(5):106-114
[13] 吴梦瑶,邢玉梅,张连城,等.甘草沙棘功能性复合饮料的研制[J].饮料工业,2017,20(5):21-24
[14] Paiva FF, Vanier NL, Berrios JDJ,. Physicochemical and nutritional properties of pigmented rice subjected to different degrees of milling[J]. Journal of Food Composition and Analysis, 2014,35(1):10-17
[15] 李厚培.多菌协酵山楂酒的工艺研究[D].济南:齐鲁工业大学,2015
[16] Hani NM, Torkamani AE, Zainul AS,. The effects of ultrasound assisted extraction on antioxidative activity of polyphenolics obtained from Momordica charantia fruit using response surface approach[J]. Food Bioscience, 2017,17:7-16
[17] 杨琳琳.益生菌发酵玫瑰花饮料的研究[D].济南:山东师范大学,2018
[18] 赖婷,刘磊,张名位,等.不同乳酸菌发酵对桂圆肉中酚类物质及抗氧化活性的影响[J].中国农业科学,2016,49(10):1979-1989
Process Optimization of Hawthorn Pulp Fermented by Probiotics and Quality Analysis
WANG Hao-yu, HUANG Yan, LI Kun, ZHU Chuan-he*
271018,
In the paper, Domestication of,andand the optimal lactic acid fermentation technology of hawthorn pulp were investigated based the colony forming unit and theacid yield. The results indicated(7.25 lg (cfu/mL)),(7.90 lg (cfu/mL)) and(7.45 lg (cfu/mL)) could all achieve to the acclimation standard of lactic acid bacteria (≥7.00 lg (cfu/mL)). The optimal fermentation process of fermented hawthornpulp was determined by single factor experiment and Response surface experiment: fermentation time was 12 h, material-water ratio was 1:15, fermentation temperature was 37 ℃, inoculum volume was 12 %. The acid production of lactic acid bacteria was 2.87 g/kg. The total acid, amino nitrogen, conductivity and active ingredients (free phenol and flavonoids, total phenols and total ketones) in the hawthorn pulp after fermentation increased significantly, and the reducing sugar content, soluble solids and centrifugal sedimentation rate decreased significantly.
Hawthorn pectin; process optimization; quality
TS255.4
A
1000-2324(2019)03-0409-07
10.3969/j.issn.1000-2324.2019.03.011
2019-03-23
2019-04-25
山东省2017年度农业重大应用技术创新项目;山东省重点研发计划(GG201703080015);山东省“双一流”奖补资金资助(SYT2017XTTD04);泰安市大学生科技创新行动计划
王昊宇(1997-),男,在校本科生,专业方向:食品质量与安全(中英). E-mail:1260193690@qq.com
Author for correspondence. E-mail:chhzhu@sdau.edu.cn

