龙胆苦苷对创伤性骨关节炎大鼠关节软骨的保护作用机制研究*
黄力鹏 吴春迎 高宏梁 陈芒芒△
(1.温州医科大学定理临床学院,浙江 温州 325000;2.浙江省湖州市中心医院,浙江 湖州313000)
当关节创伤后,关节软骨发生退行性变性和继发性增生,导致关节活动功能障碍,约有12%的患者发生骨性关节炎[1-2]。由于外伤和交通事故的增加,创伤性关节炎的发病率有增加的趋势。目前,软骨损伤后的疾病发展过程还不清楚,但多种炎性因子 [白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、一氧化氮(NO)和肿瘤坏死因子-α(TNF-α)]和氧自由基等与创伤性关节炎的发生发展密切相关[3]。核转录因子κB(NF-κB)信号通路是体内抗氧化系统中重要的通路,可调控下游的氧化应激、细胞凋亡和炎症反应等相关基因的转录[4-5]。龙胆苦苷(GPS)属于裂环环烯醚萜苷类,是龙胆科龙胆属植物龙胆的有效成分之一,具有抗炎解热、增强免疫、抗病原体等作用[6]。但龙胆苦苷在创伤性骨关节炎是否具有保护作用报道较少。因此,本研究通过探讨龙胆苦苷通过NF-κB信号通路对创伤性骨关节炎大鼠关节软骨的保护作用机制研究,为龙胆苦苷治疗创伤性骨关节炎的机制及疗效研究提供理论依据。现报告如下。
1 材料与方法
1.1 实验动物 成年雄性SD大鼠30只,体质量220~240 g,在温度为 18~24℃、湿度为 40%~70%的环境中自由进食,控制饲养环境昼夜循环(12 h/12 h),适应性喂养1周后进行实验。购自山东省医学科学院实验动物中心,许可证号:SYXK(鲁)2016-0013。
1.2 试剂与仪器 龙胆苦苷(纯度≥98%)购自南京泽朗医药科技有限公司;戊巴比妥钠购自上海上药新亚药业有限公司;鼠抗NF-κB和NF-κB抑制蛋白(I-κB)抗体购自美国Santa Cruz公司;辣根过氧化物酶HRP标记亲和纯化山羊抗鼠IgG二抗、鼠抗GADPH单克隆抗体购自武汉艾美捷科技有限公司;ELISA试剂盒购自欣博盛生物科技有限公司;Olympus DP2-BSW型病理图像采集系统购自日本奥林巴斯公司;HBS-1096B酶标仪购自南京德铁实验设备有限公司;聚丙烯酰胺凝胶电泳配制试剂盒、SDS-PAGE蛋白上样缓冲液购自碧云天生物科技有限公司BIO-RAD垂直电泳仪购自美国BD公司;凝胶成像仪购自美国UVP公司;ECL显影液购自美国Millipore公司;组织脱水机、包埋机、全自动轮转切片机等病理配套设备购自德国Leica公司。
1.3 分组与造模 将实验大鼠平均分为3组:对照组、模型组和龙胆苦苷治疗组。使用HuIth模型制作大鼠创伤性骨关节炎模型[7]。用戊巴比妥钠(300 mg/kg)腹腔麻醉后使大鼠仰卧于手术台上,对右侧后肢膝关节进行剃毛和消毒,于髌骨外侧纵切长约2 cm的切口暴露膝关节,模型组和龙胆苦苷治疗组大鼠剪断韧带后完整切除内侧半月板,对照组大鼠只切开关节腔不破坏韧带和半月板,用生理盐水清洗切口后逐层缝合切口。术后给予20万U青霉素肌肉注射,连续使用3 d。不固定肢体,在造模后第7日驱赶动物,每日2次,30 min/次,连续 4周。
1.4 干预方法 在造模后1周开始给予药物,龙胆苦苷治疗组大鼠灌胃给予50 mg/kg龙胆苦苷溶液,对照组和模型组给予等量蒸馏水,每日1次,连续8周,在最后1次给药后1 h处死大鼠,取病变部位关节,每组取5只大鼠收集软骨组织,-80℃保存备用,进行相关指标的检测;其余5只膝关节进行甲醛固定后进行病理学检测。
1.5 标本采集与检测 病理标本的制作和Mankin评分:对膝关节进行固定、脱钙、脱水、包埋、切片、HE染片后封片进行观察膝关节病理改变情况。根据Mankin法对骨关节炎组织进行评分。酶联吸附法(ELISA):检测软骨组织中NO和TNF-α含量。取出适量软骨组织,进行研碎后将相应一抗稀释至10 μg/mL,加入96孔板中,0.1 mL/孔,4℃过夜,洗涤3次,加血清0.1 mL于上述反应孔中,37℃孵育1 h;加入相对应的二抗0.1 mL,孵育 1 h;加入底物溶液0.1 mL,显色20 min;加入2 mol/L硫酸0.05 mL终止反应,于450 nm处测各孔吸光度(A)值。Western blotting法检测软骨组织中NF-κB和I-κB蛋白水平:取出适量软骨组织,据组织量加入胞蛋白抽提试液,冰浴2 h;4℃离心15 min,取上清,进行蛋白定量;调整蛋白浓度致同一浓度,加入1/5体积的5×Buffer,沸水进行变性,进行电泳、切胶;孵育一抗、4℃过夜、孵育相对于二抗,采集图像,用凝胶成像仪对免疫印迹条带灰度值并进行分析。
1.6 统计学处理 应用IBM SPSS20.0进行统计分析。实验结果以(±s)表示,分析前进行正态性检验,采用单因素方差分析进行判断,组间两两比较用SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠膝关节软骨组织病理学观察 见图1。对照组大鼠膝关节软骨表面光滑,结构清晰,细胞排列整齐呈柱状,染色质分布均匀;模型组大鼠膝关节软骨层变薄、表面不光滑,结构不清晰,细胞排列紊乱,有坏死和凋亡的细胞;龙胆苦苷治疗组膝关节软骨组织在变性、坏死方面均较模型组轻。
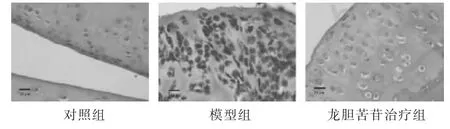
图1 各组大鼠膝关节软骨组织病理学比较(HE染色,400倍)
2.2 各组大鼠膝关节Mankin评分比较 见表1。与对照组比较,模型组和龙胆苦苷治疗组Mankin评分增加(P<0.05);与模型组比较,龙胆苦苷治疗组Mankin评分降低(P<0.05)。
表1 各组大鼠膝关节Mankin评分比较(分,±s)
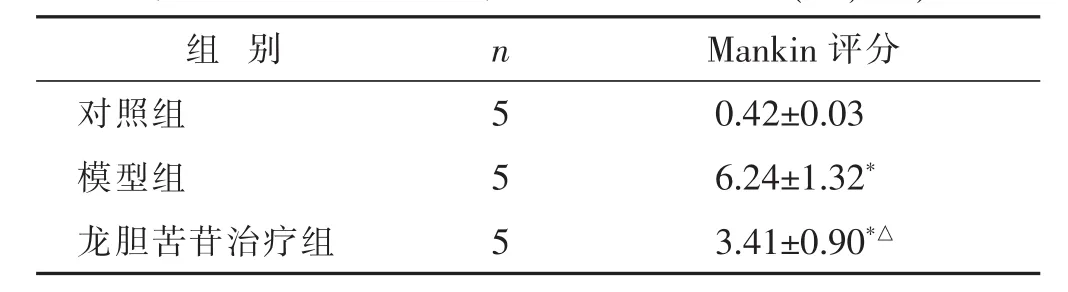
表1 各组大鼠膝关节Mankin评分比较(分,±s)
与对照组比较,*P<0.05;与模型组比较,△P<0.05。 下同
组 别 n Mankin评分对照组 5模型组 5 0.42±0.03 6.24±1.32*龙胆苦苷治疗组 5 3.41±0.90*△
2.3 各组大鼠膝关节软骨组织中NO和TNF-α含量比较 见表2。与对照组比较,模型组和龙胆苦苷治疗组大鼠膝关节软骨组织中NO和TNF-α含量增加(P<0.05);与模型组比较,龙胆苦苷治疗组大鼠膝关节软骨组织中NO和TNF-α含量降低(P<0.05)。
表2 各组大鼠膝关节软骨组织中NO和TNF-α含量比较(±s)
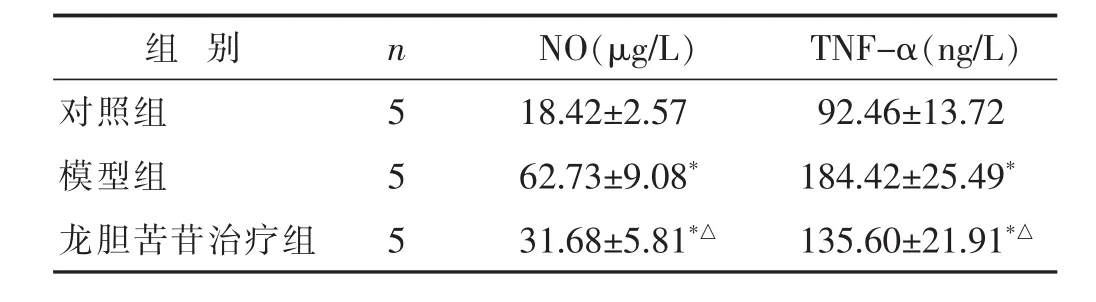
表2 各组大鼠膝关节软骨组织中NO和TNF-α含量比较(±s)
组 别 n NO(μg/L) TNF-α(ng/L)对照组 5模型组 5 18.42±2.57 92.46±13.72 62.73±9.08* 184.42±25.49*龙胆苦苷治疗组 5 31.68±5.81*△ 135.60±21.91*△
2.4 各组大鼠膝关节软骨组织中NF-κB和I-κB蛋白水平比较 见表3,图2。与对照组比较,模型组和龙胆苦苷治疗组大鼠膝关节软骨组织中NF-κB蛋白水平增加,I-κB 蛋白水平降低(P<0.05);与模型组比较,龙胆苦苷治疗组大鼠膝关节软骨组织中NF-κB蛋白水平降低,I-κB 蛋白水平增加(P<0.05)。
表3 各组大鼠膝关节软骨组织中NF-κB和I-κB蛋白水平比较(±s)
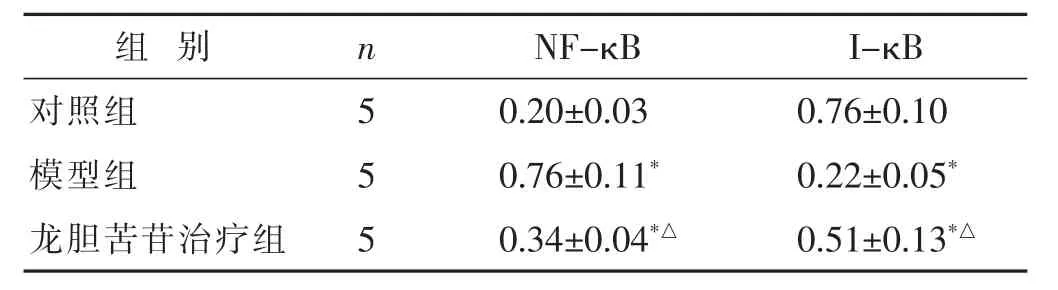
表3 各组大鼠膝关节软骨组织中NF-κB和I-κB蛋白水平比较(±s)
组 别 n NF-κB I-κB对照组 5模型组 5 0.20±0.03 0.76±0.10 0.76±0.11* 0.22±0.05*龙胆苦苷治疗组 5 0.34±0.04*△ 0.51±0.13*△
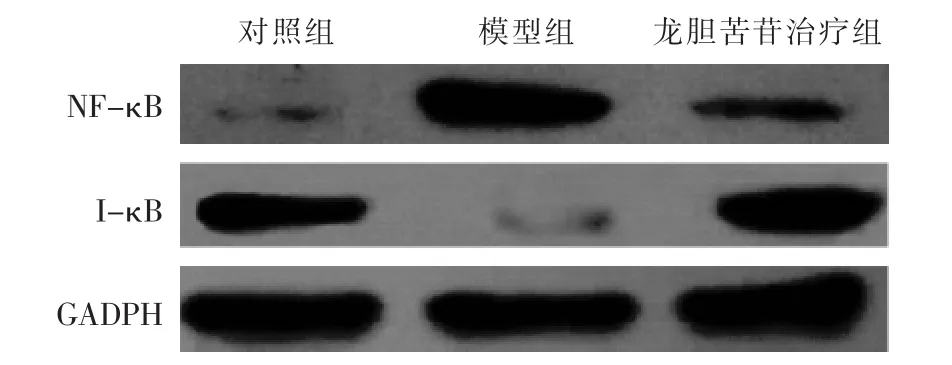
图2 各组大鼠膝关节软骨组织中NF-κB和I-κB蛋白电泳条带
3 讨 论
创伤性骨性关节炎在中医学属于“痹证”中的“骨痹”范畴,以“风寒湿痹阻”和“气滞血瘀”多见,病机为风寒湿邪入侵经络有关,导致经络阻滞,形成骨性关节炎[8]。目前对骨性关节炎的治疗尚缺乏有效的治疗手段,尤其是早期治疗,最终只能通过关节置换来缓解病痛和改善功能。而从发病到关节置换是一个漫长过程,这期间给患者在精神和经济上带来一定的压力。发挥中医学的优势,通过中医理论寻找相应的治疗药物成为治疗骨性关节炎乃至更多疾病的突破口。龙胆苦苷是龙胆的主要有效成分,龙胆具有“活血舒筋、祛风除湿”功能,多配伍治疗关节疼痛[9]。但目前龙胆苦苷对骨性关节炎的治疗机制还不清楚。由于伦理学的限制,需要制作创伤性骨性关节炎的动物模型。Hulth模型是作用膝关节炎的经典动物模型,借助手术使关节不稳定而诱发骨性关节炎,此方法特别适用于软骨病理改变的研究。本研究通过病理及大鼠膝关节Mankin评分显示,大鼠创伤性骨性关节炎成功模型造模成功。
关节炎大多伴随着明显的红、肿、热、痛、功能受限,提示炎症在关节炎的发生发展过程中扮演了重要作用,IL-1β、IL-6、NO 及 TNF-α 等炎症因子与痛风性关节炎(TBI)急性期密切相关[10-12]。 TNF-α 和 NO 是炎症反应的两个关键细胞因子[13]。TNF-α是炎症后最早出现的细胞因子,主要由巨噬细胞和淋巴细胞产生,当他们过度表达时介导炎症因子趋化作用而加剧瀑布样炎症反应,最终导致组织损伤[14]。研究发现,通过减少或拮抗TNF-α的产生可以改善急性肺损伤大鼠的生存状况[15]。在炎症发生时,细胞内一氧化氮合酶经TNF-α诱导后大量表达NO,大量表达的NO又加剧了瀑布样炎症反应[16]。本研究结果显示,模型组软骨组织中TNF-α和NO水平明显增高,在给予龙胆苦苷后都有不同程度的下降,说明龙胆苦苷在一定程度上抑制了炎症因子的表达。
探讨龙胆苦苷抗炎的作用机制,为其药理作用的开发具有积极的促进作用。研究发现,NF-κB信号通路与炎症的发生发展密切相关[17]。细胞膜上的Toll样受体4(TLR-4)能够特异性识别炎症信号,通过TLR-4跨膜信号转导激活NF-κB信号通路,进一步放大炎症反应[18]。NF-κB是炎症、应激的主要调节器,当细胞处于静息状态时,滞留于细胞质中,当NF-κB在接受了转录因子NF-E2相关因子2(Nrf2)的信号后,很快进入细胞核,与基因中的κB位点进行结合,促进基因的转录,启动细胞凋亡等引起细胞损伤[19]。I-κB能与NF-κB结合形成非活性的二聚体,抑制了NF-κB在细胞质和细胞核之间的穿梭,同时在细胞质和细胞核中发挥作用[20]。本研究结果显示,模型组软骨组织中NF-κB明显增高,在给予龙胆苦苷后I-κB表达增加,NF-κB合成受到抑制,说明NF-κB信号通路被抑制。
综上所述,龙胆苦苷能够改善创伤性骨关节炎大鼠关节软骨的形态、降低软骨组织中NO和TNF-α含量,其机制可能与降低了NF-κB蛋白水平,抑制NF-κB信号通路,为龙胆苦苷的药用价值的开发提供了一定的理论依据。

