重组人促红细胞生成素对肝细胞模拟缺血/再灌注损伤的保护作用
李龙,温陈,解维敏,刘文玉,刘波,陶开山,窦科峰,慕喜喜,3(.神木市医院肝胆外科,陕西 神木 79300;.空军军医大学西京医院肝胆外科,陕西西安 7003;3.西安市中心医院普通外科,陕西 西安 70003)
由于移植外科技术的成熟以及新型免疫抑制药物的开发,越来越多的终末期肝功能衰竭患者选择进行肝移植来挽救生命,由此造成严重的供肝短缺,并引起边缘供肝的使用逐渐增加,但是此类供体肝脏对缺血/再灌注损伤(ischemia reperfusion injury,IRI)十分敏感,常常预后不良[1-2]。尽管有学者已开始尝试无血流阻断肝移植,并取得初步成果[3-4],但IRI仍是肝移植手术中无法避免的重要环节,严重影响移植肝的预后[5]。在移植肝IRI过程中伴随着活性氧自由基的释放,由此引发氧化损伤[6],常常导致细胞凋亡、坏死,包括引发细胞过度自噬死亡[7]。自噬(autophagy)是细胞利用胞内溶酶体降解受损、变性、衰老的蛋白质,实现物质和能量的回收利用,从而维持细胞稳态,但自噬活性过高会诱发细胞Ⅱ型程序性死亡[8]。促红细胞生成素(erythropoietin,EPO)主要由肾脏分泌促进红细胞生成来应对缺氧。有研究表明,EPO还具有抗炎、抗氧化、抗凋亡等作用,有学者认为其可能是一种细胞保护因子[9]。重组人促红细胞生成素(recombinant human erythropoietin,rhEPO)是通过DNA重组生产的EPO,其序列和生物活性均与内源性EPO相同。本研究拟采用H2O2建立肝细胞缺氧/复氧培养模型,探索rhEPO处理对肝细胞模拟IRI的保护作用,以及与肝细胞自噬活性的关系,揭示其可能涉及的分子机制。
1 材料与方法
1.1 材料:大鼠肝细胞株BRL3A购于上海中科院细胞库。rhEPO购自克隆生物高技术有限公司。30% H2O2试剂购自国药集团化学试剂有限公司。吖啶橙染色试剂盒购自Sigma。CCK-8检测试剂盒购自碧云天生物技术研究所。Western blot检测抗体:anti-LC3B、anti-p62、anti-p-p85(1∶1 000)、anti-p85(1∶ 500)购自Abcam,anti-p-AKT(1∶500)、anti-AKT (1∶1 000)购自CST,anti-βactin (1∶300)购自Abmart,HRP标记的二抗购自碧云天生物技术有限公司。PrimeScript RT Master Mix试剂盒购自Takara。BCA蛋白检测试剂盒购自碧云天生物技术有限公司。天冬氨酸转氨酶 (aspartate aminotransferase,AST)和丙氨酸转氨酶(alanine aminotransferase,ALT)测定试剂盒购自Sigma。
1.2 细胞培养与分组:取指数生长期的BRL3A细胞,按照2000个 (100 μl·孔) 的密度种植于96孔板,加入H2O2(终浓度为200 μmol/L)刺激细胞2 h,取3代培养的BRL3A细胞随机分为4组:① 正常对照组;② H2O2处理组;③ H2O2+10 U/ml rhEPO处理组;④ H2O2+ 20 U/ml rhEPO处理组,每组分为6个复孔。
1.3 细胞存活率的检测:将各组细胞继续培养4 h后,采用CCK-8测定细胞存活率,每孔(200 μl体积溶液)加入10 μl的CCK-8溶液,然后用加入了相应体积的细胞培养液以及CCK-8溶液,不含细胞的孔作空白对照。放入培养箱内继续孵育约1 h左右,用酶标仪检测,在450 nm测定吸光度值。各孔OD值为实际OD值减去空白对照组OD值,每组复孔去掉最大值和最小值 (n=6孔),取均数。重复实验(n=3次),根据结果绘制细胞存活曲线。
1.4 转氨酶释放测定:取各组培养细胞的上清液,按照试剂盒说明书的方法,化学比色法测定培养液中AST、ALT的含量。
1.5 吖啶橙染色检测肝细胞自噬小体形成:24孔板培养孔中加入细胞爬坡玻璃片(预先消毒处理),按上述实验分组,每组3个复孔。将各组细胞继续rhEPO处理4 h后,去除培养基,无菌PBS洗3遍,然后向各孔中加入吖啶橙荧光染色液,保持吖啶橙染液终浓度20 μg/ml,进行室温孵育约15 min。移除染色液后,用无菌的PBS清洗约4遍,置于倒置荧光显微镜下,观察染色结果。
1.6 Western Blot检测:样品中加入蛋白酶抑制剂后,在冰上裂解细胞,提取蛋白99℃变性10 min。BCA蛋白检测试剂盒检测蛋白浓度。制作10%的SDS-PAGE分离胶,蛋白上样后电泳,110 V,120 min。转膜,220 mA,40 min。5%牛奶封闭后,加入一抗4℃孵育过夜。用辣根过氧化物酶标记的二抗,室温孵育1 h。最后用ChemiDocTM XRS +和Image Lab TM software显影,并计算条带灰度值。
2 结 果
2.1 rhEPO可以逆转H2O2导致的BRL3A细胞存活率下降(表1、图1):H2O2处理后的BRL3A细胞存活率明显下降(95.36±3.12%比57.82±2.54%,P<0.05),经过不同浓度的rhEPO处理后,BRL3A细胞存活率有不同程度升高,差异有统计学意义(P<0.05)。
表1 BRL3A细胞存活率(±s)

表1 BRL3A细胞存活率(±s)
注:与对照组比较,aP<0.05;与200 μmol/L H2O2处理组比较,bP<0.05
组别 例数(例) 存活率(%)正常对照组 3 95.36±3.12 H2O2处理组 3 57.82±2.54a H2O2 +10 U/ml rhEPO处理组 3 72.55±2.79b H2O2 +20 U/ml rhEPO处理组 3 81.63±3.45b

图1 CCK-8测定各组BRL3A细胞存活率
2.2 各组BRL3A细胞上清中转氨酶的含量(表2、图2):H2O2处理后的BRL3A细胞上清中AST和ALT的释放量明显增加〔AST(U/L):574±21.34比75±11.63;ALT(U/L):378±16.42 比 66±10.21,P<0.05〕;经过不同浓度的rhEPO预处理,AST和ALT的释放量明显下降,与200 μmol/L H2O2处理组比较,差异有统计学意义(P<0.05)。
表2 各组细胞培养上清中转氨酶比较(IU/L,±s)
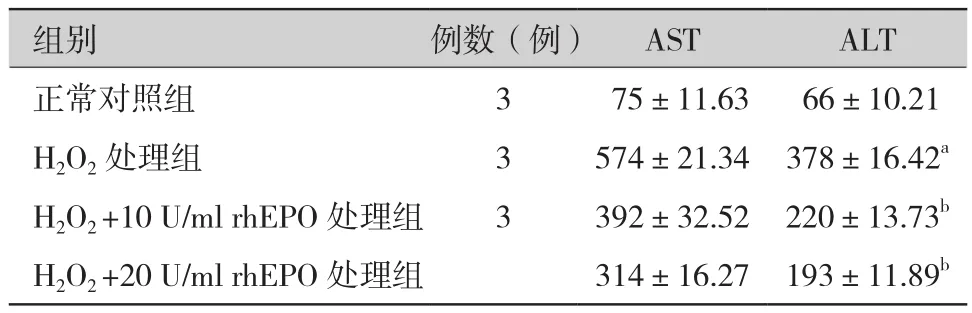
表2 各组细胞培养上清中转氨酶比较(IU/L,±s)
注:与对照组比较,aP<0.05;与200 μmol/L H2O2 处理组比较,bP<0.05
组别 例数(例) AST ALT正常对照组 3 75±11.63 66±10.21 H2O2处理组 3 574±21.34 378±16.42a H2O2 +10 U/ml rhEPO处理组 3 392±32.52 220±13.73b H2O2 +20 U/ml rhEPO处理组 314±16.27 193±11.89b

图2 化学比色法检测培养上清中AST和ALT含量
2.3 rhEPO能明显抑制H2O2导致的BRL3A细胞致死性自噬活性,使胞内自噬小体明显减少(图3):为测定各组BRL3A细胞的自噬活性,本研究中采用吖啶橙染色。正常对照组BRL3A细胞自噬活性水平较低,经H2O2处理后,BRL3A细胞自噬活性明显升高,胞内酸性小体增加,发生自噬性死亡。给予不同浓度的rhEPO处理后,BRL3A细胞自噬活性得到明显抑制,其中20 U/ml rhEPO处理组的胞内酸性小体的数量明显减少,和H2O2组比较,差异具有统计学意义(P<0.05)。
2.4 rhEPO处理能明显抑制LC3-Ⅱ蛋白表达,同时p62蛋白增多(图4):LC3B蛋白分子两个亚型,两者的比例可以反映细胞自噬的活性强弱,当自噬增强时,形成酸性自噬小体,使LC3-Ⅰ向LC3-Ⅱ转变,同时,随着细胞自噬活性增强,自噬相关蛋白p62会成比例的降解。与对照组相比,H2O2处理可引起BRL3A细胞自噬活性增加,LC3-Ⅰ向LC3-Ⅱ转变,同时,自噬相关蛋白p62被大量降解,差异具有统计学意义(P<0.05)。给予rhEPO处理后,特别是在20 U/ml rhEPO浓度下,BRL3A细胞自噬活性被明显抑制,与H2O2处理组比较,LC3-Ⅱ/LC3-Ⅰ的比例显著下降,同时伴随有p62蛋白的重新堆积,提示BRL3A细胞致死性的自噬行为被逆转。

图3 吖啶橙染色检测BRL3A细胞胞内自噬小体的形成

图4 Western-Blot检测各组培养BRL3A细胞中自噬相关蛋白LC3-Ⅱ和p62的表达变化
2.5 rhEPO处理能显著增加p-p85和p-AKT表达,活化PI3K/AKT信号通路(图5):检测p85和AKT的磷酸化蛋白p-p-p85和p-AKT的表达量,观察信号通路PI3K/AKT的活化水平。与正常对照组相比较,H2O2处理可引起BRL3A细胞p-p85和p-AKT的表达量下降。给予rhEPO处理后,磷酸化蛋白p-p85和p-AKT的表达又出现增多,这和BRL3A的自噬活性变化水平相一致。
3 讨 论
多种肝脏外科操作中,如肝切除、肝移植等,肝脏组织都将不可避免的面临组织IRI[10]。然而,迄今为止,其具体的损伤机制尚未完全阐明,在临床上也始终缺乏有效的干预手段。研究证实,无氧代谢与酸中毒、钙离子超载、氧自由基的生成、细胞凋亡、内皮素、肝脏微循环衰竭、补体系统、热休克蛋白等均参与其中[11]。

图5 Western Blot检测各组培养BRL3A细胞中PI3K/AKT信号通路蛋白p-p85和p-AKT的表达变化
缺氧/复氧模型是体外从细胞水平研究IRI的理想模型[12],且有研究证实利用H2O2可成功建立细胞缺氧/复氧损伤模型[13]。本研究通过建立肝细胞模拟缺血/再灌注损伤的体外培养模型,利用H2O2释放的活性氧自由基,造成大鼠BRL3A肝细胞的氧化应激损伤,然后给予rhEPO观察其对细胞损伤的防御或修复效应,结果显示,其能有效提升氧化应激环境下肝细胞的生存能力。既往研究发现EPO不仅能够促进红细胞生成,提高机体的携氧能力,改善组织器官缺氧,同时还具备许多特殊的生理功能,如抗炎[14-15]、抗凋亡[16]、促进血管生成[17]等。我们的结果说明,EPO具有显著的抗氧化损伤功能,且这种保护作用与rhEPO浓度呈正相关。
值得注意的是,近年来,许多学者还发现肝脏IRI过程中还存在着特殊的细胞生理活动,即自噬现象[18]。生理状况下,肝脏组织细胞保持着低水平的自噬活性,通过物质和能量循环来维持细胞的稳态[19]。但在一些应激条件下,这种自噬活性会被放大,打破这种稳态平衡,形成细胞Ⅱ型程序性死亡,称之为自噬性死亡[20-21]。本研究中在给予H2O2刺激后,吖啶橙染色可观察到肝细胞胞质中出现大量的酸性自噬小体,同时,可检测到微管相关蛋白1轻链3(microtubuleassociated protein 1 light chain 3,LC3/Atg8)亚型LC3-Ⅰ向LC3-Ⅱ的转变,且p62大量降解[22],提示H2O2加强了肝细胞的自噬活性,结合细胞存活率下降,我们推测这种过度强化的自噬现象即为致死性细胞自噬。自噬涉及多种信号调节通路,如PI3K/AKT/mTOR[23]、MAPK/ERK1/2[24]、p53/Genotoxic Stress[25]、AMPK[26]等,其中最为经典的即为PI3K/AKT/mTOR信号通路,PI3K/AKT的磷酸化可促进mTOR的活化,对细胞自噬产生明显的抑制作用,反之,即可启动细胞自噬[27-28]。研究证实,mTOR作为该通路的关键效应分子,激活的mTOR,即p-mTOR可以抑制以及破坏自噬体的形成,反馈调节细胞的自噬水平[28-29]。本研究中 H2O2刺激细胞后,p-p85和p-AKT的表达明显下降,说明PI3K/AKT的磷酸化程度变低,提示PI3K/AKT信号被抑制,细胞自噬过程被加强,即形成过度激活现象,导致肝细胞死亡。给予rhEPO处理后,p-p85和p-AKT的表达回升,PI3K/AKT的磷酸化导致mTOR被激活,自噬效应得到明显的抑制。本研究的不足之处在于没有进一步做mTOR的蛋白水平检测,以进一步验证我们的猜想,后续需要进一步检测磷酸化mTOR,完善相关的分子机制。

