油酸微生物计数方法适用性试验研究
刘娜,潘雯,张红霞
(1. 西宁联勤保障中心药品仪器监督检验站,甘肃 兰州 730000;2. 广州市药品检验所,广东 广州 510000)
油酸是一种常见的药用辅料,该品种在现行版美国药典(USP)、英国药典(BP)、欧洲药典(EP)辅料中都有收载,但无微生物限度检查项,在中国药典(CHP)及日本药典(JP)中均未收载该品种;USP、EP、CHP中仅规定药用辅料限度为需氧菌总数不得过103CFU/g,霉菌和酵母菌总数不得过102CFU/g。本文通过试验,首次确定了油酸的微生物限度检查方法,该方法操作简便,结果可靠。
1 仪器与试药
1.1 样品
油酸原料药:生产企业:德国Lipoid Gmgh公司;批号:520200-2150681;520200-2150682;520200-2150683
1.2 试验环境
在C级受控洁净环境,局部A级单向流空气的无菌室内进行。阳性菌操作在符合国家Ⅱ级生物安全标准的生物安全柜内进行。
1.3 适用性试验用菌种
金黄色葡萄球菌(Staphylococcus aureus) [CMCC(B)26003] 、铜绿假单胞菌(Pseudomonas aeruginosa)[CMCC(B)10104] 、大肠埃希菌(Escherichia coli)[CMCC(B)44102] 、枯草芽孢杆菌(Bacillus subtilis)[CMCC(B)63501] 、白色念珠菌(Candida albicans)[CMCC(F)98001] 、黑曲霉(Aspergillus niger)[CMCC(F)98003] 的冷冻干燥第0代菌种,由中国食品药品检定研究院提供,经本实验室菌种复苏和确认,实验中使用第三代培养物。
1.4 稀释液
pH7.0无菌氯化钠-蛋白胨缓冲液(批号:151103),由北京三药科技开发公司提供。
1.5 仪器
HVE-50型高压灭菌器(日本HIRAYAMA);PL602-L型电子天平(梅特勒-托利多仪器上海有限公司);HVE-50BSC-1360A2 型生物安全柜(北京东联哈尔仪器制造有限公司);SLI-1200型恒温培养箱(上海爱朗仪器有限公司);MJPS-250型霉菌培养箱(上海精宏实验设备有限公司);JLQ-S1型菌落计数器(江苏无锡市电化教具厂);XW-80A型旋涡混合器(上海医科大学仪器厂);DK-S型电热恒温水浴锅(上海森信实验仪器有限公司)。
1.6 培养基与试剂
胰酪大豆胨肉汤培养基(批号:170523),沙氏葡萄糖肉汤培养基(批号:170706),沙氏葡萄糖琼脂培养基(批号:170613),胰酪大豆胨琼脂培养基(批号:170627),麦康凯液体培养基(批号:1704242),麦康凯琼脂(批号:170330),卵磷脂吐温80醇液(批号:160422)(含0.1%卵磷脂,0.7%吐温80),聚山梨酯80,均由北京三药科技开发公司提供,本实验室培养基适用性检查结果证明上述批次的培养基均符合2015年版中国药典要求。
2 方法
2.1 常规法
采用常规法对3批样品进行3次独立的平行试验。
2.2 菌液的制备
分别接种金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、枯草芽孢杆菌至胰酪大豆胨肉汤培养基,35℃培养24小时。接种白色念珠菌至沙氏葡萄糖肉汤培养基,25℃培养2~3天,备用。接种黑曲霉至沙氏葡萄糖琼脂斜面培养基,25℃培养5~7天,洗脱孢子,备用。以上试验菌用无菌生理盐水按10倍稀释使接入菌量不大于100 cfu,备用。
2.2 稀释剂的选用
经试验考察,最终确定选用含0.1%卵磷脂和0.7%聚山梨酯80的pH 7.0无菌氯化钠-蛋白胨缓冲液作为稀释剂。
2.3 需氧菌总数、霉菌及酵母菌计数方法适用性试验
2.3.1 供试液的制备无菌吸取油酸10 mL,加含0.1%卵磷脂和0.7%聚山梨酯80的pH7.0无菌氯化钠-蛋白胨缓冲液至100 mL,作为1︰10的供试液。
2.3.2 供试品对照组取1:10供试液1 mL,倾注含0.1%卵磷脂和0.7%聚山梨酯80的胰酪大豆胨琼脂培养基,30℃~35℃,培养3天,沙氏葡萄糖琼脂培养基,20℃~25℃,培养5天,计数。
2.3.3 稀释剂对照组取含0.1%卵磷脂和0.7%聚山梨酯80的pH7.0无菌氯化钠-蛋白胨缓冲液替代供试液,按试验组操作加入试验菌,培养,计数。
2.3.4 试验组取5支试管各加入1∶10供试液9.9 mL,每管分别加入金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉0.1 mL,从试管中取1 mL,操作方法如2.3.2供试品对照组,倾注含0.1%卵磷脂和0.7%聚山梨酯80的胰酪大豆胨琼脂培养基,30℃~35℃,培养3天;另取2支试管各加入1∶10的供试液9.9 mL,每管分别加入白色念珠菌、黑曲霉0.1 mL,从试管中取1 mL同上操作,倾注沙氏葡萄糖琼脂培养基,20℃~25℃,培养5天,计数。
2.3.5 菌液组取pH7.0无菌氯化钠-蛋白胨缓冲液替代供试液,按试验组操作加入试验菌,培养,计数。(注:所加菌液的体积不超过供试液体积的1%。)
2.3.6 回收率计算公式

2.3.7 实验结果
供试品制备成含0.1%卵磷脂和0.7%聚山梨酯80的1︰10供试液,采用常规法对金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉进行试验,在含0.1%卵磷脂和0.7%聚山梨酯80的TSA平板上的比值均在0.5~2范围内;对白色念珠菌、黑曲霉进行试验,在SDA平板上的比值均在0.5~2范围内。见表1和表2。
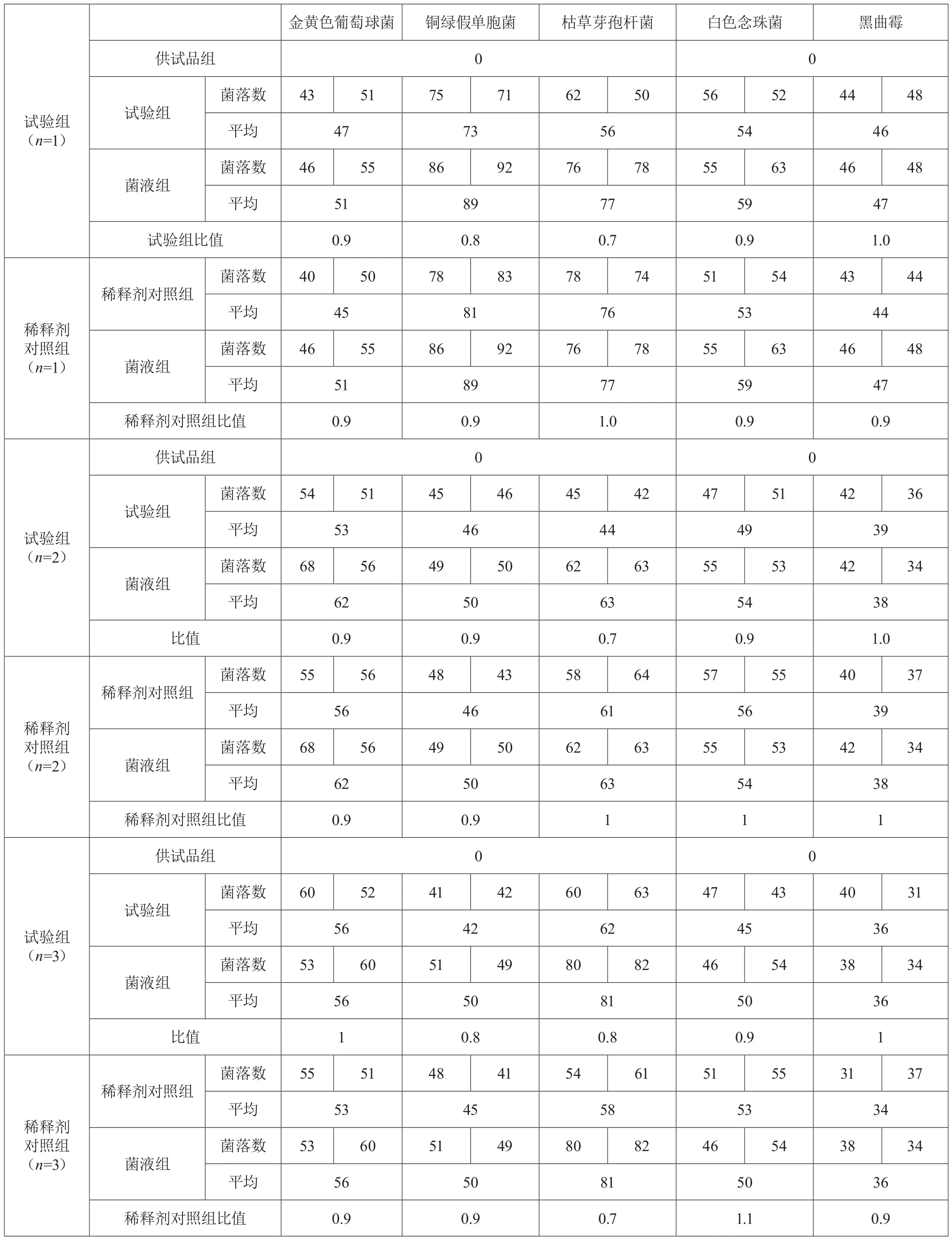
表1 需氧菌总数计数法适用性试验结果
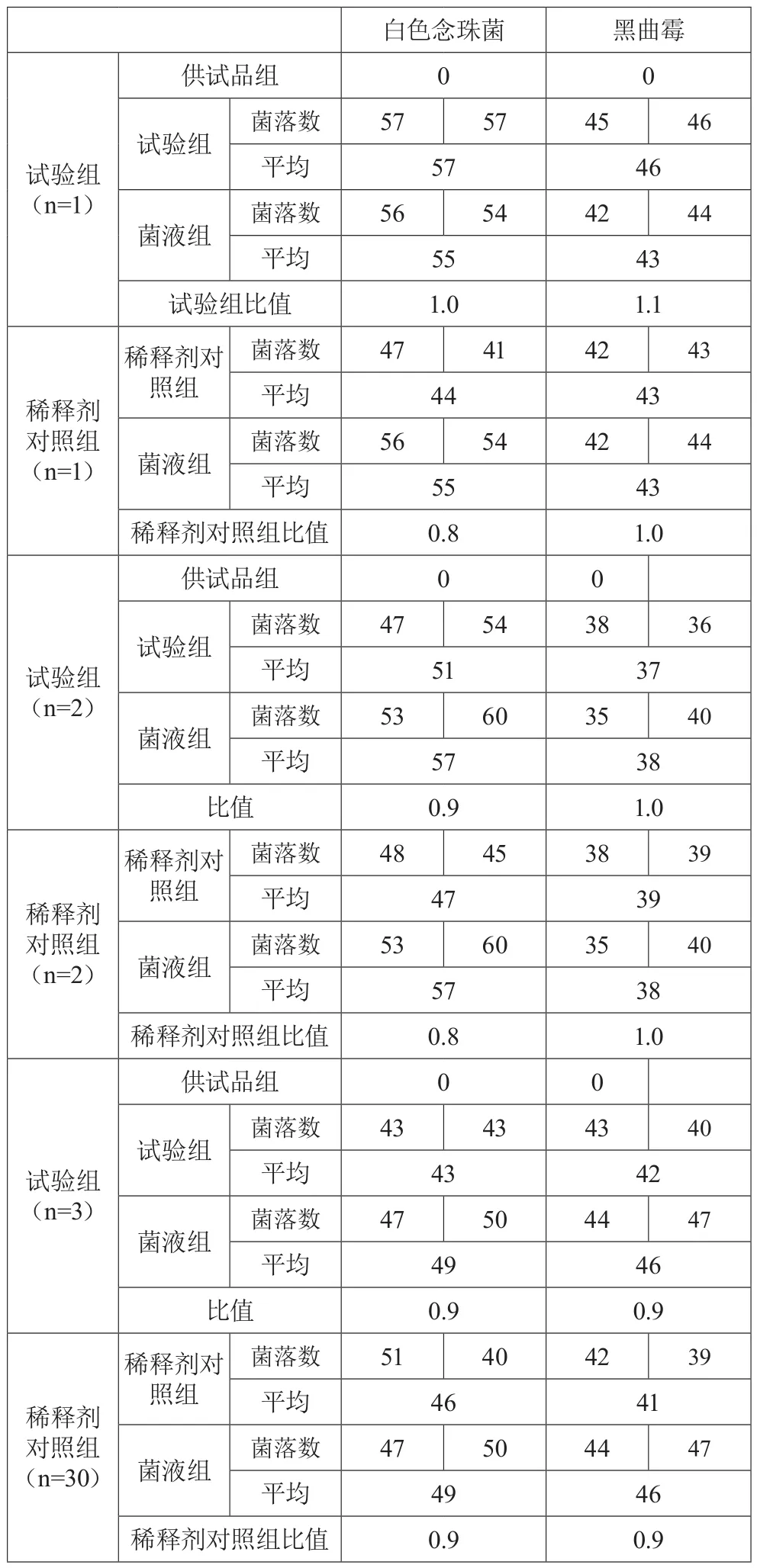
表2 霉菌和酵母菌总数计数方法适用性试验结果
2.4 控制菌检查方法验证
大肠埃希菌检查采用常规法,按照《中国药典》2015年版四部[1]大肠埃希菌检查方法检查。结果表明,供试品的大肠埃希菌检查可采用常规法检验。见表3。

表3 控制菌检查方法验证结果
3 讨论
2015年版中国药典的施行,微生物限度检查方法在操作和培养基都有了非常大的改变,针对具体品种的特点,需要通过培养基适用性试验来确定检验方法的可行性。
本文分别采用常规法、薄膜过滤法、培养基稀释法进行试验,结果表明薄膜过滤法回收率和培养基稀释法回收率都不符合规定要求;并且样品黏稠,具有吸附性,薄膜过滤法试验操作难度大。常规法分别考察了①稀释液加20 mL十四烷酸异丙酯,萃取取下层;②稀释液加2%卵磷脂醇液;③TSA琼脂加1%卵磷脂醇液。这三种方法均不符合回收率要求。最终确定取本品10 g,加含0.1%卵磷脂和0.7%聚山梨酯80的pH7.0无菌氯化钠-蛋白胨缓冲液至100 mL,制成1︰10的供试液,按平皿法,倾注含0.1%卵磷脂和0.7%聚山梨酯80的胰酪大豆胨琼脂,依法检查(《中国药典》2015年版四部通则<1105>与<1106>)。
该品种在现行版USP、BP、EP中有收载,但无微生物限度检查项,在CHP及JP中均未收载;USP、EP、CHP中药用辅料限度为:需氧菌总数不得过103CFU/g,霉菌和酵母菌总数不得过102CFU/g,结合进口药品标准和企业标准,最终确定限度为每1 g供试品中需氧菌总数不得过100 cfu,霉菌和酵母菌总数不得过20 cfu,每1 g不得检出大肠埃希菌[2-4]。该方法操作简便,试验菌回收率均在0.5~2.0范围内,控制菌均能检出,方法可行。

