高温高压碳酸盐岩的酸岩反应实验研究
罗 雄 焦国盈 孟 伟 解修权
(重庆科技学院, 重庆 401331)
酸化压裂是针对碳酸盐岩储层而广泛采用的一项增产增注措施。为预测酸化压裂施工中酸液的有效作用距离,提高酸化压裂效果,在酸压设计方案中需要明确反应速度常数、反应级数等酸岩反应参数[1-2]。位于四川省阆中市天宫乡境内的川深1井是一口预探井,该井龙王庙、仙女洞及Z2dy4(震旦系灯影组四段)等层段的岩心分析结果表明,储层岩石的主要成分为碳酸盐岩。本次研究,将通过室内实验,探讨川深1井储层的酸岩反应参数(反应速度常数、反应级数),为优化酸化压裂施工提供基础数据。
1 实验方案
1.1 实验材料和参数设定
利用SY-3型酸岩反应旋转岩盘仪进行酸岩反应动力学实验。实验材料主要包括氯化铵、氢氧化钠、酚酞、盐酸、碳酸钙。
实验所用岩心,为川深1井龙王庙、仙女洞及Z2dy4层段的碳酸盐岩,属于高温高压储层的碳酸盐岩。取心层段井深分别为7 510~7 605 m、7 666~7 673 m和8 154~8 160 m。
实验所用胶凝酸体系:20%HCl+0.5%缓蚀剂+0.8%胶凝剂+1.0%铁离子稳定剂+1.0%助排剂。
实验中,反应釜压力设置为7 MPa,实验温度为80 ℃。对每个层段的岩样,进行2种圆盘转速(500 rmin和800 rmin)的实验。酸岩反应中,每隔2 min取一次酸液样品,取样4次。
1.2 实验原理
根据酸碱滴定原理,检测岩石反应前后酸液中氢离子的变化,计算酸液中氢离子浓度的变化值。
ΔCHCl=VNaOH*CNaOHVHCl
(1)
式中:ΔCHCl—— 氢离子浓度变化量,molL;
VNaOH—— 氢氧化钠体积,L;
CNaOH—— 氢氧化钠浓度值,molL;
VHCl—— 盐酸体积,L。
考虑岩样面容比后,酸岩反应系统的反应动力学方程[3]为:
J=KCm
(2)
(3)
式中:J—— 反应速度,即单位时间内流到单位岩石面积上的物流量,mol(cm2·s);
K—— 反应速度常数,(molL)-m·(molcm2·s);
C——t时刻酸液的酸浓度,molL;
m—— 反应级数,无因次;
V—— 参加反应的酸液体积,L;
S—— 岩盘反应表面积,cm2。
对式(2)两边取对数,得lgJ=lgK+mlgC;采用最小二乘法,对lgJ和lgC的关系进行线性回归处理,求得m和K值,从而确定酸岩反应动力学方程。
1.3 实验步骤
按下列步骤进行实验:
(1) 在切片机上,将待测岩样制成圆盘,圆盘规格为Φ2.5 cm×(2.0~2.5)cm。
(2) 将待测岩盘表面打磨平整、光洁,烘干,然后取出冷却。
(3) 将岩盘非测试部分用AB胶涂抹,保留一个端面与酸液反应;然后将其固定在岩心托上,置放于室温下备用。
(4) 用稀酸液清洗储酸罐、反应釜及管线阀门,然后再用清水清洗一遍。排去污水后,用高压氮气冲刷干净,关闭取样、放酸、排酸阀门。
(5) 从配好的酸取样,将酸液(约1 L)注入储酸罐。将固定好的岩盘置于反应釜内转轴上,旋紧。向储酸罐及反应釜系统充入高压氮气,使其达到预定压力。
(6) 对储酸罐及反应釜系统进行加热,使其达到预定温度,恒温30 min。
(7) 设定试验转速及反应时间。启动电机,使其按预定转速恒速旋转。
(8) 在温度、压力、转速恒定后,开启放酸阀。在酸液与岩盘反应面接触时,开始记录反应时间。
(9) 按设定的反应时间取样。
(10) 停止实验,排出余酸,清洗储酸罐、反应釜及管线阀门。
(11) 打磨岩盘反应断面,直到露出新鲜断面。
(12) 滴定酸样,计算酸浓度。
(13) 计算酸岩反应速度。
(14) 采用不同浓度的酸液,重复第5至第13步,直到取得4个数据点。
(15) 绘制酸岩反应速度和酸浓度的双对数图,计算酸岩反应参数。
2 实验结果与分析
2.1 酸岩反应速率
龙王庙岩样的实验测试数据见表1,其反应速度与酸浓度的关系曲线见图1。从图1可以看出,随着酸浓度的增加,反应速度呈上升趋势。这是由于与酸岩反应的酸液中氢离子浓度增加了。转速为500 rmin时的反应速度,总体大于转速在800 rmin时的反应速度,表明酸岩反应速度并不会因酸液注入速度的加快而增大。对曲线进行拟合处理,求得:圆盘转速为500 rmin时,K=2×10-4,m=0.999 1,即反应动力学方程为J=2×10-4C0.999 1;圆盘转速为800 rmin时,K=2×10-4,m=0.999 3,即反应动力学方程为J=1×10-4C0.999 3。
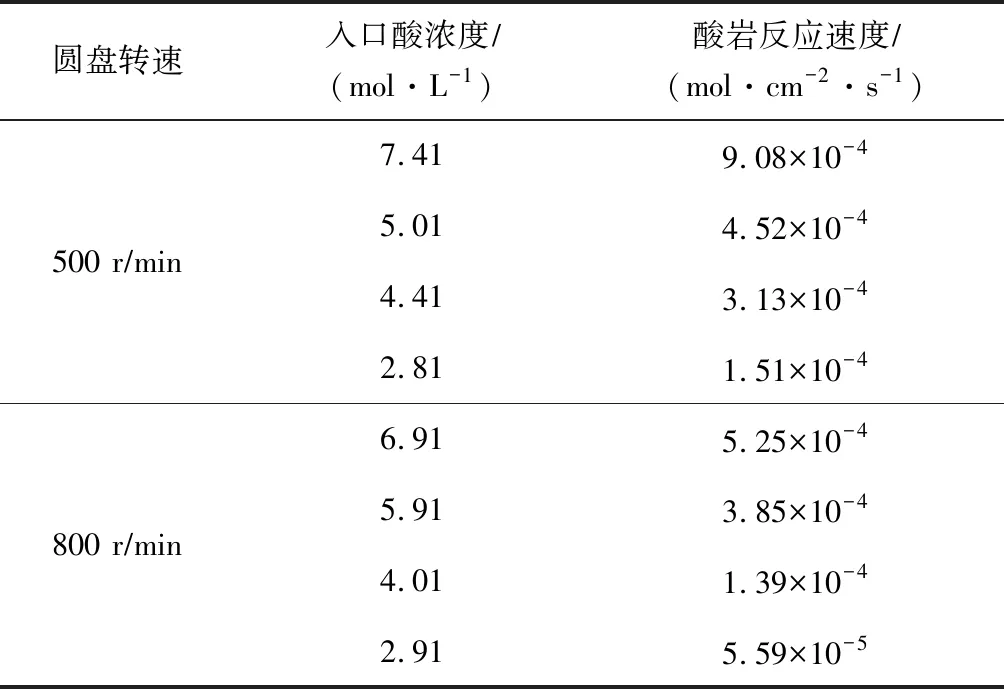
表1 龙王庙岩样的实验测试数据
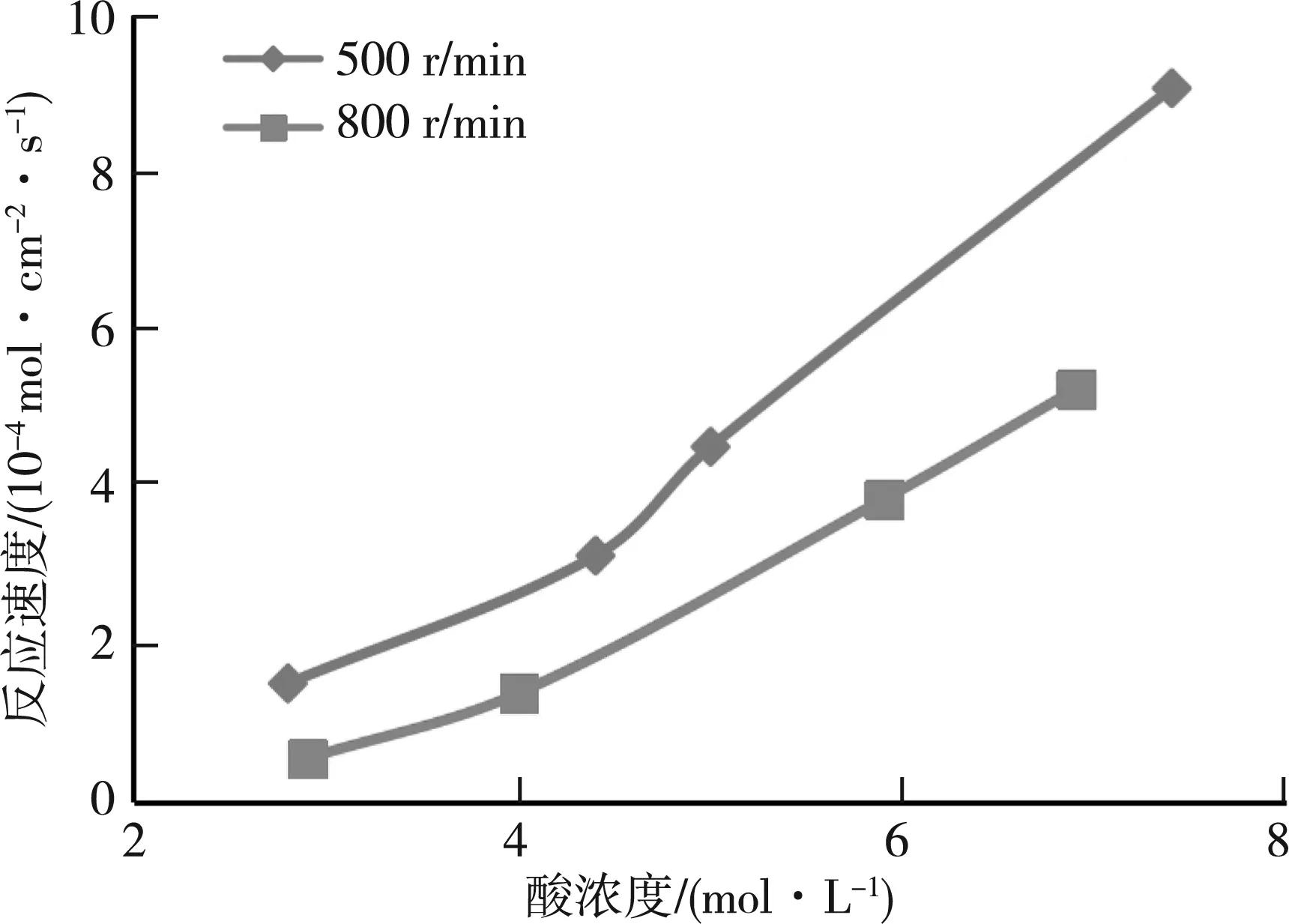
图1 龙王庙岩样的反应速度与酸浓度的关系
仙女洞岩样的实验测试数据见表2,其反应速度与酸浓度的关系曲线见图2。从图2可知,转速为500 rmin时,酸浓度在4 molL以内,反应速度变化较小;酸浓度达到4 molL以后,反应速度则快速上升。转速为800 rmin时,随着酸液浓度的增加,酸岩反应速度的变化不太明显。对曲线进行拟合处理,求得:圆盘转速为500 rmin时,K=2×10-4,m=0.998 3,反应动力学方程为J=2×10-4C0.998 3;圆盘转速为800 rmin时,K=8×10-5,m=0.999 7,反应动力学方程为J=8×10-5C0.999 7。
Z2dy4岩样的实验测试数据见表3,其反应速度与酸浓度的关系曲线见图3。转速为500 rmin时,曲线较平缓,酸液浓度增加后,酸岩反应速度缓慢上升,变化趋势不太明显。转速为800 rmin时,酸液浓度小于3 molL,反应速度较小;酸液浓度大于3 molL之后,反应速度则快速上升。对曲线进行拟合处理,求得:转速在500 rmin时,K=9×10-5,m=0.999 7,反应动力学方程为J=9×10-5C0.999 7;圆盘转速为800 rmin时,K=4×10-4,m=0.997 2,反应动力学方程为J=4×10-4C0.997 2。
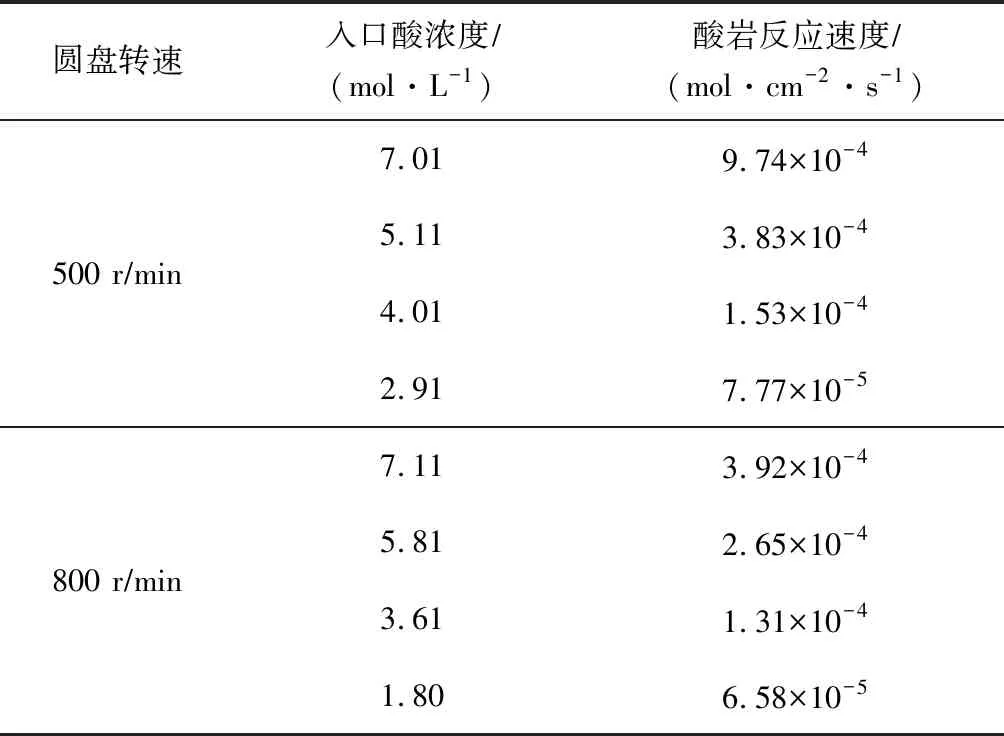
表2 仙女洞岩样的实验测试数据

图2 仙女洞岩样的反应速度与酸浓度的关系

圆盘转速入口酸浓度∕(mol·L-1)酸岩反应速度∕(mol·cm-2·s-1)500 r∕min7.015.89×10-45.913.81×10-43.712.07×10-41.515.56×10-5800 r∕min6.811.47×10-35.014.36×10-43.405.74×10-52.481.13×10-5
采用酸碱中和滴定法,测试每次残酸取样中的氢离子浓度的变化(浓度差),实验结果见表4。随着反应时间的延长,氢离子浓度整体上呈下降趋势。在8 min时,酸岩反应基本完成,此时的酸液浓度差趋于一致。总体上看,转速为500 rmin时的浓度差较大。说明转速较低时,反应比较充分;转速过大,反应不彻底,就达不到酸蚀的效果。在此实验条件下,转速设定为500 rmin,是比较合适的。

图3 Z2dy4岩样的反应速度与酸浓度的关系
表4 不同情况下的溶液浓度差 molL
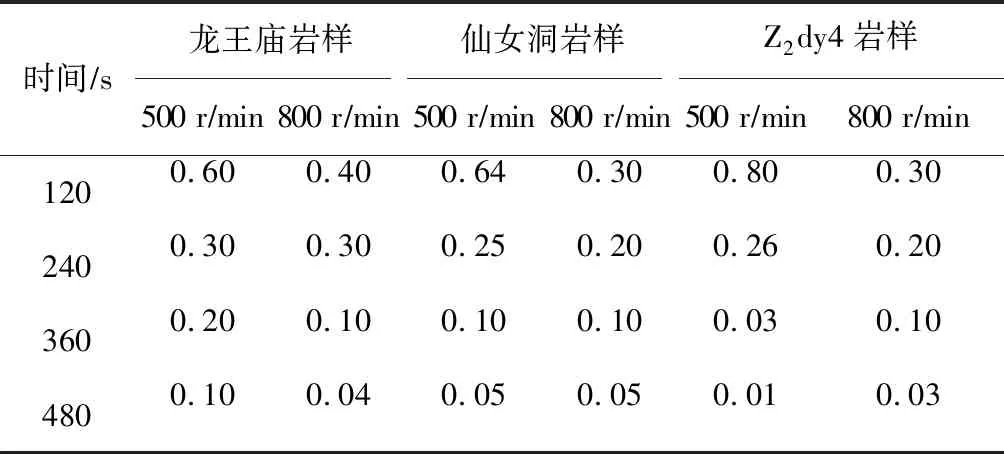
表4 不同情况下的溶液浓度差 molL
时间∕s龙王庙岩样仙女洞岩样Z2dy4岩样500 r∕min800 r∕min500 r∕min800 r∕min500 r∕min800 r∕min1200.600.400.640.300.800.302400.300.300.250.200.260.203600.200.100.100.100.030.104800.100.040.050.050.010.03
2.3 反应速度变化
酸液反应在低转速时为逆流,在高转速时为离心流。实验结果表明,在低转速时反应速度的变化更大(见图4)。

图4 酸岩反应时间与反应速度的关系
在酸岩反应过程中,随着时间的延长,大量反应产物进入溶液,溶液的密度、黏度及离子浓度不断增加,使得扩散阻力增大,传质速率降低,酸岩反应的速度也就逐渐降低。后来,酸液中的有效氢离子完全反应,反应速度即趋于平缓。
3 结 论
采用旋转罗盘装置对川深1井碳酸盐岩储层岩样进行酸蚀实验,运用酸碱中和滴定法测定反应前后残酸浓度变化值,并使用最小二乘法对lgJ和lgC进行线性回归处理,求得反应速度常数和反应级数,从而确定了川深1井龙王庙、仙女洞和Z2dy4层岩样的酸岩反应动力学方程。

