基于雌激素受体调节Nrf2-ARE通路的黄芩中抗氧化成分的筛选
刘媛媛,刘 陶,吴玉梅,张 晗,赵 鑫,刘志东,李 楠
(天津中医药大学1. 现代中药发现与制剂技术教育部工程中心、2. 天津市现代中药重点实验室-省部共建国家重点实验室培育基地,天津 301617)
随着环境的日益恶化以及大气层的不断破坏,辐射地球的紫外线(ultraviolet rays,UV)强度越来越大。皮肤长期暴露于紫外线下导致皮肤老化,大量实验研究表明,氧化应激是UV造成皮肤损伤的重要原因。当皮肤受到UV辐射时,皮肤内形成大量活性氧(reactive oxygen species,ROS)。正常情况下,体内ROS的产生和清除处于动态平衡,UV反复照射破坏了氧化和抗氧化防御系统平衡[1]。高水平的ROS等氧化物可引起表皮角质层和真皮层内细胞脂质、核酸、蛋白质等大分子损伤,影响相关信号通路传导。
转录因子NF-E2相关因子2(NF-E2-related factor 2,Nrf2)是调控细胞对抗外源性有害物质和氧化损伤的关键转录因子。Nrf2通过与抗氧化反应元件(antioxidant response element,ARE)相互作用,诱导抗氧化蛋白表达。Nrf2-ARE是机体抵抗内外界氧化损伤的防御性转导通路[2-3]。正常生理情况下,细胞质中的Nrf2与Keap1结合,并处于活性相对抑制状态。在应激状态下,Nrf2与Keap1解离转位至细胞核,启动下游超氧化物歧化酶(superoxide dismutase,SOD)等基因和蛋白表达,从而维持机体氧化还原平衡。Nrf2-ARE通过抑制ROS,从而阻止光老化的形成。
黄芩(ScutellariabaicalensisGeorgi)是唇形科黄芩属多年生草本植物,具有清热燥湿、泻火解毒、止血等功效。黄芩的活性成分主要是黄酮类,包括汉黄芩素、黄芩素、黄芩苷等。汉黄芩素、黄芩素、黄芩苷均具有抗氧化、抗衰老的作用[4]。植物雌激素通过调节雌激素受体,促进细胞中核转录因子Nrf2入核[5-9],从而发挥抗氧化抗衰老作用[2,10-12]。汉黄芩素、黄芩素、黄芩苷均为黄芩中植物雌激素类成分[12-13],它们是否能通过雌激素受体调节Nrf2-ARE信号通路,发挥抗氧化作用还有待明确。本研究通过建立基于Nrf2-ARE通路的报告基因筛选模型,筛选黄芩中基于雌激素受体发挥抗氧化作用的活性成分,并利用UVB造模后的HaCaT细胞进行验证。
1 材料
1.1 仪器FORMA3111 CO2恒温培养箱(美国Thermo公司);低温高速离心机(美国Beckman);HZQ-C空气浴振荡器(哈尔滨市东明医疗仪器厂);超净台(苏州佳宝净化工程有限公司);SH2B型紫外光疗仪(美国Sigma);DMIL倒置相差显微镜(德国LEICA);Infinite M200型多功能酶标仪(瑞士Tecan);VICTORTMX5多功能读板仪(Perkin Elmer);Flex Station3多功能酶标仪(美国Molecula Device)。
1.2 药物与试剂叔丁基对苯二酚(tertiary butylhydroquinone,tBHQ,Sigma);ICI 182780(Biotechne,批号:129453618);全反式维甲酸ATRA(Solarbio,批号:1228A023);ROS试剂盒、SOD测试盒(WST-8法),均购自碧云天;SOD测试盒(WST-1法),购自南京建成生物工程研究所;汉黄芩素(wogonin,批号:C19A8Q34235)、黄芩素(baicalein,批号:C20M8Y31962)、黄芩苷(baicalin,批号:P16S8F44143),购自上海源叶生物科技有限公司。DMEM培养基(Gibco);胎牛血清(Biological Industries);DMSO(Sigma);CCK-8试剂盒(日本Dojindo Lab);感受态细胞DH5α、质粒小提试剂盒(天根);萤火虫荧光素酶报告基因载体pGL4.37、海肾荧光素酶报告基因载体pRL-TK(Promega);氨苄西林、LB液体培养基(干粉)、LB固体培养基(干粉),购自Solarbio。
1.3 细胞株人肾上皮细胞系293T、人类永生化表皮细胞株HaCaT,来源为ATCC细胞库。
2 方法
2.1 质粒载体的转化与验证利用感受态细胞DH5α转化质粒pGL4.37,并加入到适量菌汤中,用无菌的涂布器取适量菌汤涂布于选择培养基上,倒置培养,37 ℃过夜。挑取单个菌粒,加入到含有适量肉汤的锥形瓶中,37 ℃、160 r·min-1过夜摇菌。从过夜摇菌的菌液中取1 mL于离心管中,做好标记。通过设计上游引物①:5′-GTGAATCGATAGTACTAACA-3′;上游引物②:5′-TCAACGAGTACGACTTCGTG-3′;下游引物①:5′-CCAAACTCATCAATGTATCT-3′三段引物,将质粒送华大基因公司测序,以进一步鉴定阳性克隆[5]。
2.2 质粒的提取及测定取“2.1”中阳性克隆的菌液,采用质粒小提试剂盒提取质粒。取1 μL质粒溶液,以DEPC水作空白对照。在紫外分光光度计上分别读取260 nm、280 nm波长下的吸光度值。
2.3 细胞培养复苏293T细胞,以10%胎牛血清的DMEM完全培养基,于37 ℃、5% CO2的培养箱中培养。

2.5 293T细胞瞬时共转染及ARE转录活性的测定取对数生长期的293T细胞,以3×104个/孔的密度接种于96孔细胞培养板中,待细胞生长密度达到70%~80%时,使用PEI(1 g·L-1)转染试剂同时转染ARE荧光素酶报告质粒pGL4.37(每孔41 ng)和海肾荧光素酶报告质粒pRL-TK(每孔2.4 ng),培养24 h。培养结束后,各孔分别加入Nrf2激活剂tBHQ(10 μmol·L-1),不同浓度的黄芩苷、汉黄芩素、黄芩素和细胞基础培养基,培养6 h。弃上清液,D-Hank′s漂洗细胞,裂解后,用Dual-Luciferase检测系统检测。每组实验设6个复孔,重复3次。通过萤火虫荧光素酶活性与海肾荧光素酶活性对比,得到相对荧光素酶活性值。诱导表达倍数=(药物诱导的Luciferase/药物诱导的Renilla)/(基培对照组的Luciferase/基培对照组的Renilla)。
2.6 黄芩主要活性成分通过雌激素受体影响Nrf2-ARE通路发挥抗氧化作用预先给予浓度为1 μmol·L-1的雌激素受体抑制剂ICI 182780稀释液50 μL处理细胞1 h,再分别加入200 μmol·L-1的黄芩苷溶液50 μL,使黄芩苷最终浓度为100 μmol·L-1,继续培养6 h后,检测荧光,方法同“2.5”。
2.7 验证黄芩中主要活性成分的抗氧化作用
2.7.1细胞模型的建立 复苏HaCaT细胞,以10%胎牛血清的MEM完全培养基,于37 ℃、5% CO2的培养箱中培养,待细胞长到80%左右进行种板。抑制剂组预先给予浓度为1 μmol·L-1的雌激素受体抑制剂ICI 182780稀释液和1 μmol·L-1Nrf2-ARE通路抑制剂ATRA[14]稀释液各50 μL处理HaCaT细胞1 h,再分别加入200 μmol·L-1的黄芩苷溶液50 μL,使黄芩苷最终浓度为100 μmol·L-1,给药组直接给予100 μmol·L-1的黄芩苷溶液100 μL,加入继续培养24 h后,造模。将预给药后的HaCaT细胞分别给予不同剂量的UV照射,设置空白对照组,24 h后分别收集细胞,检测细胞活性。光源采用美国Sigma公司的SH2B型紫外光疗仪,模拟UVB辐射皮肤损伤模型,光谱为280~320 nm,强度为60 mJ·cm-2。
2.7.2UVB照射后HaCaT细胞ROS、SOD活性的检测 使用ROS试剂盒考察空白组、模型组、给药组、抑制剂组的HaCaT细胞ROS活性。用无血清MEM培养基清洗细胞,每孔加入100 μL稀释好的DCFH-DA工作液,37 ℃、5% CO2细胞培养箱孵育30 min。用无血清MEM培养基洗涤细胞3次,每孔加入100 μL MEM培养基。在酶标仪中使用激发波长488 nm,发射波长525 nm检测荧光值。
使用SOD试剂盒考察空白组、模型组、给药组、抑制剂组的HaCaT细胞SOD活性。ICI 182780组采用WST-8检测法,ATRA组采用WST-1检测法。按说明书操作计算。
3 结果
3.1 质粒载体转化的验证及质量的测定通过基因测序得2 098 bp,将该序列与已知质粒进行比对,同源性99%,其中测序序列结果中包含ARE序列,证明转化成功。质粒浓度为158.00 mg·L-1,纯度为1.97。
3.2 黄芩主要活性成分对293T细胞活力的影响如Fig 1所示,黄芩苷(1、10、100 μmol·L-1)组293T细胞活力与正常对照组相比差异无显著性,汉黄芩素和黄芩素1 μmol·L-1组293T细胞活力与正常对照组相比差异无显著性。1、10、100 μmol·L-1为黄芩苷对293T细胞的安全浓度,1 μmol·L-1为汉黄芩素和黄芩素的安全浓度。采用黄芩苷、汉黄芩素和黄芩素的安全浓度进行抗氧化活性的筛选。
3.3 黄芩抗氧化活性成分的筛选分别将黄芩苷(1、10、100 μmol·L-1),汉黄芩素(0.2、0.5、1 μmol·L-1)和黄芩素(0.2、0.5、1 μmol·L-1)加入转染了质粒DNA的293T细胞中,检测报告基因的活性。Fig 2结果显示,100 μmol·L-1黄芩苷可明显激活293T细胞中的Nrf2-ARE通路,诱导表达倍数为空白组的(1.56±0.01)倍(P<0.01);黄芩苷(1、10 μmol·L-1)诱导表达倍数与空白组比较差异均无显著性。如Fig 3所示,汉黄芩素和黄芩素0.2、0.5、1 μmol·L-13个浓度的诱导表达倍数均小于1,无抗氧化活性。
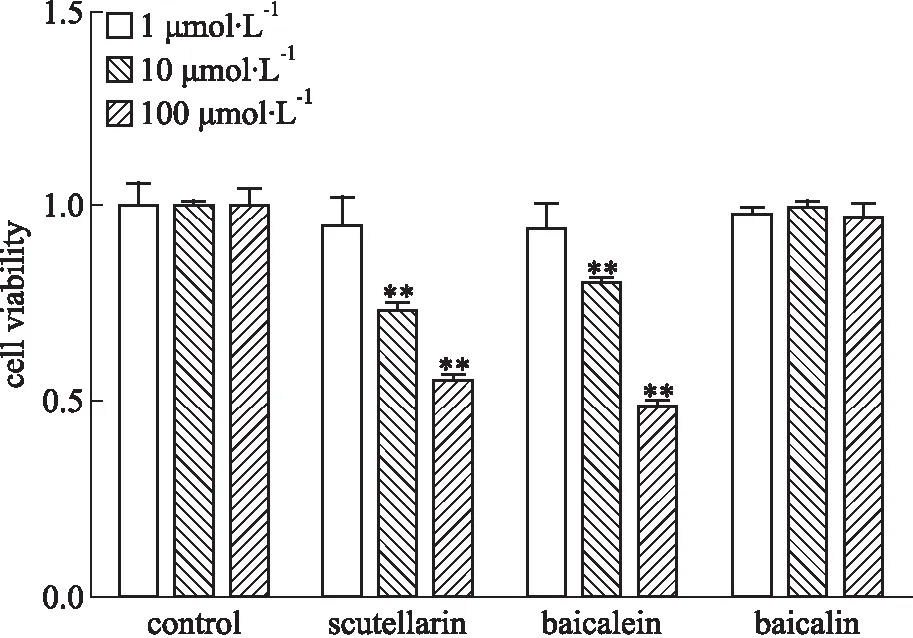
Fig 1 Effect of scutellarin, baicalein, baicalin on cell viability of 293T n=6)
**P<0.01vscontrol

Fig 2 Effect of baicalin on luciferase induction
**P<0.01vscontrol
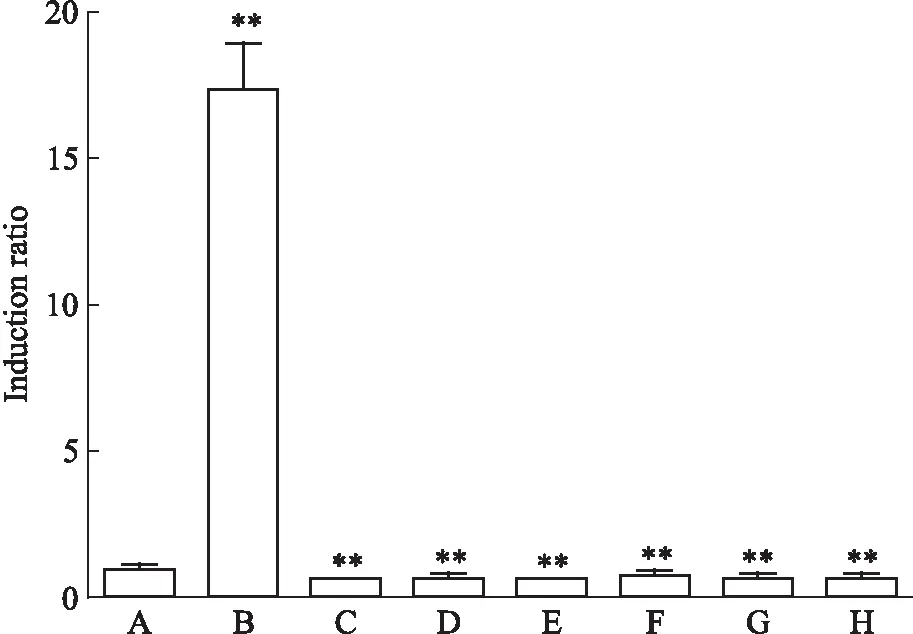
Fig 3 Effect of scutellarin, baicalein on luciferase induction in 293T
A:Control;B:tBHQ;C:0.2 μmol·L-1of scutellarin;D: 0.5 μmol·L-1of scutellarin;E: 1 μmol·L-1of scutellarin;F: 0.2 μmol·L-1of baicalein;G: 0.5 μmol·L-1of baicalein;H: 1 μmol·L-1of baicalein.**P<0.01vscontrol
3.4 黄芩主要活性成分通过雌激素受体影响Nrf2-ARE通路如Fig 4所示,预给予雌激素受体特异性抑制剂ICI 182780后,诱导表达倍数下降至(1.02±0.23)倍,抗氧化作用基本消失。
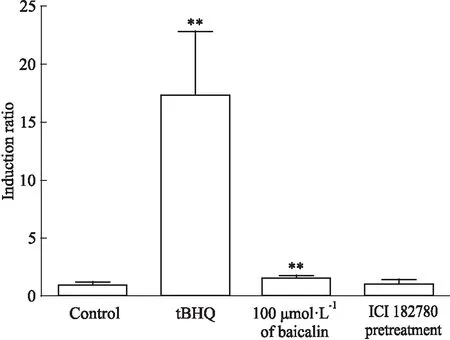
Fig 4 Effect of ICI 182780 on luciferase-upregulation
**P<0.01vscontrol
3.5 验证黄芩主要活性成分通过雌激素受体影响Nrf2-ARE通路Tab 1结果显示,与模型组比较,黄芩苷(100 μmol·L-1)对HaCaT细胞有明显的抗氧化作用。预给予雌激素受体特异性抑制剂ICI 182780后,ROS值升高,SOD值下降,抗氧化作用消失。表明黄芩苷可能通过雌激素受体发挥抗氧化作用。
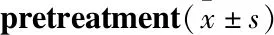
Tab 1 Regulation of baicalin on ROS and SOD levels in UVB-irradiated HaCaT cells after ICI 182780
**P<0.01vsmodel
3.6 验证黄芩主要活性成分通过Nrf2-ARE通路发挥抗氧化作用Tab 2结果显示,与模型组比较,黄芩苷(100 μmol·L-1)对HaCaT细胞有明显的抗氧化作用。预给予Nrf2-ARE通路特异性抑制剂ATRA后,ROS值升高,SOD值下降,抗氧化作用消失。表明黄芩苷可能通过Nrf2-ARE通路发挥抗氧化作用。
4 讨论
本研究采用基因载体pGL4.37-ARE与内对照报告基因载体pRL-TK共转染293T细胞,建立双荧光素酶报告基因系统,检测293T细胞中相关蛋白表达,并将其诱导表达倍数归一化,以消除实验中不同测试之间所固有的变化,从而筛选出可明显激活293T细胞中的Nrf2-ARE通路的活性成分黄芩苷,并为后续单体抗氧化成分的开发提供实验依据。
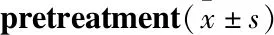
Tab 2 Regulation of baicalin on ROS and SOD levels in UVB-irradiated HaCaT cells after ATRA
*P<0.05,**P<0.01vsmodel
文献报道,黄芩苷可以下调Keap1表达、上调Nrf2蛋白水平,过量的Nrf2由胞质向核内转移,与ARE调控序列结合,启动下游SOD等基因和蛋白表达,从而清除氧自由基[10],实现抗氧化作用[6]。研究表明,黄芩苷(100 μmol·L-1)可缓解UVB照射所致HaCaT细胞内ROS的过量表达,提高SOD活性,从而达到对UVB照射导致的氧化应激的保护作用。预加入雌激素受体抑制剂和Nrf2-ARE通路抑制剂抗氧化作用消失,从而推断黄芩苷可能是通过雌激素受体调节Nrf2-ARE通路发挥抗氧化作用。
黄芩素与黄芩苷化学结构相似,但在本研究构建的筛选模型中,在考察浓度范围内黄芩素未表现出抗氧化作用。刘靖丽等[15]从密度泛函理论角度探讨了黄芩素和黄芩苷抗氧化活性与结构关系,认为C6位的酚羟基是黄芩苷黄芩素的最大反应活性位点。在非极性溶剂中,抗氧化活性取决于脱氢能力,脱氢能力越强,抗氧化能力越强,黄芩苷的脱氢能力强于黄芩素,所以黄芩苷的抗氧化活性大于黄芩素;在极性溶剂中,抗氧化活性取决于电离势,电离势越低,抗氧化活性越强,黄芩苷的电离势低于黄芩素,所以黄芩苷的抗氧化活性强于黄芩素。与本研究结果一致。
本研究成功建立了双荧光素酶报告基因系统,用于体外筛选具有抗氧化活性成分,并用UVB造模后的HaCaT细胞进行了验证。结果发现,黄芩中主要活性成分黄芩苷通过雌激素受体影响Nrf2-ARE通路,发挥抗氧化作用。
——一道江苏高考题的奥秘解读和拓展