α1-肾上腺素受体结构改变影响其生物学活性及生理功能的研究进展
马 力,杨泽平,母 茜,邵钰婷,杨 洋,安 输,郭晓汐,郝 倩,徐天瑞,刘 莹
(昆明理工大学生命科学与技术学院细胞信号传导实验室,云南 昆明 650500)
1994年8月,国际药理联合会受体命名与药物分会根据肾上腺素受体(adrenergic receptor,AR)与其配体结合特性及功能等差异,将AR分为α亚型(包括α1和α2)、β亚型(包括β1、β2、β3)两大类。α1-ARs在许多生理过程中发挥重要作用,包括平滑肌收缩、心肌变时变力、肝糖原代谢等等。大量药理学研究表明,结构同源但具不同特性的α1-ARs亚型,调控上述生理过程。不同组织细胞上的α1-ARs的药理学特性并不均一,存在多种亚型,按照国际药理联合会受体命名与药物分类委员会规定,将其分为α1A、α1B和α1D3种亚型。根据该受体与激动剂和拮抗剂亲和力的不同,以及对烷化剂氯乙烷、可乐定敏感度的差异,首先鉴定出α1A-AR和α1B-AR。此后,应用cDNA分子克隆技术,克隆出人类3种α1-ARs(A、B、D)亚型。
近年来,应用分子生物学技术、放射配体结合技术、拮抗剂功能分析等手段,对α1-ARs亚型的蛋白结构、分类、分布等各方面的研究均取得很大进展,但是,对α1-ARs结构改变影响其生理功能的研究较少。本文总结了α1-ARs受体羧基端截短、二聚化、别构效应和点突变这4个方面的结构改变,导致其内吞、磷酸化、脱敏以及对激动剂的亲和力等生理功能的改变,以期为α1-ARs受体的药理、生理及病理生理学功能研究提供理论基础。
1 α1-AR的结构及分布
1.1 α1-AR的结构α1-ARs属于G蛋白偶联受体(G protein-coupled receptors,GPCRs),为单一的多肽链,包含7个跨膜螺旋。α1-ARs的3种亚型的氨基末端均位于细胞外,但长度不尽相同,羧基端均位于细胞内,氨基酸序列的同源性较小,但该区域大约在第7个跨膜螺旋后的第16个氨基酸有1个保守的半胱氨酸残基,可能与翻译后的硫酯化过程有关。α1-ARs跨膜区域由3个细胞内和3个细胞外回环结构组成。3种受体亚型中,构成这些回环的氨基酸尽管有所不同,但长度基本相似。第1个和第2个细胞外回环结构均含有1个半胱氨酸残基。半胱氨酸残基在所有GPCRs中均是高度保守的,由于它涉及二硫键的形成,因此,对于蛋白质的折叠、磷酸化及在质膜中的表达均发挥关键作用。
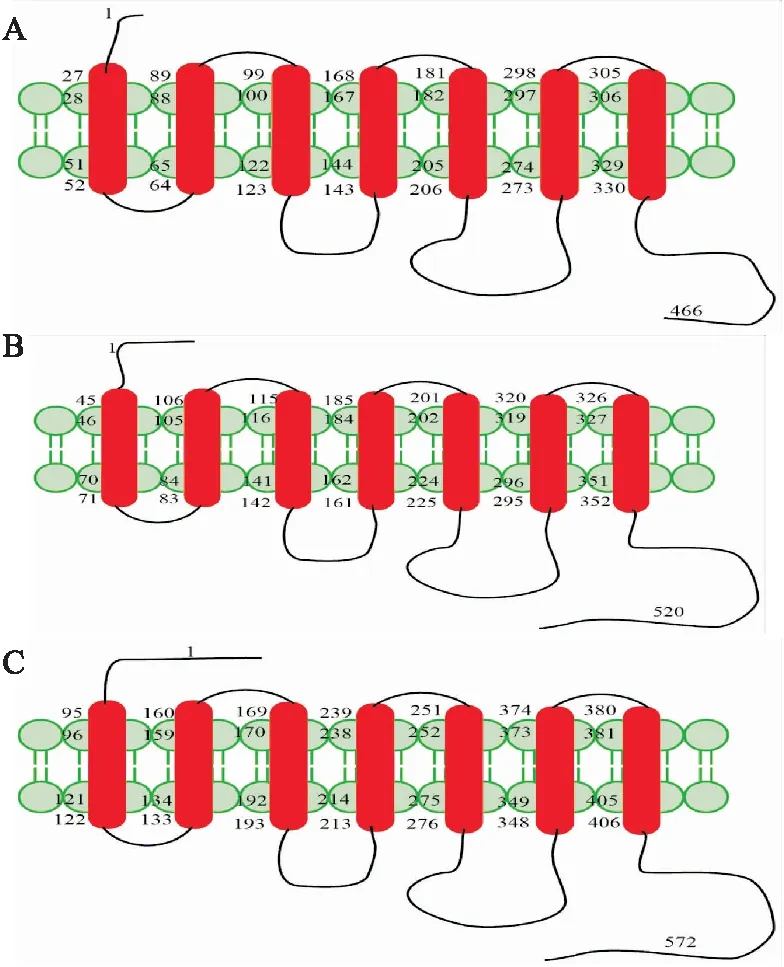
Fig 1 Structure diagram of α1-ARs
The α1-ARs consist of 7 transmembrane helices, 3 intracellular loops and 3 extracellular loops, as well as an extracellular amino terminus and an intracellular carboxy terminus. A: The amino terminus of α1A-AR consists of 27 amino acids and the carboxy terminus consists of 137 amino acids; B: The amino terminus of α1B-AR consists of 45 amino acids and the carboxy terminus consists of 169 amino acids; C: The amino terminus of α1D-AR consists of 95 amino acids and the carboxy terminus consists of 167 amino acids.
1.2 α1-AR的分布采用Western blot方法研究脑、心脏、肾脏、肝脏、输精管、前列腺、肾上腺等组织中,α1-ARs各亚型蛋白的表达情况,发现α1A受体亚型绝大部分分布在脑、心脏、血管、肝、输精管、肾上腺,少部分分布在肾脏、前列腺;α1B受体亚型在脑、心脏分布较高;而α1D受体亚型在脑分布较高。大脑皮层中的3种亚型受体随着年龄的增长而增加,其中α1B亚型在心脏中的分布随年龄的增加而增加,在肝脏中的分布随年龄的增加而减少。在肝脏、肾脏、心脏的α1D和α1A亚型不受年龄的影响。
研究表明,α1-AR在不同亚细胞结构上的表达存在差异。现已知α1A-AR主要表达在细胞内,但在成纤维细胞和血管平滑肌细胞表面也有一定程度的表达;α1B-AR主要表达在细胞膜表面;而α1D-AR主要表达在细胞内和细胞核周围。
2 α1-AR结构改变导致其生理功能的变化
2.1 羧基端结构改变在结构上,GPCRs是1条单一的多肽链,包含一段胞外氨基末端(N端)、7个由22-28个疏水性氨基酸组成的α螺旋形成的跨膜结构域,以及1个胞内的羧基末端(C端)[1]。连接疏水性氨基酸跨膜片段的亲水性氨基酸片段组成3个细胞外环与3个细胞内环。在GPCRs结构中,胞外N端或跨膜区形成配体结合域,位于胞内侧的C末端包含丝氨酸和苏氨酸的磷酸化位点,而连接跨膜区段的胞内环和C末端形成G蛋白结合域[2]。配基与受体结合后,将信号传递给与受体偶联的G蛋白,导致下游信号的产生,受体与配基结合后发生的构象变化决定了下游信号的特异性[3]。而C-端在G蛋白活化幅度方面起关键作用,同时C-端的近端也参与受体与G蛋白的偶联。C-端截短的α1B-AR突变体则表现出激动剂依赖的磷酸化和受体内陷作用的消失[4-5](Tab 1)。
先前已经证明,C-端是α1-ARs的重要调节域。它的完整性是α1-ARs脱敏和内吞作用所必需的[6]。因此,为了研究C-端对α1A-AR、α1B-AR脱敏和内吞的影响,Uberti等[7]通过用一种受体亚型的C末端替换另一种受体亚型的C末端,来设计α1A/α1B嵌合体,并且监测它们的内吞作用,证明α1B-AR的C端完整性是α1B-AR内吞作用所必需的(Tab 1)。
2.2 二聚化α1-ARs的3种亚型均可形成同源二聚体,但是异源二聚体只发生在α1B-AR与α1A/α1D-AR之间,α1A-AR与α1D-AR的二聚体并未发现,表明异二聚体的形成仅发生在亚型的特定组合之间。Uberti等[7]通过α1-ARs与标记有Flag-或HA-不同表位标签的受体免疫共沉淀,为HEK293细胞中所有3种亚型的同源二聚化提供了直接证据(Tab 2)。Uberti等[7]研究还表明,α1-AR的同源和异源二聚体复合物均在细胞膜表面表达,但是在这些复合物中难以确定哪些受体实际存在以及具体分布比例。
Gao等[8]发现,α1A/α1B-AR能与趋化因子(C-X-C基序)受体4[chemokine (C-X-C motif) receptor 4,CXCR4]形成异源二聚体,且该异二聚体复合物在人血管平滑肌细胞(human vascular smooth muscle cell,hVSMC)的细胞膜上组成型表达,二聚体的形成能增强α1-ARs对激动剂去氧肾上腺素(phenylephrine,PE)的敏感性,这表明二聚体可以为调节血管功能和血压的替代疗法提供作用靶点(Tab 2)。Albee等[9]发现,α1A/B/D-AR能与非典型趋化因子受体3(atypical chemokine receptor 3,ACKR3)形成异二聚体,该复合物在hVSMC的细胞膜表面上组成型表达,二聚体的形成能够负调节α1-ARs。靶向α1-ARs和ACKR3异源二聚体的药物研发,能够为血管类疾病的治疗提供新的靶点和方向(Tab 2)。
受体的二聚化对于受体活化及信号转导是必需的。α1B-AR与复杂的G蛋白、信号蛋白或支架蛋白相偶联,并能与AR形成同源二聚体或异二聚体[10-12]。受体的二聚化对细胞的特性和功能的影响如下:(1)二聚体的形成对受体的细胞表面表达和功能发挥是必需的。α1D-AR和α1B-AR形成异源二聚体是α1D-AR在细胞膜表面正常表达所必需的。α1B-AR可能通过掩盖α1D-AR的N端内质网滞留结构域,促进α1D-AR在细胞膜上的表达[7]。(2)二聚体对配体的亲和力表现出一定的偏向性,可增强或降低对配体的结合力。α1B-AR和α1D-AR二聚体能明显增加α1B-AR与肾上腺素配体的结合能力[4]。表明GPCRs二聚化与配体结合有正协同作用。
2.3 别构效应别构效应又称为变构效应,是寡聚蛋白与配基结合改变蛋白质的构象,进而导致蛋白质生物活性改变的现象。由于某些不直接影响蛋白质活性的物质,结合于蛋白质活性部位以外的其他部位(即别构部位),引起蛋白质分子的构象变化,进而导致蛋白质活性改变的现象。变构调节剂具有克服别构效应的潜力,但是对于α1-ARs家族的变构调节剂的研究很少,关于任何变构位点的结构信息甚至更少。Campbell等[13]的研究表明,变构相互作用与结合位点相关。即最佳大小的二价配体将促进变构位点的结合,从而增强配体的变构效应,否则无效力或效力差。

Tab 1 Changes in function induced by C-terminus of α1-AR
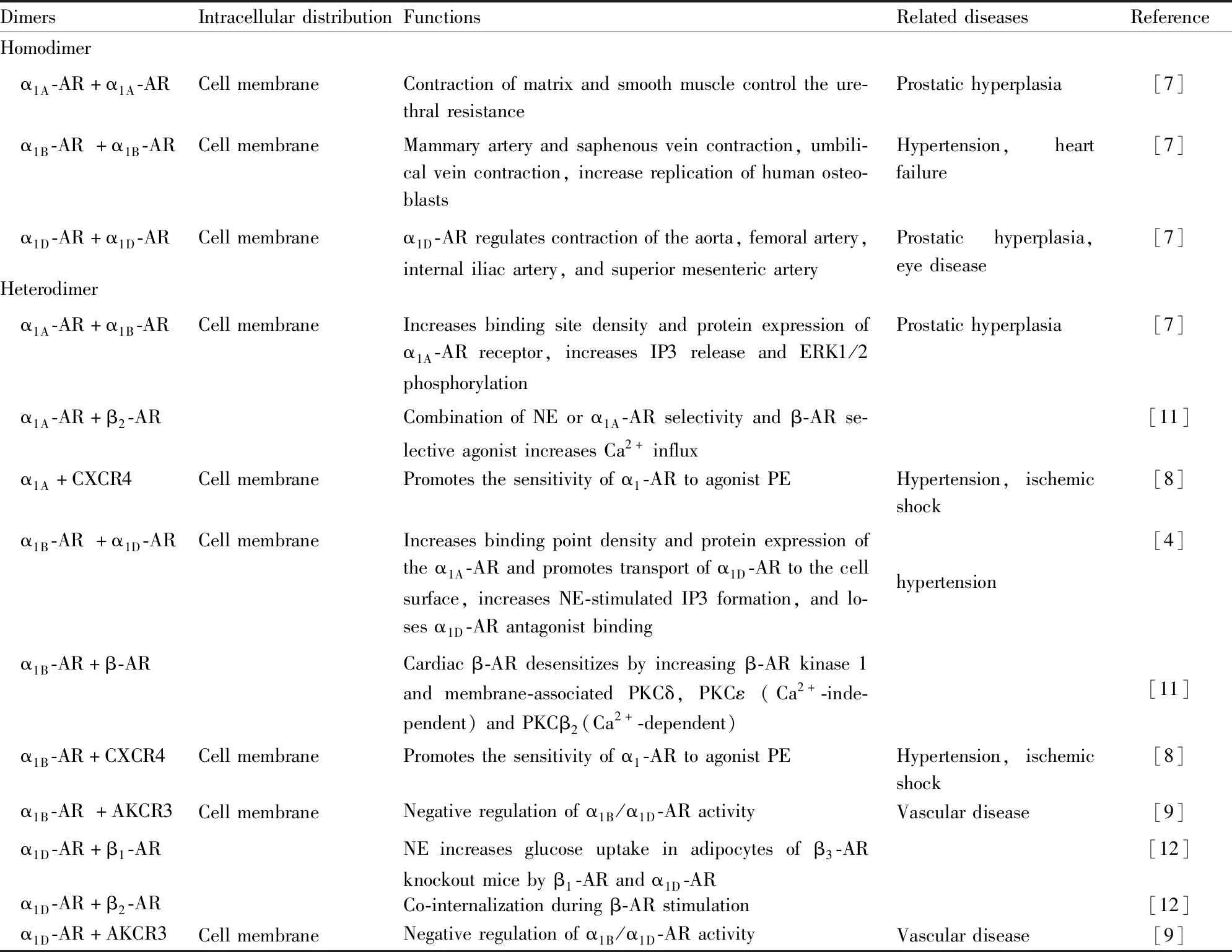
Tab 2 Effect of dimerization on physiological function of α1-AR
Ciolek等[14]基于细胞的功能实验证明,Zn2+和Cu2+可以通过降低激动剂功效,拮抗AR活化,此时AR活化曲线几乎无变化。该研究证明了金属离子与α1-ARs之间的相互作用,说明Zn2+和Cu2+可能具有调控前列腺功能的生物学作用。Zn2+和Cu2+的变构作用主要归因于哌唑嗪(α1-AR阻滞剂)动力学结合率的降低。尽管AR中的变构位点代表了新型亚型选择性药物的替代靶点,但它们的研究很少。继阿米洛利后,Zn2+和Cu2+是第2类分子,已发现它们作为哌唑嗪与α1-ARs结合的负变构调节剂而发挥作用。
2.4 点突变α1-ARs结构上关键位点的氨基酸对其生理功能至关重要,关键位点的氨基酸突变体在受体磷酸化、脱敏、受体异构化及受体与激动剂结合的亲和力等生理功能方面均会发生改变。
研究表明,Ser394和Ser400在佛波醇酯诱导蛋白激酶C(protein kinase C,PKC)活化后被磷酸化,而Ser404、Ser408和Ser410可以被α1B-AR激动剂肾上腺素激活。G蛋白偶联受体激酶2(G protein-coupled receptor kinase 2,GRK2)介导的Ser404、Ser408和Ser410的磷酸化可能引发α1B-AR的脱敏。以上结果表明,缺乏这3种丝氨酸的受体,α1-AR通过GRK2介导受体脱敏的能力受损[15]。在α1B-AR的第3个细胞内环的保守取代(A293E),导致受体组成型激活。无激动剂刺激的情况下,与表达野生型α1B-AR的细胞相比,表达突变受体的细胞表现出更高基础水平的肌醇磷酸。为了进一步评价A293E的作用,将A293分别突变成其他19种氨基酸[16]。结果表明,α1B-AR中A293的所有可能的氨基酸点突变体诱导了不同水平的受体组成型激活(Tab 3)。此外,α1B-AR的D142具有疏水、亲水双特性,可以通过该残基的质子化、去质子化来调节,是α1B-AR的无活性(R)和活性(R*)状态之间转变的重要调节剂(Tab 3)。此外,结合先前描述的α1B-AR突变体A293E对F310突变体进行研究,结果表明,F310与激动剂儿茶酚胺的相互作用,对于从基础状态R到完全活化状态R*的异构化是必不可少的[17](Tab 3)。
研究发现,R143的主要作用是介导受体激活,允许第2个细胞内环(2-loop)中的几个氨基酸,以及第3个细胞内环(3-loop)的N末端和C末端获得正确的构型,以形成具有对接互补性的位点。表明靶向R143的突变能够完全诱导α1B-AR失活[18]。单突变体A204V对儿茶酚胺肾上腺素和去甲肾上腺素(norepinephrine,NE)显示出增强的结合亲和力(3~10倍)。该突变体对羟甲唑啉以及其他咪唑啉激动剂的亲和力也增加10倍,这是该受体的两个其他组成型激活突变所不具备的作用。表明亲和力的增强是A204V突变,导致配体结合口袋的药理学特异性改变的结果。此外,Y203突变成丙氨酸导致受体活化减少,以及对激动剂结合的亲和力适度降低也已被证实[19](Tab 3)。

Tab 3 Changes in physiological functions induced by α1-AR mutations
3 总结和展望
本文主要总结了α1-ARs结构改变导致其生理功能的变化,以及该受体在生理和病理过程中的调节作用。研究α1-ARs激活参与的生物学过程,有助于了解人类疾病,尤其是心脑血管疾病的发生与发展过程。了解心脑血管疾病的分子基础后,对后续心脑血管疾病的早期检测、诊断、预防以及新的治疗策略提供可能。相信在不久的将来,人们通过对α1受体活化的深入研究,可以更加明确其在心脑血管疾病发生、发展中的作用机制,为指导心脑血管疾病基因治疗提供新靶点。虽然α1-ARs活化在人体生理和病理过程中的重要作用已被逐渐证实,但具体的机制,如与α1-ARs活化密切相关的心肌肥厚的发病机制等尚不明确。因此,阐明α1-ARs的关键调控因素,对临床研究心肌肥厚的发生及开发逆转心肌肥厚的药物均具有十分重要的理论意义和实用价值。