RIP140与TNF-α对心肌细胞能量代谢的调控作用
张銮坤,陈艳芳,刘培庆
(1.中山大学肿瘤防治中心药学部,华南肿瘤学国家重点实验室,肿瘤医学协同创新中心,广东 广州 510060;2.广州医学大学附属第二医院药学部,广东 广州 510260;3.中山大学药学院,广东 广州 510006)
肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)是衰竭心脏重要的炎症诱导因子,其可以激活NF-κB通路,并进一步诱导TNF-α、白介素2(interleukin 2, IL-2)等炎症因子的产生,形成正反馈恶性循环通路。受体相互作用蛋白140(receptor interacting protein 140,RIP140)与过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferators-activated receptor γ coactivator 1α,PGC-1α)是转录调控辅助因子,在心脏中通过调控线粒体能量代谢途径的关键基因和关键酶的表达,调节心肌细胞能量代谢平衡。研究表明,心脏中的代谢紊乱状况与长时间低水平的炎症反应息息相关。高脂饮食的小鼠显示出心肌胰岛素抵抗,并与心脏炎症、肥厚、纤维化及收缩功能障碍有关[1]。我们前期的研究表明,大鼠心脏组织中特异性过表达RIP140可激活NF-κB通路,并促进促炎症因子TNF-α、IL-1β和IL-2的释放[2]。Schilling等[3]发现,Toll样受体介导的炎症反应通过抑制PGC-1α,调控心脏能量代谢。Palomer等[4]发现,TNF-α可降低PGC-1α的表达,促进心肌细胞葡萄糖氧化。鉴于RIP140与PGC-1α共定位于细胞核内,并有共同转录辅助调控的靶基因,起着相反作用,那么TNF-α能否促进RIP140的表达,持续扩大炎症反应与能量代谢紊乱呢?本文通过研究RIP140与TNF-α对心肌细胞的影响,探索心肌细胞中炎症反应与代谢紊乱之间的交互作用。
1 材料与方法
1.1 材料
1.1.1细胞株 大鼠心肌细胞H9c2,购自上海中国科学院细胞库。
1.1.2试剂 RNA逆转录试剂盒、Flash SYBR Green qPCR试剂盒(Thermo);核蛋白提取试剂盒(Active Motif);TNF-α(Sigma);p65、IκB-α抗体(Cell Signaling Technology);Histone H3、α-tubulin抗体(Sigma);RIP140(Abcam);TRIzol(TaKaRa);引物由上海生工合成。
1.1.3仪器 酶标仪、电泳仪、电转仪、iQ5荧光定量PCR仪(Bio-Rad);Image Quantity LAS4000化学发光成像仪(通用医疗);核酸蛋白微量定量仪NanoDrop 2000、PCR仪(Eppendorf)。
1.2 H9c2细胞培养从液氮罐中取出冷冻的H9c2细胞,直接置于37 ℃融化复苏,无菌环境下转移至含3~4 mL DMEM培养基(含10% FBS)的15 mL离心管中,1 000 r·min-1离心6 min,弃上清,每管用5~6 mL含10% FBS的DMEM培养基重悬,接种于25 cm2培养瓶内,置于37 ℃、5% CO2的培养箱中培养。传代3次后,取对数期细胞进行后续实验研究。
1.3 腺病毒感染H9c2细胞携带RIP140基因的腺病毒(Ad-RIP140)及腺病毒空载对照(Ad-GFP)由本课题组构建,严格按照Clontech 腺病毒纯化试剂盒(Adeno-XTM Maxi purification kit)的要求操作,其构建和鉴定参考前期研究[5]。H9c2心肌细胞分别加入重组腺病毒Ad-RIP140及对照Ad-GFP,直接覆盖心肌细胞表面,37 ℃孵箱中培养4 h 后补加适当体积的完全培养基,继续感染44 h。
1.4 细胞核蛋白、胞质蛋白提取与Western blot参照核蛋白提取试剂盒说明书进行,分离细胞核蛋白和胞质蛋白,考马斯亮蓝蛋白定量后,分装50 μg蛋白上样。配制8%的分离胶和5%的浓缩胶,70 V分离30 min,于120 V电压继续电泳至溴酚蓝到达分离胶底部。220 mA恒流电转90 min,用5%的脱脂牛奶室温封闭1 h,加入相应抗体,4 ℃孵育过夜。二抗(1 ∶1 000)室温孵育1 h,洗膜后于暗室下加入生物发光液显影。采用化学发光成像仪、Quantity one软件对条带进行灰度分析,以组蛋白Histone H3、α-tubulin分别作为核蛋白与胞质蛋白的内参对照。
1.5 qPCR法检测mRNA表达水平取各组贴壁细胞,采用TRIzol法提取细胞总RNA,使用核酸微量定量仪对提取的RNA进行质量检查及定量,参照逆转录试剂盒说明书,进行逆转录反应,获得模板cDNA。使用Flash SYBR Green qPCR试剂盒对目标基因进行扩增,荧光定量PCR仪检测荧光信号,最终以β-actin为内参,采用2-ΔΔCt方法计算目标基因的mRNA相对表达水平,引物序列见Tab 1。
2 结果
2.1 腺病毒介导RIP140基因在H9c2细胞中的过表达验证使用纯化腺病毒Ad-RIP140感染H9c2细胞,Western blot检测RIP140的蛋白表达。如Fig 1所示,随着感染滴度的升高和感染时间的延长,H9c2心肌细胞外源性RIP140的表达逐渐增加。
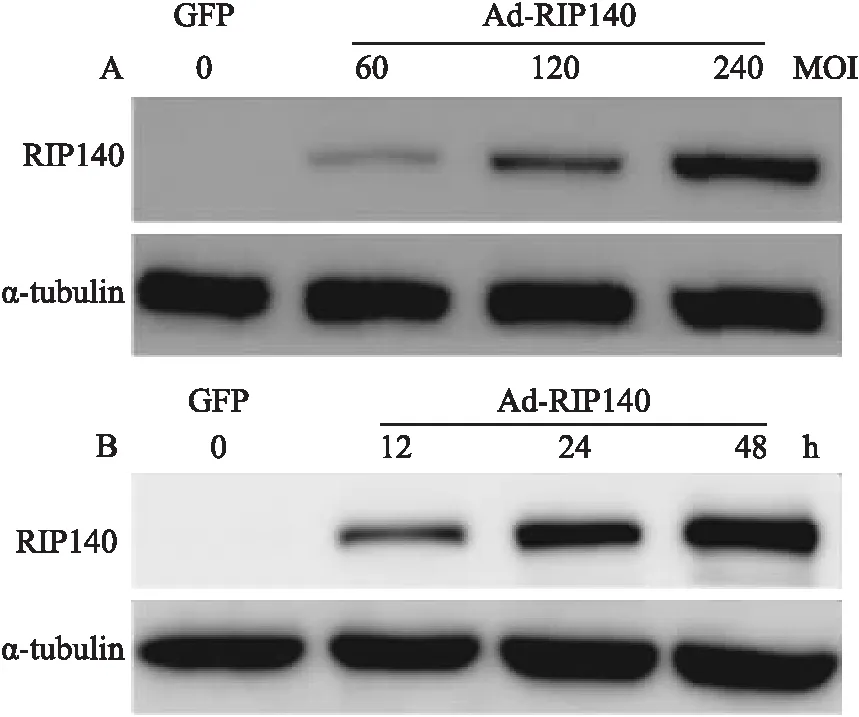
Fig 1 Efficacy of Ad-RIP140
RIP140 protein level increased in H9c2 infected with Ad-RIP140 in a quantity-dependent(A) and time-dependent(B) manner.
2.2 TNF-α与RIP140引起心肌细胞能量代谢紊乱PPARs中的PPAR-α与PPAR-β/δ可调节心肌细胞脂肪酸摄取、β氧化和葡萄糖代谢的多种蛋白。丙酮酸脱氢酶激酶4(pyruvate dehydrogenase kinase isoform 4,PDK4)是调节丙酮酸氧化脱羧的重要激酶,控制着心肌细胞葡萄糖分解代谢的速率。为了探索TNF-α与RIP140的相互作用能否影响能量代谢,我们培养H9c2心肌细胞,分为对照组、Ad-RIP140组、TNF-α组、Ad-RIP140+TNF-α组,real-time PCR检测PPAR-α、PPAR-β/δ、PDK4的mRNA表达水平。如Fig 2所示,与对照组相比,Ad-RIP140组PPAR-α、PPAR-β/δ、PDK4的mRNA表达水平下降,差异有统计学意义(P<0.05),TNF-α组PPAR-α和PDK4的mRNA表达水平下降(P<0.05);与Ad-RIP140组相比,Ad-RIP140+TNF-α组PPAR-β/δ和PDK4的mRNA表达水平更低(P<0.05)。说明TNF-α与过表达RIP140可引起心肌细胞能量代谢紊乱。
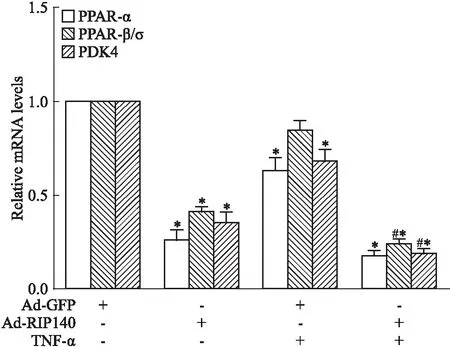
Fig 2 TNF-α aggravated down-regulation of key metabolic genes by superabundant
Cardiomyocytes were infected with Ad-RIP140(MOI 240, 48h), simultaneously with or without TNF-α(100 μg·L-1, 24 h) treatment. The mRNA levels of PPAR-α, PPAR-β/δ, and PDK4 were measured.*P<0.05vsAd-GFP group.#P<0.05vsAd-RIP140 group.
2.3 过表达RIP140促进H9c2心肌细胞p65-NF-κB转位入核我们使用纯化腺病毒Ad-RIP140感染H9c2心肌细胞,观察过表达RIP140能否在成年大鼠心肌细胞模型中激活NF-κB通路。如Fig 3所示,与腺病毒空载Ad-GFP组相比,Ad-RIP140感染组H9c2细胞核内p65含量明显升高,胞质中IκB-α的含量下降,差异有统计学意义(P<0.05)。结果表明,H9c2心肌细胞中过表达RIP140可激活NF-κB通路,p65-NF-κB转位入核。
2.4 过表达RIP140促进H9c2心肌细胞促炎症细胞因子mRNA表达炎症反应中,NF-κB调控着多个诱导因子和效应因子的表达,我们利用real-time PCR技术检测了TNF-α、IL-1β、IL-2的mRNA水平,进一步观察炎症通路激活后炎症因子的表达情况。Fig 4结果显示,H9c2心肌细胞过表达RIP140可明显上调促炎细胞因子的表达(P<0.05)。
2.5 TNF-α增加心肌细胞RIP140的表达TNF-α可降低PGC-1α的表达,促进心肌细胞葡萄糖氧化。考虑到RIP140与PGC-1α有共同转录辅助调控的靶基因,TNF-α对RIP140的表达也可能有影响。我们使用TNF-α(20 μg·L-1)刺激H9c2心肌细胞12 h,观察到RIP140的mRNA和蛋白表达均明显升高(P<0.05),见Fig 5。
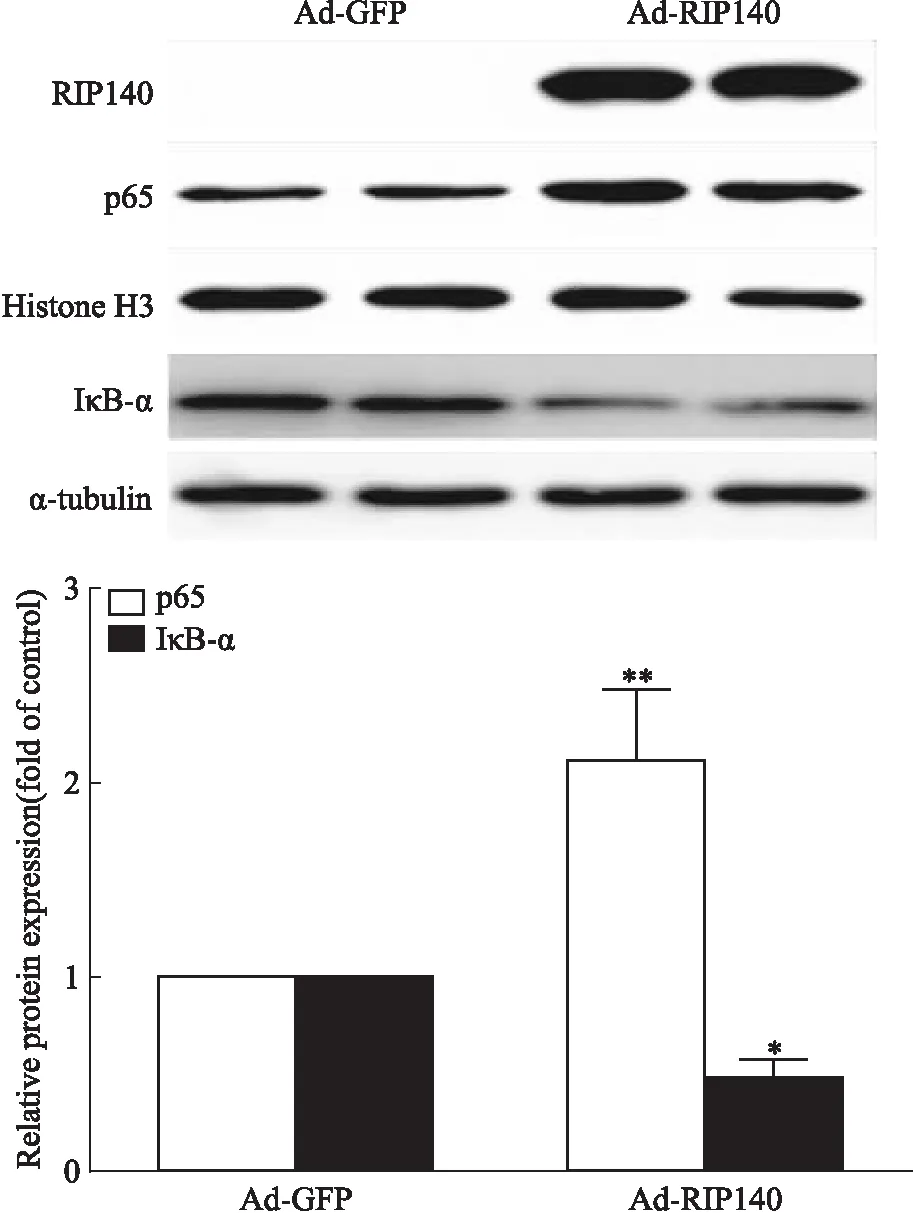
Fig 3 Activated NF-κB signaling following RIP140
H9c2 cells were infected with adenovirus overexpressing RIP140(MOI 240, 48 h) or GFP control. Protein levels of p65 in nucleus and IκB-α in cytoplasm were detected.*P<0.05,**P<0.01vsAd-GFP group.

Fig 4 Superabundant RIP140 induced proinflammatory response in H9c2 cell
H9c2 cells were infected with an adenovirus overexpressing RIP140(MOI 240, 48 h) or GFP control. The mRNA levels of TNF-α, IL-1β and IL-2 were measured by real-time PCR.*P<0.05vsAd-GFP group.
3 讨论
心脏做功与能量代谢密切联系,为维持其收缩与舒张功能,心肌细胞将贮存在脂肪酸与葡萄糖中的能量转化为肌浆球蛋白的机械能。PPARs是核激素受体家族中的配体激活受体,它有3个亚型,其中PPAR-α与PPAR-β/δ在心脏的表达丰度较高,它们通过调节脂肪酸摄取、β氧化和葡萄糖代谢的多种蛋白,对心脏能量代谢起着重要的调控作用。在心肌细胞使用葡萄糖供能的代谢中,丙酮酸在丙酮酸脱氢酶复合体(pyruvate dehydrogenase complex,PDC)催化下氧化脱羧,生成乙酰辅酶A。PDK4是调节PDC活性的重要激酶,控制着葡萄糖的分解代谢速率。PPAR-α、PPAR-β/δ和PDK4下调,意味着心脏利用脂肪酸供能减少,利用葡萄糖供能增多,能量供应总体降低。前期研究表明,促炎症细胞因子与病理性心室重构和心衰的形成密切相关。心衰患者心肌组织血清中的促炎细胞因子TNF-α含量明显增加,NF-κB活性也明显增强。心脏特异性过表达TNF-α可引起心肌炎症反应和病理性重构,严重者可导致充血性心力衰竭[6]。此外,NF-κB特异性抑制剂和基因敲除均能明显抑制压力负荷和AngII灌注诱导的心肌肥大[7]。转基因小鼠心脏特异性激活IKK/NF-κB通路,可诱导炎症性心肌病变及心衰[8]。可见,心肌肥厚、心衰的发生和发展伴随着NF-κB通路的激活及TNF-α等促炎症细胞因子的参与。我们前期的研究表明,特异性过表达RIP140的大鼠心脏代谢相关基因明显下调,但三磷酸腺苷含量没有明显变化,心脏功能障碍得到了补偿;而在梗死手术的应激下,过表达RIP140大鼠心脏在线粒体基因、呼吸控制比和ATP含量中表现出更大程度的抑制,心脏整体功能进一步恶化[9]。本研究结果中,TNF-α刺激心肌细胞导致PPAR-α、PDK4的mRNA表达水平下降,Ad-RIP140组PPAR-α、PPAR-β/δ、PDK4的mRNA表达水平下降。Ad-RIP140组、TNF-α组细胞存活率没有变化,Ad-RIP140+TNF-α组出现细胞部分死亡的情况(约10%~15%),存活细胞PPAR-β/δ、PDK4的mRNA表达水平更低,TNF-α应激显然加剧了RIP140引起的心肌细胞能量代谢紊乱,与我们前期研究结果一致。

Fig 5 TNF-α induced RIP140 expression
H9c2 cells were treated with or without TNF-α(20 μg·L-1, 12 h). The mRNA(A) and protein levels(B) of RIP140 were measured by real-time PCR and Western blot.*P<0.05,**P<0.01vscontrol group.
在心肌细胞中,LPS可通过激活NF-κB通路,诱导促炎细胞因子的产生,而抑制PPARs则加剧了此效应,说明抑制PPARs可增加NF-κB的活性[10]。我们前期的研究表明,乳鼠心肌细胞特异性过表达RIP140可通过激活NF-κB通路,使PPARs的表达明显下降,并且PPARs的下降跟NF-κB通路激活相关[11]。可见,RIP140可诱导炎症反应和能量代谢紊乱,本研究进一步使用H9c2成年大鼠心肌细胞模型,探索RIP140与炎症反应之间的关系。腺病毒介导的RIP140过表达系统可激活心肌细胞NF-κB通路,致使细胞中促炎症细胞因子IL-1β、IL-2、TNF-α表达升高。综合文献和我们的实验结果发现:一方面,过表达RIP140可以通过激活NF-κB通路,下调PPARs的表达;另一方面,过表达RIP140很可能通过下调PPARs的表达,间接激活NF-κB通路,从而形成炎症与能量代谢紊乱的恶性循环。
RIP140与PGC-1α共同调节着一系列能量代谢相关的基因的转录,其作用相反,在心衰的发展过程中,RIP140表达升高,PGC-1α表达下降[12]。PGC-1α减少或RIP140增加,均引起PDK4的转录下调,导致葡萄糖的分解代谢速率加快。Palomer等[4]发现,TNF-α可降低PGC-1α的表达,抑制PDK4的转录,从而上调心肌细胞的糖代谢速率。这与我们给予TNF-α后,心肌细胞RIP140表达上调,且PDK4表达下降的结果是一致的。TNF-α对心肌细胞能量代谢的影响可能与RIP140表达上调有关。
综上所述,一方面,RIP140可激活NF-κB通路,诱导心肌细胞促炎症细胞因子白介素、TNF-α表达升高;另一方面,促炎症因子TNF-α可刺激RIP140增加,二者作用形成一种正反馈,共同致PPAR-β/δ和PDK4表达下降加剧,加速心肌细胞能量代谢紊乱。
(致谢:本实验在中山大学药学院药理毒理实验室完成。)