疫苗监管的封闭原理分析
刘 玮,高 轩
(淮北师范大学 政法学院,安徽 淮北 235000)
2011-2014年,我国疫苗监管体系先后两次通过了世界卫生组织的评估,体现出我国疫苗监管的制度优势。但我们也应清楚地认识到,近几年我国问题疫苗事件频现,无一不让人痛心疾首。2018年,长春长生生物科技有限责任公司(以下简称长春长生)“问题疫苗”事件再度吸引全国人民的眼球,“长春长生”“百白破”“问题狂苗”成为各大媒体的热搜词。李克强总理就疫苗事件作出批示:此次疫苗事件突破人的道德底线,必须给全国人民一个明明白白的交代。[1]我国疫苗监管体系得到世界卫生组织的认可,有一个重要的原因是执行制度做得很好[2],但高标准的疫苗监管体系与频繁出现的“问题疫苗”事件形成鲜明对比,不得不让人思考良好执行制度下的执行力问题。
一、理论基础
封闭原理在管理学中应用非常广泛,它指一个管理过程是封闭的“回路”,而且这个回路可以很好地运作,使得管理有质有量。[3]27封闭原理作为重要的管理原理,不仅在企业管理中发挥着至关重要的作用,在公共管理中的作用也不可替代。一个封闭的行政系统分为五个部分,分别发挥不同的作用。其中,指挥机构是司令部,它发出指令,并将反馈信息回收回来。执行机构则负责指令的具体实施,充当着“运动员”的角色。借用政治—行政二分法,指挥机构充当着“政治”的角色,负责表达信息与指令,而执行机构充当“行政”角色,负责接收并将信息与指令变为实际行动。而指令执行的效果传导给接收机构,之后此机构再根据执行的具体情况向反馈机构发出讯号。反馈机构将指令与实践效果比对,并对结果进行处理,再根据实际情况对原指令提出修正意见,以便指挥机构根据反馈结果发布新的指令。当然,这一系列的活动都离不开监督机构,它是为保证指挥机构发出的指令能够准确无误地被执行而设置的,它根据执行机构是否按指令办事而作出决定(如图1)。
指挥机构、执行机构、接收机构、监督机构与反馈机构是一个封闭系统中不可或缺的部分,没有指挥机构发布的正确指令,就没有执行机构正确的执行,接收机构也不可能接收到正确的信息;没有监督机构的时刻监督,指挥中心的指令也不能准确及时到达执行机构;缺乏反馈机构,执行结果偏差也无法得到有效矫正。因此,有效的行政管理系统必须是完整、封闭的,并且这种封闭应该具有动态性、时效性,能够根据反馈信息及时调整,使整个封闭回路系统与时俱进,适应新形势下管理的需要。
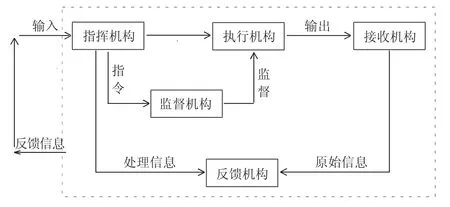
图1 封闭回路结构图
二、疫苗链条的封闭原理分析
疫苗链条很长,从疫苗的研发、生产到投入接种,涉及到诸多单位,例如疫苗生产商、疾控中心与各地疫苗接种单位,不仅需要企业的生产经营,也需要政府部门的干预。疫苗链条可以用封闭原理进行分析。
(一)指挥机构:国家
疫苗属于公共产品,特别是一类疫苗,由国家垄断提供,免费供给。从1978年至今,我国计划免疫已经实施了40多年的时间,疫苗种类、接种范围都得以扩大。在疫苗链条中,国家与政府充当指挥机构的角色,发布接种疫苗的指令,包括疫苗的种类、接种疫苗的人群范围及地域范围等。公共产品是具有社会公共需要性质的产品与服务,由国家生产或提供,疫苗和疫苗接种作为特殊的卫生产品和服务,理应由国家生产或提供。但从实际来看,国家将此公共产品外包,并对生产经营活动进行监督和干预,接收国家指令进行生产和提供疫苗的单位即是执行机构。
接种疫苗是预防控制传染病最有效的手段,疫苗接种的普及能够避免无数儿童残疾和死亡。我国通过接种疫苗,实施国家免疫规划,大大降低了传染病发病率,有效保护了广大儿童的健康和生命安全。从中国疾病预防控制中心网站查询得知,自我国实施计划免疫后,各类疾病的预防控制取得了很好的效果,其中5岁以下儿童乙肝病毒携带率已从1992年的9.7%降至2014年的0.3%;麻疹的年发病人数从20世纪中期的900多万降至2017年的6 000例以下;普及儿童计划免疫前,白喉每年可导致数以十万计儿童发病,2006年后,我国已无白喉病例报告。20世纪60年代,我国流脑发病最高年份曾高达304万例,2017年发病人数已低于200例;乙脑最高年份报告近20万例,2017年发病数仅千余例。[4]从以上数据可以得出,免疫规划是我国指挥机构发出的正确指令。
(二)执行机构:疫苗研发生产单位及接种单位
1.疫苗研发生产单位
虽然疫苗属于公共产品,但当其外包之后,各个疫苗研发生产单位就变成了疫苗链条中的执行机构。疫苗研发生产单位一定程度上是追求经济利益最大化的“理性经济人”。疫苗的研发具有特殊性,投入较大、周期很长,而且即使投入大量的时间、资金也未必会有回报,因此很多企业选择降低研发投入,甚至放弃研发。以2018年“问题疫苗”的当事单位长春长生为例,其2017年的研发费用只占其营业收入的7.87%。[5]由于疫苗的研发创新不足,使得中国的疫苗无法突破,只能生产同质化的产品。[6]疫苗市场竞争激烈,疫苗生产企业会想方设法提升自己的市场竞争力。《中国新闻周刊》在2010年调查当时狂犬病疫苗价格时了解到,原材料成本约占总生产成本的41.49%,几乎近半。当时,原国家卫生部规定疫苗企业加价不能超过20%,因此,控制原材料成本是疫苗生产企业抢占市场和利润的重要方式。[7]而一味追求降低成本带来的则是疫苗的质量隐患,很多问题疫苗产生的直接原因就是偷工减料,降低成本。例如2008年河北福尔、江苏延申以及大连金港安迪公司的问题疫苗事件。2018年,长春长生生产的问题狂犬病疫苗,同样是为了降低生产成本。该企业披露的2017年年报显示,其在2017年二类疫苗(包括狂犬病疫苗)营业成本同比上一年降低2.87%,营业收入同比增加近60%,毛利率达90.86%。[7]时隔10年,“问题疫苗”的原因竟如出一辙。
在我国良好的疫苗监管体系之下,疫苗在研发出来之后也需要进行严格的安全性和有效性测试,一旦发现疫苗的效价等指标低于国家标准便不允许上市。即便如此,市场上“问题疫苗”仍频现,造成这一问题的原因有很多,主要有两点:一是国家监管部门也被疫苗企业蒙骗,对问题疫苗并不知情;二是国家监管部门存在腐败以及权力寻租的问题。[8]只要有权力的存在就有寻租的空间,特别对于疫苗这样的高利润行业,在结构性剩余的前提下,有些企业必然会在疫苗审批等环节中寻找权力寻租的机会。
2.疾控中心及疫苗接种单位
疫苗研发上市之后要流通到各疾控中心及疫苗接种单位,由他们负责给民众接种,同时将疫苗接种相关情况汇总上报,因此疾控中心及接种单位一方面承担了执行机构的功能,另一方面也承担了反馈机构的功能。我国的一类疫苗由国家垄断并定价,基本没有操作的空间。二类疫苗从生产单位到接种单位的流通方式主要有两种,一种是由省统一采购、统一配发;另一种则由地方疾控部门和接种单位自行采购,而这种方式更容易产生灰色空间,可以从中牟利,也导致了问题疫苗的出现。[9]
(三)反馈机构:疾控中心及疫苗接种单位
《疫苗流通和预防接种管理条例》第五章特别强调了疫苗预防接种异常反应的处理,作为直接接触接种群体的单位,疾控中心及疫苗接种单位便于及时收集关于疫苗接种的第一手信息,并将信息进行处理汇总,上报给上级部门。
疾控中心与接种单位一旦发现被接种人出现异常情况,应启动应急预案,首先进行初步处理,然后报告到上级主管部门。上级主管部门也应将预防接种异常反应的处理情况再上报到国家级主管部门。
(四)监督机构
《疫苗流通和预防接种管理条例》对我国疫苗监管机构作出了明确规定,即为国务院卫生主管部门。县级以上及国务院卫生主管部门是疫苗接种阶段的监督部门,国务院和省、自治区、直辖市人民政府药品监督管理部门是疫苗生产、流通环节的监管部门,他们共为疫苗监管的责任单位。
三、疫苗监管的“封闭性”缺陷
疫苗监管主要集中在对执行机构、反馈机构的监管上,“问题疫苗”的出现是因为执行客体往往受制于很多因素而导致其主动性较差,最终无法形成良好的合力[2]。
(一)疫苗监管封闭系统的“时效性”不足
从上述分析可以看出,疫苗监管基本可以构成一个封闭回路,但良好的封闭回路并不是僵化的,应因势利导,积极回应现实的变化,而这正是我国疫苗监管所缺乏的。
《中华人民共和国药品管理法》第一百零一条明确将疫苗列为药品,它虽对人的影响非常隐蔽,不易被接种群体发现,但一旦出现不利影响会严重损害人的机体功能。而根据《中华人民共和国突发事件应对法》的规定,问题疫苗属于公共卫生事件,一旦发生就应该启动应急预案并迅速处理,保证疫苗监管的时效性。但从实际情况来看,我国疫苗监管的时效性不足,以长春长生的百白破问题疫苗为例,2018年7月20日,吉林省食药监局发布的行政处罚公示,长春长生生产的“吸附无细胞百白破联合疫苗”(批号:201605014-01)经中国食品药品检定研究院检验,其效价低于国家规定,属于劣药。而这条处罚信息针对的却是2017年11月的一起违法事件。2017年的问题疫苗历时8个多月的时间才得以处罚,这是疫苗监管时效性不足的例证,同时也体现了良好监管制度执行力的不足。
(二)封闭回路再循环效果不理想
疫苗监管封闭回路中反馈机构将收集到的信息进行处理汇总传递给指挥机构,指挥机构再根据新信息发布新指令,这是封闭原理“动态性”的体现,也是疫苗监管有效性的重要保证。
我国疫苗监管封闭回路的再循环效果不理想主要体现在疫苗不良反应监测上。目前,我国的疫苗不良反应监测系统仍然存在缺陷[8],并且疫苗不良事件监测工作分属不同的部门,疾控部门和药监部门之间的合作不畅[10],同时由于疫苗检测的技术性较强,基层药监部门很难自主检测出疫苗存在的质量问题。另外,我国的疫苗补偿机制、疫苗召回制度以及疫苗再评价制度在实践方面仍然没有得到实质性的推进,这些因素综合起来成为违规疫苗上市流通的制度漏洞。以长春长生为例,狂犬病疫苗生产过程严重违规,百白破疫苗上市流通8个多月才被发现效价不符合标准,出现此类问题都与我国疫苗的预防接种不良反应监测系统不完善有关。
(三)封闭回路中监督机构作用力不显著
疫苗监管封闭回路中监督机构虽实际存在,但由于对执行机构特别是对问题疫苗责任单位的惩处力度较低,其发挥的实际作用力不显著。我国法律对疫苗审批生产、流通上市、预防接种等环节作出了规定,并列举了不合法、不合规行为应负的法律责任,以往问题疫苗案件的处理结果也是一种警示力量。而近几年问题疫苗的同质化程度凸显出这些规定与司法实践的警示力较弱,监督机构作用力不显著。2009年,庞红卫因非法经营人用疫苗受到刑事处罚,而在第二年却又重操旧业。此类问题不止于此,长春长生的“问题狂苗”也不是第一次。问题疫苗事件的不断发生,使疫苗监管陷入了“问题疫苗——处罚——同质问题疫苗——再处罚”的循环,一方面是因为疫苗能够带来的巨大经济利益使得企业和监管部门铤而走险,另一方面也表明违法所带来的处罚不足以使他们害怕。[11]正如中国人民大学教授刘俊海所言,药企屡教不改的关键在于违法成本太低,罚了款、换个药名又继续经营。以长春长生的百白破疫苗事件为例,对于涉事百白破疫苗,共没收违法所得85.88万元,并处罚款258.4万元。25万支问题疫苗,罚款共计344.29万元,为该企业2天的利润,引发众多网友及儿童家长质疑。疫苗生产经营企业会根据自己预期所获收益与可能所受的惩罚进行成本—收益分析,如果违法成本较低,在巨大的利益驱动下,企业往往会铤而走险。
四、强化疫苗监管的“封闭性”
(一)建立健全疫苗全程追溯制度
2008年毒奶粉事件曾引起全国人民的恐慌,也带来了中国制造的信任危机,而目前国产奶粉质量大大提高,奶粉行业的全程追溯制度也逐步完善,给疫苗行业提供了很好的范例。通过识别每一罐奶粉上面的二维码或序列号就可以轻松追踪奶粉从生产到上市的全过程,赢得了消费者的一致好评,这一技术也可以应用到疫苗行业中。目前,疫苗都有自己具体的批号,可以在此基础上将其细化,对每一批的每一支疫苗进行编号,形成独一无二的身份识别码,即每一支疫苗都有自己的序列号或二维码,这一身份识别码会跟随疫苗的“一生”。通过这一识别码,用户可以轻松追踪到疫苗从审批生产到流通上市再到预防接种不同时期的具体信息。这一技术的广泛应用具有诸多优势,一方面保障了用户的信息知晓权,不管是疫苗接种单位还是普通的疫苗接种人都可以方便快捷地了解到贯穿疫苗“一生”的身世信息,有利于调动用户的积极性,参与到对疫苗的监管中来;另一方面,也有利于国家对疫苗的有效监控,防止非法疫苗进入市场,不具备合法身份识别码的疫苗很难鱼目混珠。即使是已经流通到市场中的合法疫苗一旦出现问题,也可以通过身份识别码快速追踪到是什么流程出现了问题,相对轻松快捷地追查到责任人。
很多发达国家都在试图完善覆盖生产、流通、消费等全流程的疫苗信息化追溯机制,我国上海市在这方面的工作也卓有成效,目前已经建成市疫苗和预防接种综合管理信息系统,实现基于信息系统覆盖第一类疫苗和第二类疫苗的采购、供应、仓储、物流和接种等的全环节、全过程、可追溯综合管理,并已在上海市长宁区实现区域全覆盖运行。我国可借鉴国外及上海市的经验并推广,建立健全惠及全国的疫苗全程追溯制度。
(二)建立应急处理机制与危机限时处理制度
长春长生问题疫苗事件虽然最终有了解决方案,但历时8个多月的处理时间,使“时效性”成为人们诟病的话题,让人们一度怀疑政府“懒政”。疫苗直接影响人们的生命健康安全,一旦出现问题,极易引起人们的恐慌,此次长春长生问题疫苗事件如此,此前的山东非法经营疫苗案也例证了这一点。由于政府没能在疫苗案件出现后的第一时间向民众解释,导致公众对疫苗的信任度降低。[10]问题疫苗事件对政府来说就是一个公共危机,所以建立良好的应急处理机制是有效应对公共危机的重要基础,一旦发生危机,政府可立即启动应急处理机制以有效控制危机的进一步蔓延,减少损失。
危机限时处理制度也是解决疫苗监管“时效性”不足的重要制度。现有的危机处理机制并未强调“时效性”的问题,疫苗监管虽然形成了基本的封闭回路,但由于时效性不足,监管效果并不理想。因此,应该在危机处理机制中强调“时效”的重要性,一旦危机爆发,主管部门应立即启动应急机制,及时按照法定程序实施后续解决方案。为防止出现渎职和懒政行为,应当规定处理期限,如需延长,必须取得上级主管部门的书面同意。不同类别、不同程度的危机对应不同的处理时限,可根据突发事件的危害程度,分别对特别重大、重大、较大和一般四级危机事件规定不同的处理时限。
(三)提高违法成本,加大监控力度
提高违法成本、加大处罚力度是事后补救的重要途径,需从两个方面入手。一方面,需加大对问题疫苗生产运营人员的处罚力度,不仅要提高罚款额度,还要严格追究刑事责任。目前,我国疫苗被定性为药品,并且“效价不合格”等问题疫苗属于“劣药”,而非“假药”,这些都可以在《中华人民共和国药品管理法》中找到依据。由于法律的相对稳定性特质,近期通过改变法律规定来改变问题疫苗的属性尚不可行,因此,要加大处罚力度,可以在“自由裁量权”上下功夫。《中华人民共和国药品管理法》第七十四条中详细规定了生产、销售劣药的一般行为、情节严重的行为以及构成犯罪的行为所对应的处罚措施,但规定留下了较大的自由裁量权,对于生产、经营问题疫苗的,可以考虑按照自由裁量的上限加以处罚。另一方面,还要依法追究监管人员的责任,对失职、渎职行为严肃问责,增强监管责任人的责任意识,防止“懒政”“怠政”等不作为行政行为以及受利益集团干扰的寻租行为的发生。
英国东亚委员会秘书长麦启安(Alistair Michfe)认为,中国利用G7等高收入国家作为基准是合理的,因为这些国家对错误批次药品的法律惩罚是如此之高,导致没有一家合法的药品生产商敢犯错误。以德国为例,德国以卫生部为主导,下设疫苗常务委员会,形成了专门的监管机构网络,对问题疫苗案件进行严厉处罚。德国疫苗接种者可以状告生产厂家,只要一人胜诉,厂家就会面临非常严重的处罚,因此疫苗生产商不敢以身试法。[12]
不管是疫苗研发生产单位还是执行单位,都是追求经济利益最大化的“经济人”,所作出的行为都是成本—收益核算下的最优选择,难免会产生危害人民群众利益的结果,这是市场弊端的体现,也反映出政府干预与监督的必要性。因此,在尊重市场经济的前提下应加强对疫苗的监管,封闭原理提供了良好的分析视角,可在此基础上认识到疫苗监管的不足并加以改善。
(责任编辑张 转)

