植物乳杆菌CGMCC8198破碎上清液对黑色素生成的抑制作用
张彩姣,俞晓亭,潘丽娟,周 浩,张同存,罗学刚
(工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津 300457)
黑色素是由黑色素细胞合成的一种生物色素,能够保护细胞DNA,避免皮肤被紫外线灼伤,但其过速增长或分布不均会导致皮肤局部黑色素沉积过度,导致老年斑、雀斑、黑斑病等病症[1-2].酪氨酸相关蛋白(TRPs)家族和小眼畸形相关转录因子(MITF)是影响黑色素生成最重要的分子,TRPs家族包括酪氨酸酶(TYR)、酪氨酸酶相关蛋白 1(TRP-1)和酪氨酸酶相关蛋白 2(TRP-2).TYR是黑色素生成过程中的限速酶,其表达和活性决定着黑色素生成的速度和数量;MITF对 TYR、TRP-1和 TRP-2的转录调控至关重要.目前市场上很大一部分美白剂的机理都是抑制酪氨酸酶的活性[3],常用的美白成分有熊果苷、曲酸、维生素 C及其衍生物等[4].虽然应用广泛,但也存在一些副作用,比如曲酸的细胞毒性会导致皮炎甚至癌症[5-6],维生素 C的稳定性差等,致使其应用都不是很完美.此外,一些氧化剂如阳光、烟雾中的紫外线(UV)引起的活性氧(ROS)也会导致皮肤黑色素沉积过多[7].体内过量的自由基可引发疾病和提前衰老[8],它可以刺激黑色素激活因子如 PGE2和α-MSH的分泌,从而促进黑色素合成[9].一些ROS清除剂或抑制剂可以减少黑色素生成和皮肤色素沉着,例如应用还原型谷胱甘肽(GSH)和抗坏血酸衍生物来治疗色素沉着过度等问题[10-11].
大多数乳酸菌无毒、无害,并且乳酸菌菌体及其代谢产物具有较强的抗氧化活性[12].它的抗氧化活性主要是指对超氧阴离子自由基(O-2·)、羟自由基(OH·)和 1,1-二苯基-2-苦味肼基自由基(DPPH)的清除作用及抗脂质过氧化性[13-14].Liu等[15]研究表明人体摄入某些乳酸菌后,不仅可以降低活性氧的累积,而且可以降低O-2·和过氧化氢的浓度.Kullisssr等[16]发现大多数乳酸菌是通过产生 SOD酶和 GSH而具有清除OH·和过氧化氢的能力.一些乳酸菌由于菌株中NADH和NADPH作用,还具有还原活性[17].
植物乳杆菌(L.plantarum)CGMCC8198具有很好的降血脂、降血糖等功效[18-20],但其在抑制黑色素形成及美容护肤等领域的作用尚不清楚.本文采用小鼠黑色素瘤细胞 B16F10为模型,验证植物乳杆菌(L.plantarum)CGMCC8198其菌体破碎上清液(LAS)对黑色素生成的抑制效果.
1 材料与方法
1.1 材料
1.1.1 菌种与质粒
植物乳杆菌(L.plantarum)CGMCC8198、非洲绿猿猴肾成纤维细胞 COS-7 和 pGL3-Basic载体均为本实验室保藏,小鼠黑色素瘤细胞 B16F10购自中国科学院上海细胞生物学研究所.
1.1.2 试剂与仪器
DPPH、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、噻唑蓝(MTT)、曲酸、左旋多巴(L-DOPA)、蘑菇酪氨酸酶和二甲基亚砜(DMSO),美国 Sigma-Aldrich公司;TYR、TRP-1、TRP-2和MITF的抗体,美国Abcam公司.
Synergy多功能微孔方板检测仪,美国Biotek公司;CO2恒温培养箱,美国 Thermo Forma公司;ECLIPSE TS100-F型倒置显微镜,日本Nikon公司;StepOnePlus Real-time PCR仪,美国 ABI公司;Odyssey红外激光成像系统,美国 Li-cor Biosciences公司.
1.2 样品制备
-80℃保藏的植物乳杆菌以 1%的接种量接入10mL MRS培养基中,37℃厌氧培养箱中培养至108mL-1.连续活化 3代后,将植物乳杆菌CGMCC8198的菌液于 4℃、12000r/min离心20min,弃上清液.将得到的菌体用 PBS洗 2次,重复离心,最终用与原始培养基等体积的 PBS将菌体重悬进行超声破碎.超声条件:振幅 300,超声 3s停4s,超声时间 30min.菌体破碎上清液(LAS)用0.22µm针式过滤器过滤,-20℃冰箱保存.
1.3 抗氧化能力测定
ABTS工作液的配制:称取ABTS粉末38.4mg,用 PBS定容至 10mL,得 7mmol/L溶液;称取过硫酸钾37.8mg,用1mL去离子水溶解,得140mmol/L溶液;将 10mL 7mmol/L ABTS溶液和 176µL 140mmol/L过硫酸钾溶液混合,在室温、避光条件下静置过夜,形成 ABTS+储备液.使用前用 PBS稀释成工作液,要求其在 734nm 下的吸光度为 0.7±0.02.
DPPH工作液的配制:称取 DPPH粉末3.944mg,用甲醇溶解并定容至20mL,DPPH浓度为0.5mmol/L,4℃避光保存.使用前用甲醇稀释成工作液,反应物在514nm下测定吸光度.
ABTS清除实验:取不同浓度的 LAS样品100µL,加入到 100µL ABTS工作液中,混匀,37℃避光孵育30min.以PBS为空白对照,在734nm下测定吸光度(A).以曲酸作为阳性对照组,ABTS清除率按照式(1)计算.

DPPH清除实验:取不同浓度的 LAS样品和甲醇各100µL,分别加入到100µL DPPH工作液中,混匀,37℃避光孵育 30min,以甲醇为空白对照(A0),在514nm下测定LAS样品的吸光度(A1).取不同浓度的 LAS样品 100µL,加入到 100µL 甲醇中混匀,37℃避光孵育 30min,在 514nm 下测定吸光度(A2).以曲酸作为阳性对照组,DPPH 清除率按照式(2)计算.
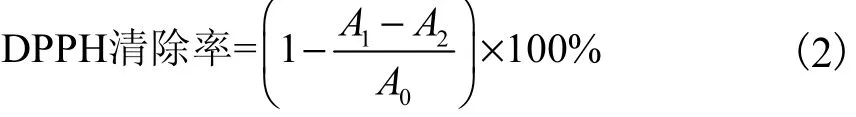
1.4 黑色素含量的检测与细胞活力的测定
小鼠黑色素瘤细胞 B16F10和非洲绿猿猴肾成纤维细胞 COS-7分别用 DMEM-HG培养基和 F12完全培养基培养,加入体积分数为 10%的胎牛血清、1%青霉素-链霉素溶液(100×),37℃、5% CO2培养箱培养.
黑色素含量的检测:将对数生长期的小鼠黑色素瘤 B16F10细胞接种于 6孔板,用 5%、10%和 20%的菌体破碎上清液(LAS)处理 B16F10细胞 48h,观察培养基颜色变化.用 NaOH裂解法检测细胞内黑色素含量,每孔加入 1mol/L的 NaOH溶液 500µL,65℃裂解 30min,用移液器将细胞液吹匀,加入到96孔板中,每孔 100µL,用酶标仪测定 490nm 下吸光度.
细胞活力的测定:采用MTT法测细胞活力. LAS体积分数为 0%、5%、10%、20%,800µmol/L曲酸作为阳性对照,将细胞与 LAS样品孵育 48h后,弃掉培养基,用 5mg/mL的 MTT溶液代替,再培养 4h.去除 MTT溶液,每孔加入 100µL DMSO,采用多功能微孔方板检测仪测定其在490nm下的吸光度.
1.5 酪氨酸酶活性的检测
1.5.1 细胞内酪氨酸酶活性检测
取对数生长期的小鼠黑色素瘤 B16F10细胞接种于 6孔板中,待细胞贴壁后,加入含有不同体积分数(0%、5%、10%、20%)LAS的培养基,37℃、5%CO2培养箱中培养48h.用含有1% Triton X-100的PBS溶液裂解细胞,与 10mmol/L 的 L-DOPA于37℃避光反应 30min,用酶标仪在 490nm下测定吸光度.
1.5.2 细胞外蘑菇酪氨酸酶活性检测
用蘑菇酪氨酸酶检测了LAS是否对其有抑制作用,检测方法参照文献[21]进行了一些改动.向96孔板中每孔加入 40µL 10mmol/L的左旋多巴、40µL 125单位的蘑菇酪氨酸酶、80µL PBS和 40µL不同浓度的LAS样品混合均匀,曲酸作为阳性对照,灭菌水作为阴性对照,37℃避光孵育10min,490nm下测定吸光度.
1.6 酪氨酸酶的转录表达
1.6.1 逆转录-聚合酶链反应(RT-PCR)
使用 Trizol试剂从培养的细胞中提取细胞总RNA,并使用 M-MLV逆转录酶进行逆转录. PCR条件:95℃变性30s,54℃退火45s,72℃延伸30s,共28个循环.反应结束分别取6µL PCR产物进行琼脂糖凝胶电泳.β-actin(199bp)上游引物 5'-CGTTGACATCCGTAAAGACC-3',下游引物 5'-GAAGGTGGACAGTGAGGC-3',退火温度 56℃;TYR(373bp)上游引物 5'-ACACCTGAGGGACCA CTAT-3',下游引物 5'-CATTGGCTTCTGGGTAAA CT-3',退火温度 54℃;TRP-1(264bp)上游引物 5'-GCCACAAGGAGGTTAGAAGACA-3',下游引物 5'-CCAGTAAGGAAGGGAGAAAGAG-3',退火温度58℃;TRP-2(360bp)上游引物 5'-AGAAGTTTGACAG CCCTCC-3',下游引物 5'-CAAGTTGCTCTGCGGT TAG-3',退火温度 56℃;MITF(162bp)上游引物 5'-AACGGGAACAGCAACGAGC-3',下游引物 5'-TC ACCAGATCAGGCGAGCA-3',退火温度54℃.
1.6.2 实时荧光定量PCR(Real-time PCR)
取对数生长期的黑色素瘤B16细胞接种于6孔板,待细胞贴壁后,加入含有不同体积分数(0%、5%、10%、20%)LAS的培养基,37℃、5% CO2培养箱中培养48h.用Bestar SybGreen qPCR Mastermix进行扩增:95℃ 2min;95℃ 10s,60℃ 30s,72℃30s,40个循环.熔解曲线:95℃ 1min,55℃1min,95℃ 10s.
1.6.3 免疫印迹实验(Western blot)
弃掉细胞培养皿中的培养基,PBS冲洗 2~3次,每孔加入 300µL的细胞裂解液,冰上裂解30min,再用细胞刮刀刮下细胞,收集在 EP管中,100℃煮沸 15min;取 40µL样品进行 SDS-PAGE电泳(5%浓缩胶,电压 80V;12%分离胶,电压120V,电泳时间 2~3h),电转移至醋酸纤维素膜上,经水冲洗后用 5%脱脂奶粉封闭 1h,然后加入兔抗 TYR、TRP-1、TRP-2、MITF 一抗抗体,TYR 和MITF稀释1000倍,TRP-1 和TRP-2稀释5000倍;4℃孵育过夜.用 PBS洗涤 3次,每 5min 换液 1次;加入稀释1000倍的TRITC标记的羊抗兔二抗,室温孵育 1h,Odyssey远红外成像系统分析.
1.7 荧光素酶活性检测
在 COS-7细胞中应用荧光素酶活性检测 LAS对pGL3-TYR和pGL3-MITF质粒的抑制作用.用含有TYR和MITF启动子的质粒转染COS-7细胞,4h后将培养基换为含有不同浓度 LAS的培养基,培养24h,利用luci裂解液裂解细胞,与luci底物反应,在多功能微孔检测仪上检测.
1.8 数据处理
实验数据使用 SPSS V13.0软件处理;各组实验数据以“平均值±标准差”表示.组间统计学差异显著性比较采用t检验,*P<0.05表示统计学上有显著性差异,**P<0.01表示统计学上有极显著性差异.
2 结果与分析
2.1 LAS的抗氧化作用
LAS的抗氧化作用如图 1所示.LAS对 ABTS和 DPPH的清除能力随着加药量的增加而增强.100%的LAS对ABTS的相对清除率为82.65%,对 DPPH 的相对清除率为 44.30%,结果表明:LAS对自由基有一定的清除作用,尤其是对 ABTS的自由基清除能力很强.曲酸对 ABTS和 DPPH自由基都有明显的清除作用,尤其是对 ABTS的作用更加明显.因此,以曲酸为对照,说明以该抗氧化体系检测LAS的抗氧化作用的结果合理.

图1 LAS的抗氧化作用Fig. 1 Antioxidant effect of LAS
2.2 LAS对小鼠黑色素瘤细胞B16F10的影响
LAS对 B16F10细胞活力和黑色素生成的影响如图2所示.
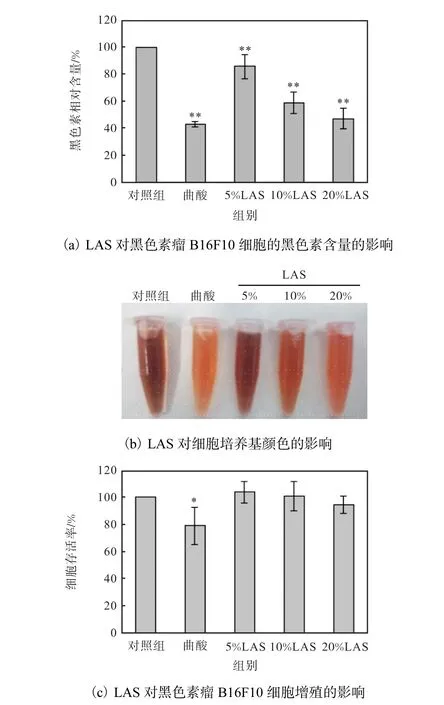
图2 LAS对B16F10细胞活力和黑色素生成的影响Fig. 2 Effects of LAS on B16F10 cell viability and melanin production
由图 2(a)可知,20%的 LAS对细胞内黑色素的抑制效果接近于阳性对照曲酸的,说明 LAS有一定的黑色素抑制作用.同时,在用NaOH裂解法检测细胞内黑色素之前,将加不同体积分数 LAS培养了48h的细胞培养基收集于 EP管中,对细胞培养基颜色的观察结果如图2(b)所示.从培养基颜色来看,随着加药浓度的增加,培养基颜色逐渐变浅.与对照组相比,20%加药组培养基颜色明显变浅,说明细胞分泌的黑色素明显减少,LAS对黑色素生成有一定的抑制作用.由图 2(c)可知,随着加药量增加,细胞存活率有所降低;当加药量为 20%,细胞的存活率为94.13%,说明细胞生长情况良好,加药不会对细胞数量造成严重影响.阳性对照曲酸的加药量为800µmol/L,此浓度下细胞的存活率为 78.93%,虽然细胞有所死亡,但这个浓度的细胞存活率不会对后续实验造成严重影响.
2.3 LAS对酪氨酸酶活性的影响
LAS对酪氨酸酶活性的影响如图 3所示.LAS给药后明显抑制 B16F10细胞内酪氨酸酶的活性,并且随着LAS给药浓度的增加而降低,当LAS的加药量为 20%时,细胞内酪氨酸酶的抑制率为 39.95%(图 3(a)).

图3 LAS对酪氨酸酶活性的影响Fig. 3 Effect of LAS on tyrosinase activity
LAS对细胞外酪氨酸酶活性的影响如图 3(b)所示,随着LAS加药剂量的增加,蘑菇酪氨酸酶的活性并没有变化,LAS并不能抑制蘑菇酪氨酸酶的活性.为了排除实验过程中一些试剂等外部因素的干扰,同时也用曲酸检测了对蘑菇酪氨酸酶活性的影响,结果如图 3(c)所示.曲酸能显著抑制蘑菇酪氨酸酶活性,100µmol/mL的曲酸能抑制 90.99%的蘑菇酪氨酸酶活性.由图 3(b)和图 3(c)可以得出结论,LAS并不能抑制酪氨酸酶自身的活性.综上说明LAS影响黑色素的生成并不是通过抑制酪氨酸酶自身的活性.
2.4 LAS对酪氨酸酶转录表达的影响
LAS对酪氨酸酶转录表达的影响如图 4所示.在LAS给药48h后的B16F10细胞中,实时荧光定量PCR结果显示,LAS能明显降低TYR、TRP-1、TRP-2、MITF的表达,且随着LAS给药量的增加,其抑制作用呈剂量依赖性增强.当 LAS的加药量为20%时,对TYR的抑制率为36.90%,对TRP-1的抑制率为 57.72%,对 TRP-2的抑制率为 35.12%,对MITF的抑制率为40.88%(图4(a)).
LAS给药 48h后,酪氨酸酶及其相关基因在蛋白水平上的表达明显下调,且呈剂量依赖性,蛋白水平结果(图4(b))与转录水平相符.这表明LAS给药能够抑制黑色素生成相关基因的表达.

图4 LAS对酪氨酸酶转录表达的影响Fig. 4 Effect of LAS on transcriptional expression of tyrosinase
2.5 LAS对MITF及TYR启动子转录活性的影响
为进一步验证 LAS对黑色素生成的抑制机理,对 TYR和 MITF的启动子活性进行了检测,如图 5所示.加入 LAS后能剂量依赖性的抑制 TYR 和MITF的启动子活性,当LAS的体积分数为20%时,对 MITF的抑制率为 23.00%,对 TYR的抑制率为40.45%.结果可知,LAS能抑制 MITF和 TYR的启动子转录活性.
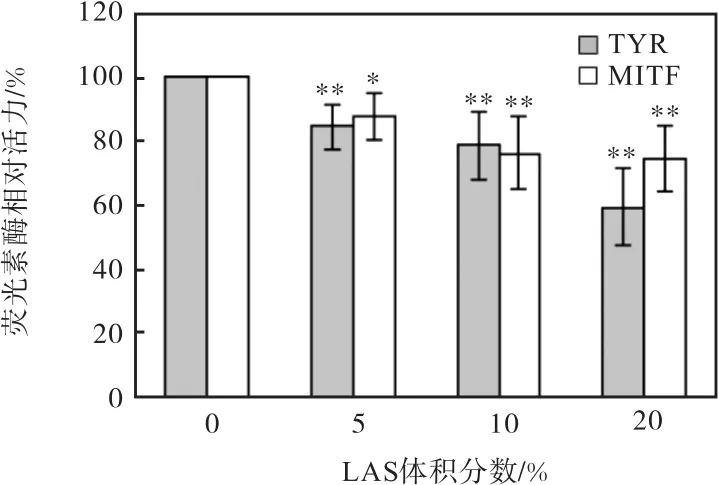
图5 荧光素酶活性分析LAS对TYR和MITF启动子的影响Fig. 5 Effect of LAS on the promoter activity of TYR and MITF
3 讨 论
由于黑色素在基底层的异常蓄积,导致人们遭受着黑斑病、雀斑等问题的困扰,影响人们的生活质量.随着对黑色素生物合成的不断研究,研究者们发现了在黑色素合成过程中起关键作用的限速酶——酪氨酸酶,酪氨酸酶抑制剂成了解决黑色素合成的重要手段,一些美白产品也都加入了酪氨酸酶抑制剂.但是,大部分酪氨酸酶抑制剂的副作用也逐渐暴露出来,如熊果苷的光敏性、曲酸和维生素 C的低效能等情况.冯荣楷等[22]对 643个从文献及数据库中取得的酪氨酸酶抑制剂进行皮肤毒性研究,发现其中约一半带有刺激性、腐蚀性或致癌性.因此,很有必要寻找更安全可用的酪氨酸酶抑制剂.已有研究[23]表明,从奶牛粪便中分离的乳酸菌菌株可用于开发酪氨酸酶抑制剂的潜在药物.本研究中,LAS可以抑制细胞内酪氨酸酶的活性,且对细胞的生长几乎没有影响,相比其他酪氨酸酶抑制剂来说使用更安全.并且发现,LAS对黑色素生成的抑制作用很可能是通过抑制 MITF和 TYR的启动子转录活性,从而下调TYR、TRP-1、TRP-2及MITF的转录表达而发挥的.
黑色素的生成还与氧自由基有关.研究[24]表明,氧自由基通过刺激黑色素激活因子如 PGE2和α-MSH的分泌来促进黑色素的合成,导致色素沉着.因此,阻断或清除自由基也可以抑制黑色素的形成.抗坏血酸、半胱氨酸等都是通过抗氧化性来抑制黑色素合成的.采用 ABTS和 DPPH自由基清除法对LAS的抗氧化活性进行了分析,证明了LAS对自由基有一定的清除作用,尤其是对 ABTS的自由基清除活性很高.LAS中对黑色素生成有抑制作用的功能组分尚不明确,有研究[25]表明多糖类物质可以抑制酪氨酸酶活性,且某些乳酸菌发酵产生的胞外多糖可以降低 B16 细胞黑色素产量,LAS的主要功能组分可能是胞外多糖,但仍尚需进一步研究.
4 结 语
本研究证明了植物乳杆菌 CGMCC8198的菌体破碎上清液具有很好的抗黑色素生成及抗氧化的功能,并揭示了益生菌抑制黑色素形成的部分作用机制,将为相关化妆品及功能产品的研发提供新思路.

