曲克芦丁原料药中三羟乙基芦丁及相关物质的半制备液相色谱法分离纯化
刘少静, 杨黎彬*, 徐小静, 韩红芳, 杨 阳, 余丽丽
(1.西安医学院药学院,陕西西安 710021; 2.西安医学院药物研究所,陕西西安 710021)
曲克芦丁(Troxerutin)是由芦丁经羟乙基化制备的半合成黄酮类化合物,为商品药维脑路通的主要成分。曲克芦丁相比芦丁能溶解于水,易于被人体吸收,其生物利用度较高[1 - 3]。曲克芦丁能够增加毛细血管抵抗力,降低毛细血管通透性和脆性,防止因血管通透性升高引起的水肿;同时具有抑制血小板凝聚,防止血栓形成,增加血氧饱和度,改善微循环等作用。除此之外,曲克芦丁还具有抗放射性损伤、抗炎、抗过敏、抗溃疡等多种生理活性,是临床上治疗静脉障碍、血栓症及闭塞性脑血管疾病的常用药物[4 - 7]。
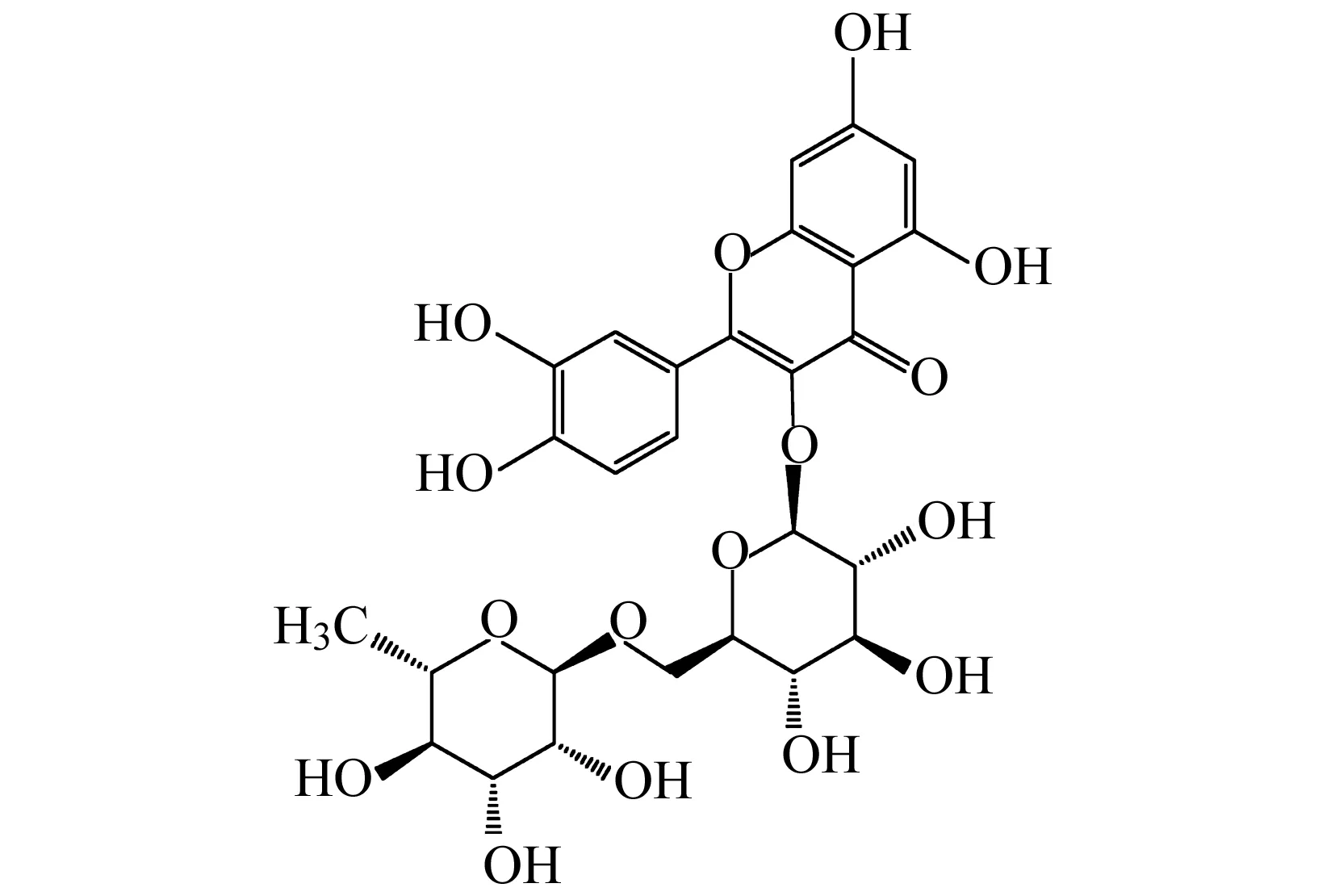
图1 芦丁化学结构Fig.1 Chemical structure of rutin
曲克芦丁通常是由芦丁在碱性条件下与环氧乙烷进行醚化反应得到的羟乙基芦丁,由于芦丁(图1)结构中存在四个解离羟基,理论上有十余种羟乙基芦丁形成。因此,目前生产和使用的曲克芦丁原料药是以三羟乙基芦丁为主要成分的羟乙基衍生物的多组分混合物,而其中药效最强的是三羟乙基芦丁。但是由于合成工艺的差异,会引起曲克芦丁及相关物质含量的变化[8 - 10]。目前有关曲克芦丁原料药中主成分及相关物质的监测及制备研究尚未见文献报道。因此,为进一步提高和监控曲克芦丁产品质量,本研究采用半制备液相色谱法对曲克芦丁原料药进行分离纯化,获得了纯度较高的三羟乙基芦丁及2个相关物质四羟乙基芦丁和四羟乙基槲皮素。
1 实验部分
1.1 仪器、试剂及原料
Aglient 1260系列高效液相色谱仪(美国,安捷伦科技有限公司),包括四元梯度泵、自动进样器、柱温箱;FA1004B电子天平(上海越平科学仪器有限公司);岛津LC-6AD型半制备液相色谱仪(日本,岛津公司);RE-2000A旋转蒸发仪(巩义市予华仪器有限责任公司);Varian VNMRS 600型核磁共振谱仪(美国,安捷伦科技有限公司);FD -1000型冷冻干燥机(日本,东京理化株式会社)。
曲克芦丁原料药(口服用,含量80%以上,批号:KF170307,由陕西某制药厂提供);乙腈、甲醇(色谱纯,广东光华科技股份有限公司);冰HAc(分析纯,天津市天力化学试剂有限公司)。实验用水为娃哈哈纯净水。
1.2 液相色谱条件
色谱条件1:Aglient TC-C18色谱柱(250×4.6 mm,5 μm);流动相:乙腈-0.1%HAc溶液(20∶80,V/V);流速:0.5 mL·min-1;柱温:30 ℃;检测波长:254 nm。
色谱条件2:Agilent TC-C18色谱柱(250×4.6 mm,5 μm);流动相:甲醇-水溶液(60∶40,V/V);流速0.5 mL·min-1;柱温30 ℃;检测波长254 nm。
1.3 半制备液相色谱条件
色谱条件1:Agilent ZORAX SB-C18色谱柱(250×9.4 mm,5 μm);流动相:乙腈-水溶液(17∶83,V/V);流速1.0 mL·min-1;柱温:室温;进样量200 μL;检测波长254 nm。
色谱条件2:Venusil ASB C18色谱柱(250×10 mm,5 μm);流动相:甲醇-水溶液(60∶40,V/V);流速1.0 mL·min-1;柱温:室温;进样量250 μL;检测波长254 nm。
1.4 样品的制备
(1) 称取曲克芦丁原料药适量,用流动相(乙腈∶水=17∶83,V/V)溶解定容,配制成20 mg·mL-1的溶液,按照1.3半制备色谱条件1进行制备、分离(图2A),分别收集保留时间为12~14 min和24~30 min的流出物。连续进样数次,合并保留时间相同的流出物,减压浓缩除去有机溶剂后,冷冻干燥,制得淡黄色无定形粉末a和b。
(2) 称取曲克芦丁原料药适量,用流动相(甲醇∶水=60∶40,V/V)溶解定容,配制成50 mg·mL-1的溶液,按照1.3半制备色谱条件2进行制备、分离(图2B),收集保留时间为10.5~12 min的流出物。连续进样数次,合并保留时间相同的流出物,减压浓缩除去有机溶剂后,冷冻干燥,制得淡黄色无定形粉末c。
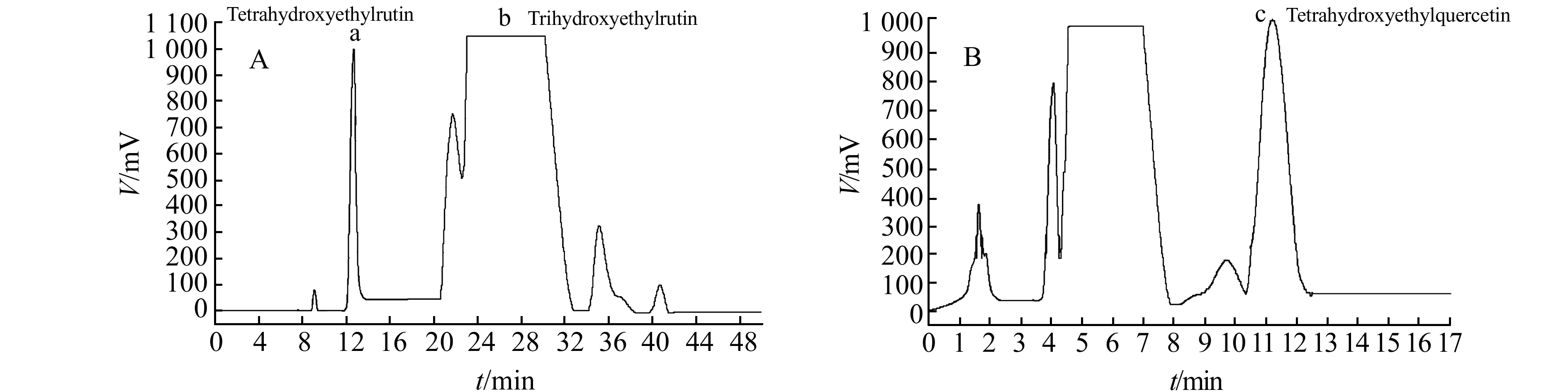
图2 不同色谱条件的半制备液相色谱图Fig.2 Semi-preparative liquid chromatograms in different chromatographic conditions(A,B)A.Agilent ZORAX SB-C18 column(250×9.4 mm,5 μm),the mobil phase was acetonitrile-water(17∶83,V/V);B.Venusil ASB C18 column(250×10 mm,5 μm),the mobil phase was methanol-water(60∶40,V/V),the flow rate was 1.0 mL·min-1.room temperature,λ=254 nm.
1.5 样品溶液的制备
分别称取适量样品a、样品b,采用乙腈-0.1%HAC溶液(20∶80,V/V)溶解并定容,称取适量样品c,采用甲醇-水溶液(60∶40,V/V)溶解并定容,制得3个样品溶液,浓度分别为1.1 mg·mL-1(样品溶液a)、1.2 mg·mL-1(样品溶液b)和1.1 mg·mL-1(样品溶液c)。
2 结果与讨论
2.1 分析用液相色谱条件的优化
(1) 曲克芦丁结构中酚羟基和醇羟基的存在使得化合物具有弱酸性,因此,为改善色谱峰形,减少拖尾,提高分离度,在样品纯度检测时于分析用流动相中加入0.1%的冰HAc。
(2) 曲克芦丁是以三羟乙基芦丁为主的羟乙基芦丁混合物,各衍生物性质接近,色谱保留行为相似,较难获得良好分离效果。因此,本实验考察了3种不同的分析型色谱柱: Venusil ASB-C18柱(250×4.6 mm,5 μm)、Agilent Eclipse Plus-C18柱(100×4.6 mm,3.5 μm)和Agilent TC-C18柱(250×4.6 mm,5 μm)。结果显示,显示样品在Agilent Eclipse Plus-C18柱和Agilent TC-C18柱上分离度较好;在Venusil ASB-C18柱上存在色谱峰拖尾和基线漂移现象。综合考虑,最终选用Agilent TC-C18柱(250×4.6 mm,5 μm)。
2.2 半制备液相色谱条件的优化
(1) 分析用流动相中加入0.1%HAc用于改善峰形、提高分离度,但是由于HAc沸点较高(117.9 ℃),减压浓缩时难以除去,将会有新的杂质引入样品中。另外,HAc浓度在减压浓缩过程中逐渐升高,引起样品酸水解,所以在半制备液相色谱流动相中将0.1%HAc改为纯水,对产品的纯度无影响。
(2) 曲克芦丁是芦丁(Rutin)经羟乙基化的半合成产物,是由三羟乙基芦丁及其它羟乙基芦丁组成的混合物,各衍生物间性质接近,较难分离、制备。在制备色谱条件2下(图2B)四羟乙基芦丁(a)与三羟乙基芦丁(b)难以达到基线分离,无法制备纯度较高的化合物。因此在该实验中,为获得a、b、c三个高纯度化合物,采用了2个不同的半制备液相色谱条件,见1.3节。
2.3 样品纯度检查
按照1.2中色谱条件1对样品溶液a、b进行分析测定;按照1.2中色谱条件2对样品溶液c进行分析测定,见图3。采用面积归一化法计算得3种物质的含量,依次为98.94%、98.14%、98.96%。

图3 分析用HPLC色谱图Fig.3 HPLC chromatogramsa.tetrahydroxyethylrutin;b.trihydroxyethylrutin;c.tetrahydroxyethylquercetin.
2.4 元素分析
通过元素分析测得a、b、c三个样品中C和H的含量分别见表1。从表1中数据可见,3个样品中C和H两种元素相对含量的实测值与理论值相符。

表1 C元素及H元素的分析结果
2.5 质谱分析
采用电喷雾电离源,以正离子扫描模式,对a、b、c三个样品进行质谱分析,结果见表2。由表2可见,三个样品的质谱分析结果与其分子量一致。

表2 质谱分析结果
2.6 核磁共振谱解析
2.6.1 样品a(1)1H NMR(D2O) d:7.67(1H,2′-H),7.43(1H,6′-H),6.90,6.89(1H,5′-H),6.37(1H,6-H),6.31(1H,8-H),0.95(3H,12″-H),5.05(1H,1″-H),4.49(1H,7″-H),3.16~4.16(糖基上的-CH、-CH2)。(2)13C NMR(D2O) d:177.483(C=O),166.427(C-7),162.048(C-9),160.823(C-5),157.157(C-3′),152.921(C-4′),149.183(C-2),138.956(C-3),125.395(C-1′),124.826(C-6′),116.386(C-5′),114.655(C-2′),110.830(C-10),105.298(C-8),103.757(C-6),100.106(C-7″),96.921(C-1″),78.641(3′,4′-OCH2-),78.072(5,7-OCH2-),77.021(C-10″),74.445(C-2″),73.868(C-8″),72.951(C-5″),72.793(C-3″),72.651(C-9″),72.580(C-4″),71.521(C-11″),70.912(C-6″),62.844,62.780,62.741,62.670(-CH2OH),19.307(C-12″)。
对比样品a与样品b的氢谱、碳谱数据,确定样品a为四羟乙基芦丁,结构见图4。
2.6.2 样品b(1)1H NMR(D2O) d:7.48(1H,2′-H),7.23(1H,6′-H),6.68(1H,5′-H),6.03(1H,8-H;1H,6-H),0.90、0.91(3H,12″-H);4.97、4.97(1H,1″-H),4.40(1H,7″-H),3.08~4.02(糖基上的-CH、-CH2)。(2)13C NMR(D2O) d:180.178(C=O),167.177(C-7),162.372(C-9),159.029(C-5),158.484(C-3′),153.142(C-4′),149.127(C-2),136.933(C-3),125.458(C-1′),124.510(C-6′),116.133(C-5′),114.481(C-2′),107.605(C-10),105.132(C-8),103.670(C-6),100.846(C-7″),96.344(C-1″),78.460(3′,4′-OCH2-),77.875(7-OCH2-),76.863(C-10″),74.485(C-2″),73.023(C-8″),72.746(C-5″),72.691(C-3″),72.619(C-9″),72.564(C-4″),71.513(C-11″),70.454(C-6″),62.788,62.670(-CH2OH),19.402(C-12″)。
根据上述氢谱、碳谱数据,并参考相关文献报道[11 - 12],确定样品b为三羟乙基芦丁,结构见图5。

图4 四羟乙基芦丁结构Fig.4 Chemical structure of tetrahydroxyethyl rutin

图5 三羟乙基芦丁结构Fig.5 Chemical structure of trihydroxyethyl rutin

图6 四羟乙基槲皮素结构Fig.6 Chemical structure of tetrahydroxyethyl quercetin
2.6.3 样品c(1)1H NMR(DMSO) d:12.62(1H,3-OH),7.84,7.84,7.82(1H,2′-H),7.82,7.81,7.80(1H,6′-H),7.17,7.16(1H,5′-H),6.80,6.80(1H,6-H);6.38,6.38(1H,8-H)。(2)13C NMR(DMSO) d:177.972(C=O),164.466(C-7),160.672(C-9),156.136(C-5),155.132(C-3′),150.936(C-4′),147.759(C-2),137.209(C-3),122.225(C-1′),122.099(C-6′),113.658(C-5′),112.813(C-2′),104.965(C-10),98.019(C-8),92.684(C-6),73.631(3′-OCH2-),70.501(4′-OCH2-),70.343(5-OCH2-),70.153(7-OCH2-),60.061,59.951,59.406,59.263,59.097(-CH2OH)。
对样品c的氢谱、碳谱数据进行分析,并与样品a谱图比对,确定样品c为四羟乙基槲皮素,结构见图6。
3 结论
本实验采用半制备液相色谱法从曲克芦丁原料药中分离纯化了四羟乙基芦丁(a)、三羟乙基芦丁(b)及四羟乙基槲皮素(c)等3个化合物,并进了结构表征。方法简便高效、重现性好。经高效液相色谱法分析检测,纯度均达到98%以上,该研究对进一步提高和监控曲克芦丁产品质量奠定基础。

