基于一步法构建的无酶传感器检测过氧化物的研究
杨 杰, 杨绍明, 曹 嫱, 张小荣, 柏朝朋, 滕 渝
(华东交通大学材料科学与工程学院,江西南昌 330013)
过氧化物广泛用作有机合成催化剂、医药杀菌剂、食品及饮用水消毒剂、漂白剂等领域,因此对过氧化物的定量测定具有重要的意义。目前已经有多种方法被应用于过氧化物的检测,如分光光度法[1]、滴定分析法[2]、荧光分析法[3]、化学发光法[4]及电化学方法等。电化学传感器法以其操作简单、响应快、选择性好、成本低等优点,被认为是较为理想的检测方法[5]。电化学传感器法分为酶传感器法和无酶传感器法。酶传感器法的特点是选择性好,但酶存在活性易受环境影响、稳定性差等问题[6]。因此,无酶传感器法检测过氧化物引起众多研究者的关注。为了提高无酶传感器法检测过氧化物的灵敏度及降低过氧化物的过电位,不同的纳米材料包括碳纳米管[7 - 8]、石墨烯[9]、纳米金属及其氧化物[10 - 11]、复合纳米材料[12 - 13]等被用于制备修饰电极。但目前文献报道制备复合纳米材料修饰电极的步骤繁琐、费时,而且修饰电极检测过氧化物的灵敏度有待提高,因此,研制制备方法简单且能灵敏检测过氧化物的复合纳米材料修饰电极十分必要。
铜纳米粒子(CuNPs)作为金属纳米家族中重要的成员,具有表面积大、导电性好、生物相容性强等优点,被广泛用于催化领域。近年来科学家们发现CuNPs可以通过化学或电化学的方式固定在修饰电极表面[14 - 15],拓宽了其应用领域。此外,碳纳米管(CNTs)因其具有较大的比表面积、良好的生物相容性、优良的电子传递速度等特点,已广泛用于电化学传感器的制备[16 - 18]。本文以具有表面积大、导电性好的泡沫镍(Ni foam)为基底材料,采用简单的一步法恒电位沉积制备CuNPs-CNTs/Ni foam修饰电极。电极表面修饰的CuNPs和CNTs分布均匀,能较好地提高电极的催化活性和稳定性。基于构建的这种无酶电化学传感器,实现了对H2O2及其有机过氧化物过氧化氢叔丁基(BHP)、过氧化氢异丙苯(CHP)的高灵敏检测。
1 实验部分
1.1 主要仪器与试剂
CHI 660E 电化学工作站(上海辰华仪器有限公司);采用三电极体系:以修饰电极为工作电极,Ag/AgCl电极为参比电极,铂电极为对电极。JSM-6701型扫描电镜(日本,JEOL公司)。泡沫镍(Ni foam,厚度1.5 mm);碳纳米管(CNTs,>97%,直径10~20 nm,深圳纳米港有限公司);CuSO4(江西化学试剂厂);H2O2(>30%,西陇化工股份有限公司);过氧化氢叔丁基(BHP)、过氧化氢异丙苯(CHP)购于国药集团化学试剂有限公司。实验用水为去离子水。
1.2 CuNPs-CNTs/Ni foam修饰电极的制备
首先将Ni foam用丙酮除油,再进行醇洗、水洗。将处理完成的Ni foam先置于6 mol/L的HCl中超声20 min,以除去表面的氧化物,然后再分别置于乙醇和去离子水中超声10 min。将处理好的Ni foam电极用高纯氮气吹干,然后用双导铜箔胶带将铜导线固定到Ni foam上,再将Ni foam裁剪为1.0×3.0 cm规格。将处理好的Ni foam电极置于按照文献方法[19]制备好的CNTs(1 mg/mL)、CuSO4(0.015 mol/L)和NaSO4(0.10 mol/L)的混合溶液中进行恒电位电沉积,用去离子水冲洗,以除去表面的物理吸附,则得到CuNPs-CNTs/Ni foam 修饰电极,将处理好的电极置于4 ℃的冰箱中保存,备用。CNTs/Ni foam修饰电极按照CuNPs-CNTs/Ni foam修饰电极的制备方法,但沉积液中只含有CNTs(1 mg/mL)。
1.3 电化学测定方法
将制成的修饰电极置于含有一定浓度过氧化物的0.2 mol/L磷酸盐缓冲溶液(PBS)中,采用三电极体系进行循环伏安法(CV)检测(扫描速率100 mV/s)得到CV曲线图;电化学交流阻抗谱(EIS)图是在5.0 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6](1∶1,V/V)溶液中测定得到(振幅:0.005 V,频率:1~100 000 Hz),并使用ZSimpwin软件进行线性拟合;电流-时间曲线(I-t)是将修饰电极置于0.2 mol /L PBS中,在恒定电位条件下,连续滴加一定浓度的过氧化物,以测定修饰电极的催化性能及稳定性。
2 结果与讨论
2.1 Ni foam和CuNPs-CNTs/Ni foam的扫描电镜与能谱表征
图1为Ni foam、CuNPs-CNTs/Ni foam的扫描电镜(SEM)图。由图1a可以看出Ni foam为三维蜂窝结构,由图1b可以看出预处理后的Ni foam表面光滑。从图1c可以看出,CuNPs均匀的分布在CNTs表面,形成CNTs-CuNPs纳米复合材料,粒径分布在120~300 nm之间。图2为CuNPs-CNTs/Ni foam的能谱(EDS)图,图中有Ni、C、O、Cu等元素的峰,结合扫描电镜图,说明成功的制备了CuNPs-CNTs/Ni foam 修饰电极。
2.2 修饰电极的电化学阻抗表征
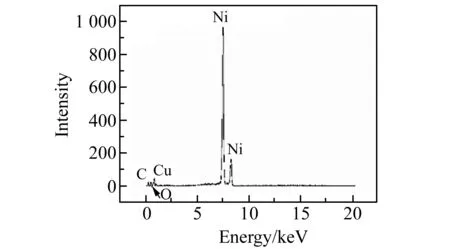
图2 CuNPs-CNTs/Ni foam的能谱(EDS)图Fig.2 EDS of CuNPs-CNTs/Ni foam
电化学交流阻抗法是有效感知修饰电极表面变化的重要方法之一。如图3所示,图中曲线a为预处理Ni foam电极的阻抗;曲线b为在Ni foam电极表面沉积上CNTs,可以发现阻抗谱的半径变小,这说明CNTs是一种良好的导体,对[Fe(CN)6]4-/3-电子在电极表面的传递有一定的促进作用;曲线c为在Ni foam表面一步法电沉积CuNPs-CNTs,其阻抗谱半径进一步减小。说明当沉积上CuNPs后电极的导电性进一步增强,CuNPs对[Fe(CN)6]4-/3-电子在电极表面的传递起促进作用。
2.3 不同修饰电极的循环伏安法表征
图4所示的分别是Ni foam(曲线a)、CNTs/Ni foam(曲线b)和CuNPs/Ni foam(曲线c)、CuNPs-CNTs/Ni foam(曲线d)在PBS(pH=7.0)中,以100 mV/s的扫速从-0.7 V扫到0.5 V所得的CV曲线。从图中可以得出,未修饰Ni foam的电极在该电位区间并无氧化还原峰出现;CNTs修饰在Ni foam电极上使电极的充电电流增加,表明CNTs能增大电极的比表面积;CuNPs/Ni foam(曲线c)修饰电极在0.07 V和-0.25 V处出现了一对明显的氧化还原峰,分别为Cu的氧化峰和还原峰[17];比较CuNPs-CNTs/Ni foam修饰电极(曲线d)与CuNPs/Ni foam修饰电极,可以发现CuNPs-CNTs/Ni foam修饰电极在电流增加的同时氧化还原峰峰电位也有明显的增加,进一步说明了CNTs促进了电子的转移。

图3 在5 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6](1∶1,V/V)溶液中不同电极的交流阻抗(EIS)谱图Fig.3 EIS responses of different electrodes in 5 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6](1∶1,V/V) solution

图4 不同电极在PBS(pH=7.0)中的循环伏安图Fig.4 Cyclic voltammograms of different electrodes in PBS(pH=7.0)
2.4 修饰电极对过氧化物的催化性能
本文采用CV法研究了CuNPs-CNTs/Ni foam对H2O2的催化行为,如图5(A)所示:曲线a为CuNPs-CNTs/Ni foam在PBS(pH=7.0)中的CV曲线,曲线b是PBS(pH=7.0)中加入150 μmol/L H2O2后的CV曲线。对比曲线a与曲线b,可以看出该修饰电极对H2O2产生了明显的催化还原特征,即在-0.25 V电位处的还原峰峰电流增大,0.07 V电位处的氧化峰的峰电流减小。结果表明该修饰电极对H2O2的催化性能较明显。
2.5 不同修饰电极对H2O2的催化效果
本文采用计时-电流法(I-t)于-0.25 V工作电位下,将Ni foam(图5(B)曲线a)、CNTs/Ni foam(图5(B)曲线b)、CuNPs/Ni foam(图5(B)曲线c)、CuNPs-CNTs/Ni foam(图5(B)曲线d)置于PBS(pH=7.0)中连续滴加5 μmol/L的H2O2得到I-t曲线。从图中可以看出Ni foam对H2O2有一定的催化作用;CNTs/Ni foam对H2O2的催化作用较弱,几乎可以忽略;CuNPs由于其特殊的纳米尺寸对H2O2有较好的催化作用[20];CuNPs-CNTs/Ni foam修饰电极对H2O2的催化作用最为明显,且催化效果远大于前三者的加和。由此可以得出CuNPs-CNTs纳米复合材料对H2O2的催化效果不是一种简单的加和作用,而是存在协同作用。说明CuNPs-CNTs纳米复合材料对H2O2有良好的催化效果。
2.6 沉积电位和沉积时间的优化
沉积电位对CuNPs-CNTs/Ni foam修饰电极的影响如图6(A)所示。从图中可以看出,当沉积电位在-0.3~-1.3 V之间变化时,修饰电极对H2O2(50 μmol/L)的电流响应先逐渐增加,在-0.9 V达到最大值,后又逐渐减小,因此本实验选择最佳沉积电位为-0.9 V。图6(B)为电沉积时间对CuNPs-CNTs/Ni foam修饰电极的影响。从图中可以看出,随着电沉积时间增加,修饰电极对H2O2(50 μmol/L)的响应电流先逐渐增加到达一个最大值,然后逐渐减小。在330 s处修饰电极的催化性能达到最大值。因此选择的最佳沉积时间为330 s。
2.7 CuNPs-CNTs/Ni foam修饰电极对过氧化物的检测分析
图7(A)为CuNPs-CNTs/Ni foam于-0.25 V电位下,在PBS中与一定浓度的H2O2的I-t曲线图,从图7(B)可知修饰电极响应电流随着H2O2浓度的增加而增加,且在5.0×10-7~3.4×10-4mol/L浓度范围呈现出良好的线性关系,其线性相关系数R=0.998。该修饰电极的灵敏度370(mA·L)/(mol·cm2),检测限为2.4×10-7mol/L。该修饰电极的灵敏度显著高于其它无酶法检测H2O2的灵敏度[21 - 22],这是因为本文制备的复合纳米材料具有优异的催化性能。
图8(A)为CuNPs-CNTs/Ni foam修饰电极对BHP的I-t曲线图,从图中可以看出,随着BHP的加入,电流响应值也在逐渐增加。图8(B)为与之对应的BHP浓度和响应电流的线性拟合图,线性相关系数为R=0.999;其线性范围为9.0×10-5~2.5×10-3mol/L,灵敏度为1.8(mA·L)/(mol·cm2),检测限为5.8×10-5mol/L。

图5 (A)CuNPs-CNTs/Ni foam在PBS(pH=7.0)中的循环伏安图;(B)不同电极在PBS(pH=7.0)中的I-t曲线Fig.5 (A) Cyclic voltammograms of CuNPs-CNTs/Ni foam in PBS(pH=7.0);(B)I-t curve of different electrodes in PBS(pH=7.0)

图6 (A)不同沉积电位的修饰电极对H2O2(50 μmol/L)的电流响应图;(B)不同沉积时间的修饰电极对H2O2(50 μmol/L)的电流响应图Fig.6 (A) The current response of the modified electrode by different deposition potential to H2O2(50 μmol/L);(B) The current response of the modified electrode by different electrodeposition time to H2O2(50 μmol/L)

图7 (A)修饰电极对H2O2的I-t曲线(工作电位为:-0.25 V);(B)修饰电极的电流响应与H2O2浓度的线性关系Fig.7 (A) I-t curve of the modified electrode to successive addition of H2O(applied potential:-0.25 V);(B) Linear relationship between current response of the modified electrode and H2O2 concentration

图8 (A)修饰电极对BHP的I-t曲线(工作电位为:-0.25 V);(B)修饰电极的电流响应与BHP浓度的线性关系Fig.8 (A) I-t curve of the modified electrode to successive addition of BHP(applied potential:-0.25V);(B) The linear relationship between current response of the modified electrode and BHP concentration
图9(A)为CuNPs-CNTs/Ni foam修饰电极对过氧化氢异丙苯的电流响应图,于-0.25 V下采用电流-时间曲线测定CuNPs-CNTs/Ni foam在PBS(pH=7.0)溶液中对连续滴加5.0×10-5mol/L的过氧化氢异丙苯。从图中可以看出,随着过氧化氢异丙苯的加入,电流响应值也在逐渐增加。图9(B)为与之对应的过氧化氢异丙苯浓度和响应电流的线性拟合图,其线性相关系数为0.999;其线性范围为:5.0×10-5~2.5×10-3mol/L,检测限为3.8×10-5mol/L。
2.8 抗干扰性能和回收率的测定
本文以H2O2为例,利用抗坏血酸(VC)、甘氨酸(Gly)、脲(Urea)研究了该修饰电极的抗干扰性能。对CuNPs-CNTs/Ni foam连续滴加10倍于H2O2浓度的上述干扰物及H2O2(5.0×10-5mol/L)进行检测。结果如图10,VC、Gly、脲对该修饰电极的影响几乎可以忽略,故该电极的抗干扰能力较强。

图9 (A)修饰电极对CHP的I-t(工作电位为:-0.25 V); (B)修饰电极的电流响应与CHP浓度的线性关系Fig.9 (A) I-t curve of the modified electrode to successive addition of CHP(applied potential:-0.25 V);(B) The linear relationship between current response of the modified electrode and CHP concentration

图10 CuNPs-CNTs/Ni foam对连续滴加干扰物和过氧化氢的响应电流值图(工作电位:-0.25 V)Fig.10 The response current of CuNPs-CNTs/Ni foam on successive addition of chaff interferent and H2O2(applied potential:-0.25 V)
为了研究该修饰电极测定H2O2的实用性能,分别对3种浓度的H2O2样品进行了回收率测试,结果如表1,得到的回收率范围在97.82%~101.3%之间。同时用该修饰电极对某医用H2O2进行测定,由电流响应值测出浓度为0.45 mol/L,则其中H2O2的质量分数为3.10%,这与产品中介绍的质量分数为3% 非常接近,因此制备的CuNPs-CNTs/Ni foam修饰电极具有较强的实用性。

表1 过氧化氢的回收率
2.9 修饰电极的重现性和稳定性研究
同一根CuNPs-CNTs/Ni foam修饰电极对50 μmol/L的H2O2重复测定5次,其电流响应的相对标准偏差为2.4%。用5根平行制备的CuNPs-CNTs/Ni foam修饰电极对50 μmol/L的H2O2进行检测,其相对标准偏差为4.6%。说明该修饰电极具有良好的重现性。将该电化学传感器存储于4 ℃ 冰箱中,四星期后,采用该电化学传感器对50 μmol/L的H2O2进行测定,仍保留了88.7%的响应电流值,表明该电化学传感器稳定性良好。
3 结论
本文采用一步电沉积的方法,制备了CuNPs-CNTs/Ni foam修饰电极,并用电化学循环伏安法和电流-时间曲线法研究了修饰电极对H2O2、BHP、CHP的电化学性能。结果表明该修饰电极对以上三种过氧化物表现出良好的催化检测性能和高灵敏度。

