SM-PCR技术检测血浆ctDNA在晚期肺腺癌患者治疗中的应用
左冉 苏雨栋 孟昭婷 王心悦 林丽 张翠翠 陈金良 王雅杰 刘萍萍 于津浦 李凯陈鹏
肺癌发病率和死亡率均占所有恶性肿瘤的第一位,其中约80%为非小细胞肺癌(non-small cell lung cancer,NSCLC),确诊时80%以上为中晚期肺癌,其5年生存率仅为19.8%[1-2]。表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKIs)是具有敏感突变的晚期NSCLC 患者的标准治疗方法,可显著延长患者的无进展生存时间(progress free survival,PFS)和总生存期(overall survival,OS)[3]。在亚裔非吸烟的女性患者中,EGFR突变比例可高达60%~70%,明确EGFR 基因状态对指导后续靶向用药治疗至关重要[4]。一直以来,传统分子诊断需要基于组织标本,血浆循环肿瘤DNA(circulating tumor DNA,ctDNA)基因突变检测可克服组织检测的异质性,患者无创伤,操作方便快捷,并可反复获取,易于实时监控,是无法获得组织活检样本晚期患者的选择之一,但ctDNA在血液中含量极微,需要技术的不断改良才能提高检测的灵敏度[5]。单分子PCR(single molecule-PCR,SMPCR)技术能实现对DNA片段的单基因突变检测,具有超高灵敏度和特异度[6]。本研究旨在探讨SMPCR 技术检测血浆ctDNA 在晚期肺腺癌患者治疗中的应用。
1 材料与方法
1.1 病例资料
分析2017年6月至2018年5月就诊于天津医科大学肿瘤医院晚期肺腺癌患者30 例,其中初治患者27例(90%),复治患者3例(10%),男性14例(47%),女性16 例(53%);年龄33~68 岁,中位年龄54 岁。ⅢB 期6 例(20%),Ⅳ期24 例(80%)。肿瘤组织穿刺活检样本30 例,应用扩增阻滞突变系统(amplication refractory mutation system,ARMS)实时荧光PCR 法进行组织样本EGFR 突变检测,静脉血样本30 例,SMPCR反向扩增ctDNA样本,对扩增产物进行高通量测序。两种样本均在同一时期获取,且静脉血样本在患者进行治疗前获取。根据2015年世界卫生组织(WHO)的病理学标准,30 例患者均被诊断为肺腺癌。根据国际肺癌研究协会(第8 版)TNM 分期系统进行临床分期。本研究为一项随机、开放、单中心的前瞻性临床研究。入组标准:1)受试者自愿参加本研究,并签署知情同意书,依从性好,配合随访;2)年龄≥18 岁且≤70 岁的男性或女性患者;3)组织学证实的肺腺癌;4)临床TNM分期为Ⅲ期和Ⅳ期;5)预计生存时间≥12 周;6)ECOG 评分:0~2 分。排除标准:经研究者判断,受试者有可能导致本研究被迫中止的因素。本研究由天津医科大学肿瘤医院伦理委员会批准(批件号:E2016182),所有患者均签署书面知情同意书,用于标本采集,临床信息提供和生物标志物分析。
1.2 方法
1.2.1 样本 使用基于SM-PCR 技术的肿瘤基因突变检测试剂盒(购自北京贝瑞和康生物技术有限公司)富集血液样本目标基因(EGFR、KRAS、BRAF、ALK、HER2、TP53)区域的ctDNA 片段,构建测序文库。使用NextSeq CN500 基因测序仪(购自北京贝瑞和康生物技术有限公司;国械注准20153400460)对上述6个基因的全部外显子进行高通量测序,全面检测突变信息。同时使用基于ARMS 实时荧光PCR 法的EGFR基因突变检测试剂盒(购自厦门艾德生物医药科技有限公司)进行肿瘤组织样本EGFR 检测,组织穿刺活检样本均为福尔马林固定石蜡包埋(formalin fixed and paraffin embedded,FFPE)样本。
1.2.2 样本量计算 通过样本量计算软件(PASS 15.0.5)中“Tests For One Roc Curve”模块进行计算,根据既往信息得知,ARMS-PCR技术的AUC值为0.7,SM-PCR技术的AUC值为0.9,取Beta=0.1,Alpha=0.05,两组例数相等,双侧检验。计算结果提示每组需要30例样本。
1.2.3 收集与随访 患者临床资料信息均通过查阅天津医科大学肿瘤医院病历获取。采用病历回顾、电话询问、面访方式对患者进行随访,随访日期截至2018年12月20日,随访时间6~18个月,中位随访时间为12个月,随访率100%。
1.3 统计学分析
采用SPSS 23.0软件进行统计学分析。血浆与组织样本基因突变检测结果比较采用Kappa 一致性检验和McNemar检验,血浆EGFR突变状况与临床病理特征的关系分析采用Fisher's 精确检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 血浆与组织EGFR突变检测结果一致性比较
对30例ⅢB、Ⅳ期肺腺癌患者的组织与血液基因检测进行分析,一致性93.3%(28/30),灵敏度86.70%(13/15),特异性100%(15/15),阳性预测值100%(13/13),阴性预测值88.2%(15/17);Kappa一致性检验说明两种方法检测结果一致性较好(Kappa=0.867,P<0.001);McNemar检验亦提示检测结果差异无统计学意义(P=0.500)。血浆与组织EGFR突变检测结果一致性比较,见表1。

表1 血浆与组织EGFR基因突变状态比较 (n=30)
2.2 血浆与组织EGFR突变检测位点结果比较
对15例组织EGFR突变检测阳性和13例血浆EGFR突变检测阳性的检测位点结果进行比较,基于SM-PCR技术的ctDNA检测不仅可以分析ARMS-PCR可检测的位点,还可分析第3代EGFR-TKI常见的耐药突变C797S,并且可以分析T790M和C797S的顺反式结果,评估患者是否适合第1代TKI联合第3代TKI治疗。血浆与组织EGFR突变检测位点结果比较,见表2。
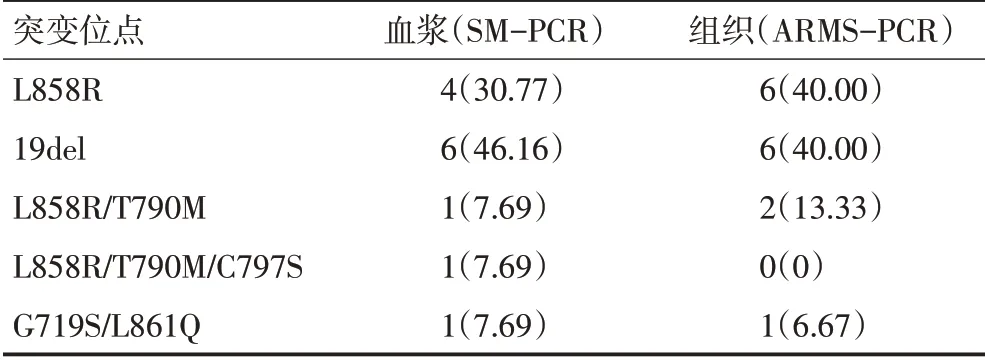
表2 血浆与组织EGFR突变检测位点结果比较 n(%)
2.3 血浆EGFR突变状况与临床病理特征的关系
30 例患者中EGFR 突变状况,与年龄、肿瘤家族史、体力状态评分及疾病分期无显著相关性,与性别(P=0.033)、吸烟史(P=0.001)呈显著相关。血浆EGFR突变状况与临床病理特征的关系,见表3。

表3 血浆EGFR突变状态与临床病理特征的关系 (n=30)
3 讨论
临床上部分肿瘤患者无法进行组织活检[7],同时肿瘤普遍存在异质性[8],同一病灶内的不同细胞间存在差异,原发灶与转移灶之间存在差异,不同转移灶之间也可能存在差异,上述均对以肿瘤组织为检验样本的检测方法提出挑战。肿瘤患者体内存在低丰度、高度片段化、半衰期短、来自于坏死及凋亡肿瘤细胞和外泌体的ctDNA,ctDNA中的特异性序列与组织样本来源的肿瘤特异性序列保持高度一致性,可部分代替组织标本进行基因突变检测[9],尽管如此,血浆和组织样本之间存在检测的不一致性,仍是将液体活检引入临床实践的重要障碍。Mao 等[10]汇总了不同技术对血浆和组织EGFR 突变进行检测的灵敏度、特异性和一致性,分别为61%、90%和79%,采用通用PCR扩增测序和目标区域捕获文库构建技术应用于血浆DNA 单基因突变检测时,会存在假阳性率高、灵敏度低和偏好严重等问题[11]。而SM-PCR技术能将目标区域DNA悉数捕获、富集,再通过高通量测序,可以准确识别点突变、插入突变、缺失突变和融合突变,实现对突变区域单分子的定性和绝对定量,具有超高灵敏度和特异度[12]。SM-PCR技术已成功应用于无创产前单基因病的检测中[13],且广泛用于多种实体瘤的基因检测[14-15]。本研究表明在晚期肺腺癌中,SM-PCR 技术对血浆EGFR 突变的检测结果与组织检测结果比较具有较好的一致性,总符合率达到93.30%,提示SM-PCR 技术可以用于检测血浆EGFR突变。
本研究结果显示,血浆EGFR 突变状态与性别、吸烟史呈显著性相关,女性不吸烟患者的血浆EGFR突变发生率较高,与检测组织EGFR敏感突变优势人群相一致。本研究发现,当组织活检标本呈EGFRL858R突变阳性时,有2例在匹配血浆样本中未检测到相应的突变,可能是由于肿瘤负荷低、血管分布不良或患者机体免疫力差难以杀伤肿瘤细胞,从而不能产生ctDNA,导致ctDNA在血浆内不易检出[16],2例患者分别接受阿法替尼和埃克替尼治疗,PFS分别为14 个月和16 个月。亦有2 例低丰度(<0.1%)突变患者分别接受奥希替尼和埃克替尼治疗,截止目前PFS均超过10 个月,相反有2 例高丰度(>20%)突变患者接受埃克替尼治疗,PFS 仅分别为3 个月和5 个月。EGFR-19del 突变的组织和血液检测结果完全一致,且有1例患者为G719X和L861Q同时突变,血检和组织检测相一致。有研究报道,当血检阳性时亦会出现组织检测阴性的情况,主要涉及的突变为T790M,可能由于检测技术的灵敏度较低或肿瘤的异质性所致[17],基于SM-PCR技术的ctDNA检测具有较高的灵敏度,有助于克服异质性,能对组织检测结果进行有效的补充。
本研究血液ctDNA 共检出4 种低丰度(<1%)鼠类肉瘤病毒癌基因(KRAS)突变变体,分别为G12V、G12C、G13D和Q61H,有研究在健康对照人群中进行血浆检测,亦报道了低丰度的T790M[18]和KRASG12X突变[19]。肿瘤患者检出的低丰度血浆突变可能源自肿瘤组织,但不可排除体细胞来源,进一步行组织活检标本验证可帮助鉴别。低丰度的EGFRL858R 和EGFR-19del 尚未在健康人群中报道,即使血浆检测到低丰度突变亦要诊断阳性。此外,在2个血浆样本中,SM-PCR技术检测到EGFR突变(L858R或19del)和耐药突变T790M 同时存在并测定其相对丰度,可精确定量监测EGFR-TKIs 治疗后血浆ctDNA 敏感突变和耐药突变丰度的细微变化,通过进行血浆ctDNA 前瞻性的动态检测,可更好地预测EGFR-TKIs 何时开始耐药;2 例患者之前均接受过EGFR-TKI治疗,且血检与组织检测结果相一致。
EGFR-C797S已经明确为第3代EGFR-TKI的耐药突变位点,研究发现如果EGFR-T790M 和C797S为反式突变,则对第1 代和第3 代EGFR-TKI 联合用药敏感,如果为顺式突变则对所有EGFR-TKI 耐药[20]。SM-PCR 技术的血液ctDNA 检测包括敏感突变(L858R、19del)和耐药突变(T790M、C797S),同时可分析T790M 和C797S 顺反式情况,并且包含G719X、S768I 和L861Q 等EGFR 罕见突变。对本研究SM-PCR技术检测结果进一步分析,发现1例患者T790M 和C797S 是顺式突变,表明不适合第1 代TKI联合第3 代TKI 治疗。因此,SM-PCR 技术的血液ctDNA 检测既适用于初治的NSCLC 患者,也适用于第1代及第3代TKI耐药的患者。
本研究观察到1 例患者血浆棘皮动物微管相关蛋白4-间变淋巴瘤激酶(echinoderm microtubule associated protein-like 4 and anaplastic lymphoma kinase,EML4-ALK)基因融合阳性,亚型为变体3(E6;A20),经验证ALK D5F3 IHC Ventana 阳性。迄今为止,已发现至少15种不同的EML4-ALK融合变体,变体3为最常见的亚型,提示变体3在耐药后更容易出现ALK耐药突变,尤其是ALK-G1202R突变,还发现变体3 患者接受第3 代ALK 抑制剂劳拉替尼的疗效劣于变体1 患者,但目前样本量较小,期待后续的研究数据进一步证实[21]。SM-PCR 技术通过融合变体分析,从而明确ALK基因融合阳性患者的变体亚型,有助于指导患者后续的治疗选择。
综上所述,SM-PCR 技术不仅可用于血浆ctDNA,也可用于肿瘤组织样本。其可控制测序文库质量,与第2 代测序结合可有助于全面检测突变信息[22],在产前检测、肿瘤早期诊断、个体化用药和预后监测等一系列个体化诊疗的临床领域均表现出广阔的应用前景。在晚期肺腺癌中,基于SM-PCR技术的血浆ctDNA 检测EGFR 突变与组织样本的ARMSPCR检测结果的一致性较高,与其他实体瘤研究数据相一致,其目标检测位点比ARMS-PCR 技术的检测位点全面(特别是耐药位点),同时检测多种突变,且分析结果更精细,可实现绝对定量。本研究仅对血浆ctDNA进行了定性及定量分析,基于SM-PCR技术的血浆ctDNA 的动态检测将会对本研究的结果进一步补充支持。

