门脉高压脾机能亢进对根治性治疗肝癌患者预后的影响*
娄诚 杨倩玉 白同 王毅军 高英堂 杜智
近年来,关于门静脉高压脾机能亢进对肝癌发生和预后的影响受到广泛关注。目前研究认为,在门脉高压基础上,脾脏随着纤维化的不断进展逐渐失去正常免疫功能,出现脾大、脾亢,成为“病理脾”。这种病理脾对肝癌免疫起负性调节作用,影响肝癌的发生和预后[1-2]。有学者主张,对合并门脉高压的肝癌患者,在肝癌治疗同时切除脾脏,改善预后[3-4]。但是目前,病理尚缺乏免疫相关界定标准,何种情况可以考虑切脾,切脾是否能够改善肝癌患者长期生存,这些问题临床上仍存较大争议。本研究通过回顾性研究探讨不同程度门脉高压脾机能亢进与脾切除对肝癌患者预后的影响,为上述问题的解答寻求临床依据。
1 材料与方法
1.1 临床资料
回顾性分析天津市第三中心医院自2008年1月至2018年1月间收治的符合米兰标准[5]并实施根治性治疗的原发性肝癌患者临床资料。纳入标准:1)年龄18~75岁;2)影像学、肿瘤标志物和术后病理诊断符合肝细胞肝癌;3)符合肝癌米兰标准;4)合并不同程度门静脉高压、脾大、脾亢;5)施行手术或热消融治疗实现肿瘤根治。排除标准:1)根治性治疗前接受过介入等其他治疗的患者;2)合并肝脏以外其他器官、系统严重疾病;3)合并其他恶性肿瘤;4)术后3个月内死亡;5)失访或病历资料不全。根据以上标准纳入肝癌患者403例,其中340例仅行肝癌根治性治疗,63例合并严重脾亢的肝癌患者,结合肿瘤部位、既往是否存在食管-胃底静脉曲张破裂出血史、根治术出血风险和患者意愿等,在肝癌治疗同时行脾切除术。收集所有患者临床资料,包括性别、年龄、病因(乙肝、丙肝、酒精肝、其他)、Child-Pugh 分级、白蛋白(albumin,ALB)、总胆红素(total bilirubin,TBIL)、谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate transaminase,AST)、凝血酶原时间(prothrombin time,PT)、甲胎蛋白(alpha fetoprotein,AFP)、白细胞、血小板(platelet,PLT)、肿瘤TNM分级(肿瘤数目、大小)、脾脏长径、治疗方法等,利用上述指标分别计算每例患者ALBI[log TBIL(μmol/L)×0.66]+[ALB(g/L)×(-0.085)]、APRI[AST(ULN)×100/PLT(109/L)]以及血小板/脾长径比值(PSR)[PLT(109/L]/脾长径(cm))等临床参数。本研究通过天津市第三中心医院伦理委员会批准,所有患者均签署知情同意书。
1.2 方法
1.2.1 治疗方法 根治性治疗包括手术治疗和热消融治疗两种方式。手术方式包括开放或腹腔镜,所有手术均为根治性切除,至少保留0.5 cm 安全切缘,术后病理切缘阴性。热消融治疗根据肿瘤部位不同采取经皮、开腹或腹腔镜辅助等方法,消融范围至少超出肿瘤边界0.5 cm,消融后即时超声造影证实消融完全。所有患者术后2个月强化CT、AFP检查确定根治性治疗。同时行脾切除的肝癌患者均合并严重脾机能亢进,脾切除标准为脾大超过肋下2 cm,PLT 低于50×109/L,白细胞低于3.0×109/L,该组患者均采用开腹手术,先期切除脾脏,随后进行肝癌切除或术中热消融治疗,如既往有上消化道出血史则同时行贲门周围血管离断术。对于合并严重脾机能亢进患者(PLT<50×109/L),在手术或热消融治疗前1h 输注PLT 16~32 IU。
1.2.2 分组 依据PLT 水平区分门脉高压脾机能亢进程度,分为4级:严重脾亢(PLT≤50×109/L),中度脾亢(50×109/L<PLT≤100×109/L),轻度脾亢(100×109/L<PLT≤150×109/L)和无脾亢(PLT>150×109/L)。根据切脾与否,将合并严重脾亢肝癌患者分为仅行肝癌根治未切脾组与联合脾切除肝癌根治组。
1.2.3 随访情况 所有患者常规随访。5年内每3个月随访1 次,随后每6 个月随访1 次。复发标准以影像学确定性发现为准,如超声造影、强化CT、强化MRI、肝动脉造影等,单纯AFP 升高不作为复发标准。截至2018年1月,记录所有患者无瘤生存期(disease free survival,DFS)和总生存期(overall survival,OS)。
1.3 统计学分析
采用SPSS 25.0 软件进行统计学分析。采用Cox比例风险回归模型对仅行肝癌根治治疗患者行单因素和多因素预后因素分析。计量资料比较采用t检验或单因素方差分析,计数资料比较采用χ2检验或秩和检验。以死亡或复发为终点,采用Kaplan-Meier生存分析比较单纯肝癌根治未切脾组与联合脾切除肝癌根治组间的DFS 和OS,用Log-rank 检验比较两组生存曲线,P<0.05为差异具有统计学意义。
2 结果
2.1 一般资料
340例仅行肝癌根治治疗患者临床资料显示,男女比例3:1。根据肝癌AJCC 第八版TNM 分期,将符合米兰标准肝癌分为ⅠA期、ⅠB期和Ⅱ期。根据文献[6],将ALBI 分为<-2.6,-2.6~-1.39 和>-1.39 三个级别(表1)。所有患者随访至2018年1月,中位随访时间49.73(6.1~120)个月。
2.2 影响肝癌患者DFS 的Cox 单因素和多因素风险回归分析
Cox 单因素风险回归分析显示PLT、Child-Pugh分级和ALBI分级是肝癌合并门脉高压患者DFS的危险因素。进一步Cox 多因素风险回归分析显示PLT、Child-pugh 分级和PSR 是这类患者DFS 的独立危险因素(表2)。

表1 合并不同程度门脉高压肝癌患者临床资料

表2 肝癌合并不同程度门脉高压脾亢患者Cox比例风险回归分析

表2 肝癌合并不同程度门脉高压脾亢患者Cox比例风险回归分析(续表2)
2.3 影响肝癌患者OS的Cox单因素和多因素风险回归分析
Cox 单因素风险回归分析显示病因、PLT、ALT、Child-pugh 分级、ALBI 分级、APRI、PSR、TNM 分期和根治方式等是肝癌合并门脉高压患者OS 的危险因素。进一步Cox多因素风险回归分析显示PLT、ALBI分级、PSR、TNM分期和根治方式是这类患者OS的独立危险因素(表2)。以不同PLT 水平分组的多因素OS 生存曲线显示,随PLT 水平下降,患者OS 显著下降,各组间均具有显著性差异(图1)。
2.4 联合脾切除肝癌根治组与仅行肝癌根治未切脾组间临床资料比较
两组间年龄、性别比、病因类型、肝功能分级、ALBI、肿瘤分期等均无显著差异。与门脉高压相关的白细胞、PLT、脾脏长径、PSR、APRI 等指标也无显著差异。仅在AFP 和根治方式中存在差异(表3)。生存分析显示,在OS比较中,联合脾切除组与仅行肝癌根治组1、3、5年生存率分别为100%、98.2%、68.5%和97.1%、79.4%、56.8%,联合脾切除组肝癌患者具有更长的OS(P<0.05,图2)。在两组DFS比较中未发现显著性差异,联合脾切除组1、3、5年DFS 分别为90.5%、45.9%、28.2%,仅行肝癌根治组分别为85.7%、52.6%和24.8%(P>0.05,图3)。
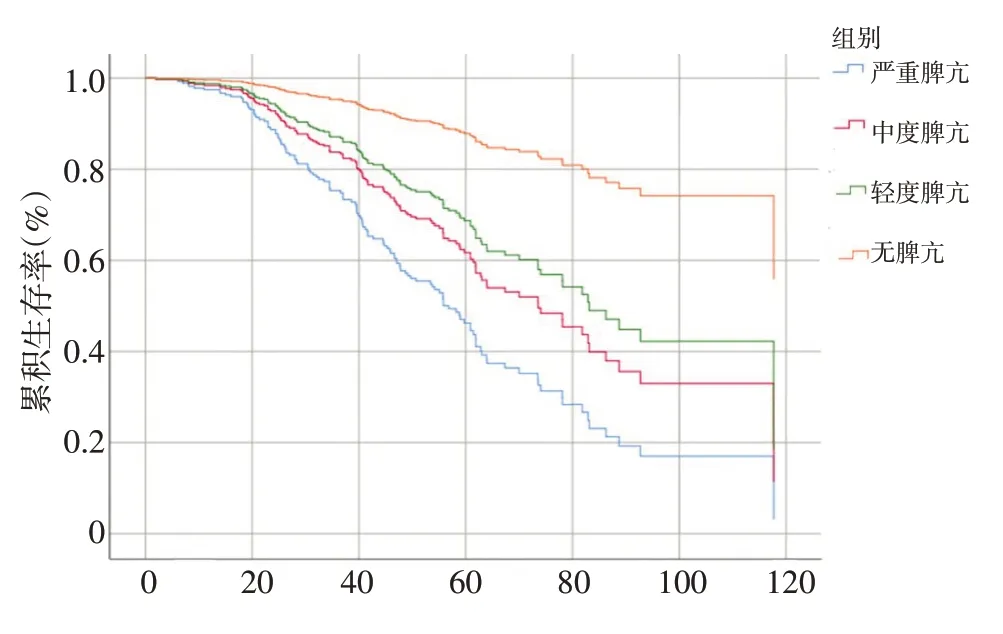
图1 合并不同程度脾亢肝癌患者Cox多因素分析OS结果

表3 合并严重脾亢患者中仅行肝癌根治组与肝癌根治联合脾切除组临床资料比较

图2 合并严重脾亢肝癌根治联合脾切除与未切脾组间OS比较

图3 合并严重脾亢肝癌根治联合脾切除与未切脾组间DFS比较
3 讨论
门脉高压、脾大脾亢是肝癌患者预后不良的重要因素。一方面,门脉高压、脾大、脾亢提示肝硬化肝功能受损,限制了肝癌的治疗选择,增加食管胃底静脉曲张破裂出血、肝衰竭等事件的风险[7];另一方面,脾脏随着门脉高压进展,纤维化程度逐渐加重,其正常抗肿瘤免疫逐渐消失,代之以促进肿瘤发生、发展的负性免疫调节,脾脏这种抗肿瘤免疫的双向性已得到众多研究的证实[1-2,8]。但相关机制研究进展缓慢,目前尚缺乏任何免疫学指标可供临床病理脾功能的评价[9]。此外,由于门脉高压确切病生理过程仍不清楚,门脉高压症候群在不同患者间临床表现差异巨大,因此目前单纯依据脾大、脾亢标准评估判断病理脾已不能满足临床需要。多参数、多侧面的综合评价是一个可能的解决方案。
ALBI 是2015年发现的一个评估肝癌患者肝功能的新方法,相比Child-Pugh、ICG15,该方法只用ALB、TBIL 两个客观指标,简单而且客观[6]。与Child-pugh 相比,ALBI 具有更好的肝切除术后肝衰竭预测价值[10],而且,ALBI与TNM、JIS、BCLA等肝癌分期结合,较日本肝损伤分级、Child-Pugh 分级具有更好的肝癌预后评估价值[11-13]。APRI 是Wai 等[14]于2003年提出的肝纤维化无创诊断模型,其预测肝纤维化(F0-2)和肝硬化(F5-6)(Ishak 病理分期)的AUC 分别是0.89 和0.94。该模型仅有AST 与PLT 两个指标,临床应用简单。该模型还可有效预测食管静脉曲张的存在,其高值提示重度静脉曲张,显示其对门脉高压程度的评估价值[13]。此外,PSR也是一个良好的判断食管静脉曲张存在与否的无创预测指标,具有门静脉高压严重度的评估价值[14]。
本研究分析临床资料并计算获得上述参数进行肝癌预后单因素、多因素风险回归分析。结果显示,无论单因素还是多因素分析,PLT水平均是肝癌患者DFS和OS的独立危险因素。以不同PLT水平分组的多因素OS 生存曲线表明,随着门脉高压脾亢加重,PLT水平下降,患者OS显著下降,提示PLT水平与病理脾严重度的高度相关性。PSR也是OS的独立危险因素,多因素分析与DFS 同样具有相关性,提示脾长径与PLT 水平协同后较好的肝癌预后评估价值。此外,APRI也是肝癌OS单因素分析的危险因子。ALBI作为最新肝功能评估手段,在本研究中也显示了重要价值,其与肝癌OS、DFS 均具有高度相关性,优于Child-Pugh 分级。上述指标包括血小板、APRI、PSR均是门脉高压脾亢的重要临床参数,ALBI 作为肝功能指标也间接反映门脉高压状态,这些指标均与肝癌预后高度相关,又各具特点,每一指标均反映肝硬化门脉高压脾亢的不同侧面,未来期望将这些指标进一步整合,实现更加准确、可靠的的病理脾严重度评估,以满足临床需要。
在现有文献中,脾切除对肝癌预后的影响仍有争议。Chen 等[4]研究发现,脾切除可延长肝癌患者DFS(5年DFS,37%vs.27.3%,P=0.003),但并不延长OS(5年OS,56%vs.50.9%,P=0.175)。Zhang 等[17]在先期病例对照研究中也得出了相似的结论,随着进一步病例积累,随访期延长,在随后研究中发现,脾切除对肝癌患者的DFS(1,3,5,7,9年DFS:89.0%,65.5%,54.9%,54.9%,54.9%vs.71.9%,50.6%,40.6%,27.0%,21.6%,P=0.004)和OS(1,3,5,7,9年OS:98.1%,83.6%,69.2%,57.3%,57.3%vs.93.5%,75.7%,56.3%,40.0%,27.8%,P=0.025)均有明显改善[18]。Li等[19]分层研究发现,肝癌根治同时的脾切除可改善TNM Ⅰ期患者的DFS(中位DFS,62.1个月vs.24.1 个月;P=0.034),延长TNMIⅡ期患者的OS(中位OS,79.1 个月vs.23.3 个月,P=0.018)。本研究证实,对于合并门脉高压严重脾亢的肝癌患者,脾切除可延长肝癌根治患者的OS,但对此类患者的DFS 无影响。这一结果与徐教邦等[20]的研究结果相一致。根据现有研究,严重脾亢患者脾切除可以明显改善肝功能[21],而肝功能是肝癌预后的独立危险因素[22],因此这类患者脾切除完全有可能延长肝癌患者的OS。而DFS除肿瘤和肝脏因素外,还受根治方法等因素影响。有文献报道小肝癌消融和手术的主要预后差异就是DFS[23],其次切脾对肝功能的改善需要一段时间,因此其对不同时间发生的肿瘤复发影响不同,本研究未区分近远期复发,因此尚不能确定切脾与DFS的相关性。回顾上述不同研究发现,一些研究采用PLT<100×109/L 或80×109/L 为脾亢脾切除标准[17,19],这是导致各研究结果不同的可能原因。本研究以PLT<50×109/L 为脾切除适应证,脾亢程度更重,切脾对肝癌远期预后的改善也必将更加显著。
本研究仍存在一些不足:1)仅为回顾性研究,需进一步前瞻性研究证实。2)本研究根治性治疗采用手术和热消融两种方式。目前,对<3 cm 肝癌,两种方法疗效无差异,本研究应用米兰标准,对>3 cm 肝癌患者施行热消融,是否能达到根治效果尚有争议。3)由于病例数不足,切脾与脾亢两组患者仍存在AFP、根治方式等方面的差异,需进一步大样本消除干扰因素。
综上所述,PLT、PSR、APRI、ALBI 等临床参数是合并门脉高压脾机能亢进肝癌患者重要的预后影响因素。对于合并严重脾机能亢进符合米兰标准的肝癌患者,在肝癌根治同时联合脾切除可提高肝癌患者OS。

