PPARγ配体激动剂罗格列酮对甲状腺乳头状癌BCPAP细胞增殖、凋亡的影响及机制
赵永魁,王晓涛,陈建立,王长友,张国志
(华北理工大学附属医院,河北唐山063000)
甲状腺乳头状癌(PTC)是一种常见的甲状腺恶性肿瘤,其分化程度高、预后较好。然而,部分患者易早期发生颈部淋巴结转移,是其复发和死亡的主要原因[1,2]。临床上,对于PTC的治疗首选手术切除并辅以术后131I治疗,但常发生肝肾功能损伤等不良反应[3]。PPARγ配体激动剂罗格列酮(ROZ)是治疗2型糖尿病的一线口服药物,具有肾脏保护作用。随着肿瘤治疗研究的不断深入,许多证据表明ROZ对多种癌症具有抑制作用,可降低患者的发病率和病死率,但具体作用机制尚不明确[4,5]。2017年10月~2018年5月,我们观察了ROZ对人PTC细胞BCPAP增殖、凋亡的影响,并探讨其可能的机制,以期为ROZ辅助治疗PTC提供理论依据。
1 材料与方法
1.1 主要材料 BCPAP细胞(中国科学院干细胞库),DMEM培养基、胎牛血清(FBS)、胰酶(美国Gibco公司);AnnexinV-FITC/PI染料试剂盒、噻唑蓝(MTT,美国Sigma公司);线粒体凋亡途径相关蛋白(Bcl-2、Bax)、第10号染色体缺失的磷酸酶和张力蛋白同源基因(PTEN)、蛋白激酶B(AKT)、磷酸化蛋白激酶B(p-AKT)、β-actin抗体(美国CST公司),HR标记山羊抗兔IgG二抗、DAB显影液(上海碧云天生物技术研究所);ROZ、BCA蛋白浓度测定试剂盒、RIPA裂解液、PMSF、SDS-PAGE凝胶配制试剂盒(北京索莱宝科技有限公司);PTEN特异性抑制剂bpV(phen)购自美国Abcam公司;酶标仪、湿转系统(上海Bio-Rad公司),流式细胞仪(美国BD公司)。其余材料及仪器由华北理工大学医学实验中心提供。
1.2 实验方法
1.2.1 细胞培养 将BCPAP细胞接种于含10% FBS和1%双抗的DMEM培养基,在5% CO2、37 ℃、饱和湿度条件的孵育箱中培养。
1.2.2 细胞增殖情况观察 采用MTT法。取生长状态良好的BCPAP细胞,按1×104/孔接种96孔板。将细胞分别置于ROZ终浓度为0、20、40 μmol/L的完全培养基中,各浓度设3个复孔;分别于培养24、48、72 h时,各孔加入5 mg/mL MTT溶液10 μL,于培养箱中反应4 h;弃培养基,每孔加入DMSO 100 μL,继续于37 ℃恒温箱中反应15 min。用酶标仪在波长570 nm处测定各孔光密度值(OD值),OD值越大增殖能力越强。
1.2.3 细胞凋亡情况观察 采用流式细胞术。取生长状态良好的BCPAP细胞,调整细胞密度为1×106/mL,以2×106/孔接种于6孔板并分为4组。A组不处理,B组加入终浓度为40 μmol/L的ROZ处理,C组加入终浓度为1 μmol/mL PTEN特异性抑制剂bpV(phen)处理,D组先加入终浓度为1 μmol/mL bpV(phen)处理12 h后再加入终浓度为40 μmol/L的ROZ处理。各组处理48 h后,将细胞制备成悬液放入1.5 mL离心管中,冰PBS洗涤细胞2次;加入500 μL Binding Buffer,混匀后避光;各离心管内分别加入5 μL Annexin V-FITC,和5 μL Pronpidium Iodide,避光孵育15 min。1 h内上机检测,以右上象限和右下象限凋亡率之和视为细胞凋亡率。
1.2.4 线粒体凋亡途径相关蛋白及PTEN/AKT通路蛋白检测 采用Western blotting法。取生长状态良好的BCPAP细胞,按1.2.3进行分组处理。各组处理48 h后以RIPA裂解液裂解,离心收集蛋白。BCA法定量总蛋白,SDS-PAGE蛋白电泳,转膜(90 V,90 min),10%脱脂奶封闭;一抗孵育过夜(1∶1 000) ,二抗(1∶1 000)37 ℃恒温箱孵育2 h;上机荧光显色,Image J软件分析灰度值,以目的蛋白与内参蛋白灰度值比值作为目的蛋白相对表达量。

2 结果
2.1 ROZ对BCPAP细胞增殖能力的影响 随着ROZ浓度增加和作用时间的延长,BCPAP细胞增殖的OD值逐渐降低(P均<0.01)。见表1。
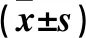
表1 ROZ对BCPAP细胞增殖能力的影响
注:与上一浓度或前一作用时间比较,*P<0.01。
2.2 ROZ对BCPAP细胞凋亡的影响 A、B、C、D组细胞凋亡率分别为7.252%±0.103%、15.076%±0.288%、7.556%±0.448%、7.764%±0.241%,B组细胞凋亡率高于A、C、D组(P均<0.01),A、C、D组间细胞凋亡率差异均无统计学意义(P均>0.05)。见图1。

图1 各组细胞凋亡率比较(AnnexinV-FITC/PI染色)
2.3 ROZ对BCPAP细胞线粒体凋亡途径相关蛋白、PTEN/AKT通路蛋白表达的影响 与A、C、D组比较,B组细胞Bax、PTEN蛋白表达增加,而Bcl-2、p-AKT蛋白表达减少(P均<0.01),A、C、D组间细胞Bcl-2、Bax、PTEN、p-AKT、AKT表达差异均无统计学意义(P均>0.05)。见表2和图2、3。
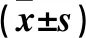
表2 各组细胞Bcl-2、Bax、PTEN、p-AKT、AKT蛋白表达比较
注:与B组比较,*P<0.01。

图2 各组细胞Bcl 2、Bax蛋白表达情况(Western blotting法)

图3 各组细胞PTEN、p-AKT和AKT蛋白表达情况(Western blotting法)
3 讨论
甲状腺癌是一种常见的头颈部恶性肿瘤,近年来其发病率增长迅速。总体而言,大多数甲状腺肿瘤起源于甲状腺滤泡细胞或滤泡旁细胞[6]。在甲状腺癌的多种病理类型中,PTC是临床上常见的分化类型,占所有甲状腺恶性肿瘤的86%[7]。肿瘤根治术是目前治疗甲状腺癌的首选方式[8],且绝大多数患者术后辅以同步131I放疗后有着很好的总体生存率和治疗结局,但肝肾功能损伤等不良反应是导致131I治疗终止的常见原因之一[9,10]。
无限增殖和抗凋亡能力会加速肿瘤的恶化与不良结局,也是肿瘤发生、发展的重要原因[11]。因此,诱导细胞凋亡是目前化疗药物或协同化疗药物的常见靶点。Bcl-2和Bax蛋白是Bcl家族中一对重要的正负调控因子,在细胞程序性凋亡的多条途径中起着至关重要的作用[12]。Bcl-2和Bax是线粒体凋亡途径上的一对关键拮抗基因,Bcl-2/Bax相对表达比例的改变可以直接导致包括线粒体、内质网等在内的细胞器和关键蛋白发生改变,诱导细胞凋亡的发生[13,14]。同时,作为上游调控蛋白,Bcl-2也可以通过抑制Caspase蛋白家族的活化,阻止细胞凋亡蛋白酶级联反应,从而调控细胞的凋亡进程[15]。
PTEN是一种具有双重特异性磷酸酶的抑癌基因,它具有多种生物活性,并作用于多条信号通路来调节细胞的增殖、凋亡、迁移、黏附和血管生成,已被证实是抑制肿瘤生长的关键基因[16, 17]。PTEN可以通过负性调节PI3K/AKT信号通路,减弱来自于上游信号传导通路的信号强度,从而达到促进细胞凋亡、抑制细胞增殖的作用[18]。研究表明,PI3K/AKT信号通路的抑制可以下调Bcl-2/Bax表达比例,诱导细胞发生凋亡[15]。在恶性黑色素瘤细胞模型中特异性上调PTEN蛋白表达,已被证实可以通过这一途径诱导细胞发生凋亡[19]。
在治疗糖尿病的应用过程中,PPARγ配体激动剂显示了较好的肾脏保护作用[20]。此外,近年来的研究表明,PPARγ被其特异性配体激活后,能够有效诱导肿瘤细胞分化、抑制其增殖[21,22]。在我们的前期研究中,也初步证实了PPARγ配体激动剂ROZ可以通过诱导结肠癌细胞的凋亡来调抑制结肠癌细胞的增殖,但具体机制尚未完全阐明[23]。本研究中,我们首先利用MTT法证实了ROZ对PTC细胞增殖的抑制作用具有浓度和时间依赖性。通过流式细胞仪和Western blotting法验证了ROZ对PTC细胞增殖的抑制作用可能是通过改变Bcl-2/Bax相对表达比例,从而诱导细胞发生凋亡。bpV(phen)是PTEN选择性抑制剂[24],在分别采用ROZ和bpV(phen)处理PTC细胞后发现,ROZ可以上调PTEN蛋白表达,进而抑制AKT信号通路的激活,诱导细胞发生凋亡;同时,bpV(phen)可以逆转这种变化。这说明ROZ可能是通过PTEN/AKT通路来抑制肿瘤细胞增殖并诱导细胞凋亡。当然,PPARγ配体激动剂的调节涉及很多方面,本研究只是其中一个方面。除了抑制肿瘤细胞增殖、诱导凋亡以外,还可能涉及其他相关信号通路及分子靶点,PTEN/AKT通路可能并不是PPARγ配体激动剂抑制肿瘤细胞的惟一信号通路,具体机制尚需进行后续研究。

