高效液相色谱法测定猕猴桃酒中4 种有机酸含量
倪慧,李华佳,李可,尚雪娇,朱永清,郭壮,*
(1.湖北文理学院食品科学技术学院鄂西北传统发酵食品研究所,湖北 襄阳 441053;2.四川省农业科学院农产品加工研究所,四川 成都 610066)
猕猴桃又称奇异果,因其口感酸甜,富含丰富的VE、VC、膳食纤维、黄酮和多酚等营养成分[1-2],且具有降血脂[3]和抗氧化[4]功能而深受消费者的喜爱。猕猴桃属于呼吸跃变型水果,采摘后容易软化和腐败变质[5],因而对猕猴桃进行深加工则显得尤为重要。发酵制作猕猴桃酒不仅可以提高猕猴桃的利用率[6-7],而且能更好发挥其特有的保健功效[8],同时提高农产品附加值。作为影响猕猴桃酒风味形成的重要影响因素之一[9],通过测定有机酸种类和含量可间接对猕猴桃酒品质的优劣进行评价。
目前常采用酸碱滴定法[10]、离子色谱法[11]、红外光谱法[12]和色谱法[13]对食品中有机酸的种类和含量进行测定。GB5009.157-2016《食品安全国家标准食品中有机酸的测定》中约束了使用高效液相色谱法(high performance liquid chromatography,HPLC) 测定食品中的有机酸,相较于其他方法,该方法具有准确、方便和快捷等优点。虽然可以参照GB2758-2012《食品安全国家标准发酵酒及其配制酒》采用HPLC 法测定猕猴桃酒中的有机酸,但上述标准对猕猴桃和猕猴桃酒中的特征酸——奎宁酸[14]的检测方法并未加以描述,因此对猕猴桃酒中有机酸的测定方法进行优化则显得尤为重要。
本试验采用HPLC 对猕猴桃酒中奎宁酸、苹果酸、乳酸和柠檬酸的测定方法进行了优化,并对10 个自酿猕猴桃酒中4 种有机酸的含量进行了测定。通过本项目的开展,实现了猕猴桃酒中4 种有机酸的快速检测和定量分析,以期为后续猕猴桃酒的生产工艺改良和相关标准的制定提供参考依据。
1 材料与方法
1.1 材料与仪器
Lactobacillus plantarum(植物乳杆菌):由湖北文理学院鄂西北传统发酵食品菌种资源库提供;猕猴桃酒:湖北文理学院鄂西北传统发酵食品研究所自酿;奎宁酸、苹果酸、乳酸、柠檬酸:均为标准品,默克生命科学(上海)有限公司;磷酸氢二铵、磷酸二氢钾、磷酸:均为分析纯,西陇科学股份有限公司;甲醇、乙腈、异丙醇:均为色谱纯,国药集团化学试剂有限公司;偏重亚硫酸钾、果胶酶(5 万U/g):均为食品级,烟台帝伯仕自酿机有限公司;0.22 μm 一次性针头式过滤器和合成纤维树脂滤膜:上海市新亚净化器件厂。
LC-20ADXR 高效液相色谱仪(配置有LC-20AD XR 四元低压梯度泵、SIL-20A XR 自动进样器、CTO-10AS vp 柱温箱和SPD-M20A 二极管阵列检测器)、InertSustainSwift C18 色谱柱(250 mm×4.6 mm,5 μm):日本岛津公司;5810R 台式高速冷冻离心机:德国Ep-pendorf 公司;PHS-25 型pH 计:上海仪电科学仪器有限公司。
1.2 试验方法
1.2.1 色谱条件的优化
1.2.1.1 有机酸标准溶液配制
准确称取0.600 0 g 奎宁酸、0.600 0 g 苹果酸、3.000 0 g 乳酸和1.200 0 g 柠檬酸标准品,溶解后于50 mL 容量瓶中定容,配制成不同浓度的有机酸母液待用。
1.2.1.2 供试溶液的配制
吸取各有机酸母液0.50 mL 于10 mL 容量瓶中,加入0.20 mL 的0.10 mol/L 磷酸溶液后定容,制成混合有机酸的标准供试溶液,取上清液过0.22 μm 针孔滤膜后直接进样。
1.2.1.3 磷酸盐种类的选择
分别配制溶度为0.08 mol/L 的磷酸氢二铵溶液和磷酸二氢钾流动相,pH 值为2.90,进样量为20 μL,柱温为30 ℃,流速为1.00 mL/min,检测波长为215 nm。
1.2.1.4 磷酸盐浓度的选择
分别配制溶度为 0.01、0.05、0.08 mol/L 的磷酸二氢钾流动相,pH 值为 2.90,进样量为 20 μL,柱温为30 ℃,流速为1.00 mL/min,检测波长为215 nm。
1.2.1.5 pH 值的选择
配制溶度为0.01 mol/L 磷酸二氢钾流动相,调节pH 值分别为 2.90、2.50 和 2.30,进样量为 20 μL,柱温为30 ℃,流速为1.00 mL/min,检测波长为215 nm。
1.2.1.6 有机相的选择
分别设置乙腈和水相的体积比为 0 ∶100、5 ∶95 和10 ∶90,流动相为 0.01 mol/L 磷酸二氢钾溶液,pH 值为2.90,进样量为 20 μL,柱温为 30 ℃,流速为 1.00 mL/min,检测波长为215 nm。
1.2.1.7 流速的选择
分别设置流速为 0.05、0.80、1.00 、1.20 mL/min,流动相为0.01 mol/L 磷酸二氢钾,pH 值为2.90,进样量为20 μL,柱温为30 ℃,检测波长为215 nm。
1.2.1.8 柱温的选择
分别设置柱温为25、30、35 ℃,流动相为0.01 mol/L磷酸二氢钾,pH 值为2.90,进样量为20 μL,流速为1.00 mL/min,检测波长为215 nm。
1.2.2 猕猴桃酒中4 种有机酸的测定
1.2.2.1 猕猴桃酒的制作
称取成熟猕猴桃洗净打浆,添加4 g 的偏重亚硫酸钾和0.06%的果胶酶搅拌均匀后调节糖度为22°Brix,接种60 g 酿酒酵母6 h 后分装并按107CFU/mL 猕猴桃酒添加量分别接入10株植物乳杆菌,于22 ℃发酵7 d,再18 ℃进行后发酵20 d 后待用,其编号为GJ1~GJ10。
1.2.2.2 标准曲线的制备
分别吸取 0.10、0.20、0.50、1.00、2.00 mL 不同母液于10 mL 容量瓶,加0.20 mL 的0.10 mol/L 磷酸溶液后定容,配制出不同梯度标准品溶液,溶液过0.22 μm 的针孔滤膜待用。分别以4 种有机酸的浓度为自变量x,峰面积为因变量y,采用外标法进行计算。
色谱条件:流动相为0.01 mol/L 磷酸二氢钾,pH值为2.90;进样量为20 μL,柱温为30 ℃,流速为1.00 mL/min,检测波长为215 nm。
1.2.2.3 猕猴桃酒中4种有机酸含量的测定
吸取2.0 mL 猕猴桃酒于10 mL 容量瓶中,加入0.20 mL 的 0.10 mol/L 磷酸溶液,用 0.01 mol/L 磷酸二氢钾溶液定容。混合均匀后转移至离心管中10 000 r/min离心15 min,取上清液过0.22 μm 针孔滤膜后直接进样,按照1.2.2.2 的色谱条件进行4 种有机酸含量的测定。
1.2.3 方法性能研究
1.2.3.1 精密性试验
将1.2.1.2 中的供试样品溶液连续进样7 次,分别对柠檬酸、苹果酸、乳酸和奎宁酸的峰面积进行测定,然后计算其相对标准偏差值(relative standard deviation,RSD)。色谱条件同 1.2.2.2。
1.2.3.2 重复性试验
取GJ1 样品2 mL 于10 mL 容量瓶中,并加入0.20 mL 的0.01 mol/L 磷酸溶液,用0.01 mol/L 磷酸二氢钾定容。混合均匀后转移至离心管中10 000 r/min离心15 min,取上清液过0.22 μm 针孔滤膜待用。按照1.2.2.2 的色谱条件对其峰面积进行测定,试验重复操作7 次。
1.2.3.3 加标回收率试验
取1.2.3.2 中滤液4 份,分别编号为GJ11、GJ12、GJ13 和 GJ14,其中 GJ11 不做任何处理,GJ12、GJ13 和GJ14 分别加入不同浓度标准品混合溶液,色谱条件同1.2.2.2。
1.3 统计学分析
使用高效液相色谱工作站自带的LCsolution 软件将色谱图另存为数据矩阵后,使用Origin 8.5 软件(O-riginLab,MA,ΜSA)作图。使用高效液相色谱工作站自带的LCsolution 软件对4 种有机酸进行定性和定量分析。采用保留时间对有机酸种类进行定性,采用外标法对有机酸进行定量。
2 结果与讨论
2.1 色谱条件的优化
2.1.1 磷酸盐的选择
磷酸二氢钾和磷酸氢二铵对4 种有机酸保留时间及分离效果的影响如图1所示。
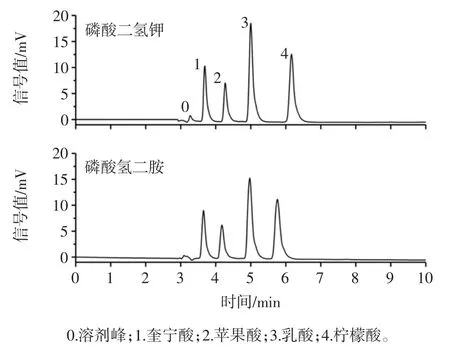
图1 流动相磷酸盐种类对4 种有机酸分离效果的影响Fig.1 Effects of phosphate type of mobile phase on the separation of 4 kinds organic acids
由图1 可知,当选择磷酸盐作为流动相时,4 种有机酸都能得到较好的分离,且当选择磷酸氢二铵时,各有机酸的保留时间相较于磷酸二氢钾小,检测时间更短。但对比两图可知,以磷酸氢二铵作为流动相时,奎宁酸、乳酸和柠檬酸的峰形相较之磷酸二氢钾差,出现拖尾现象。因此,本研究选择使用磷酸二氢钾作为流动相。
2.1.2 流动相中磷酸盐浓度的选择
浓度为 0.01、0.05、0.08 mol/L 磷酸二氢钾对 4 种有机酸保留时间及分离效果的影响如图2所示。
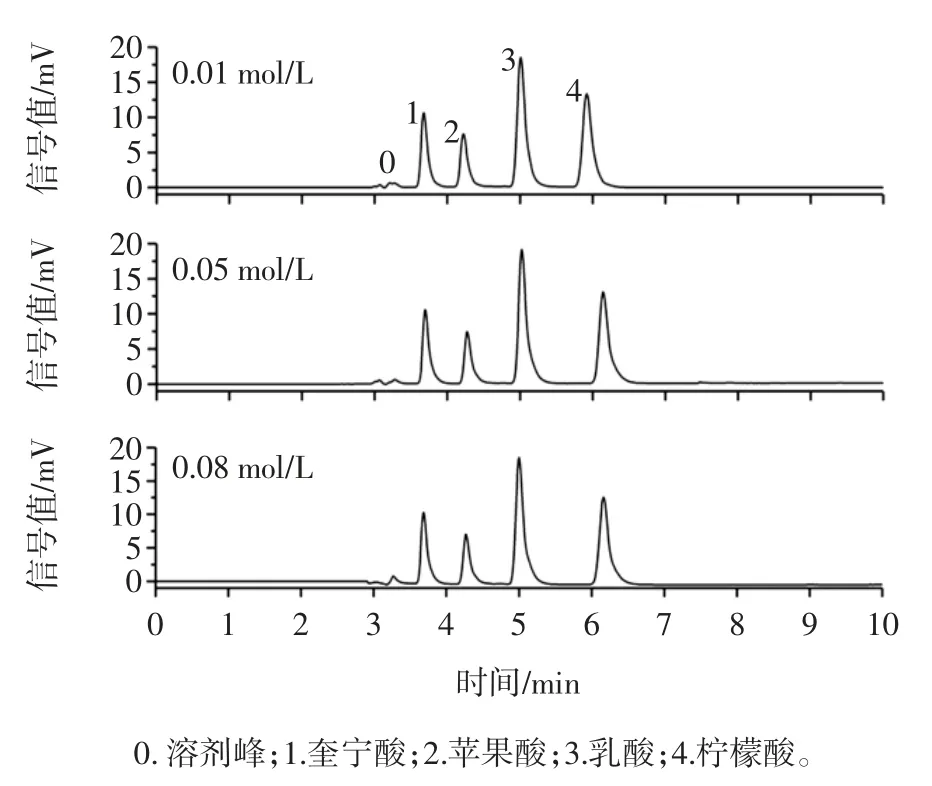
图2 流动相磷酸二氢钾浓度对4 种有机酸分离效果的影响Fig.2 Effects of monopotassium phosphate concentration in mobile phase on the separation of 4 kinds organic acids
由图2 可知,磷酸二氢钾的浓度对于4 种有机酸的保留时间和峰形均具有一定的影响,对比3 个不同磷酸二氢钾浓度的色谱图可知,随着磷酸二氢钾浓度的降低4 种有机酸的保留时间也相应的缩短,从而缩短单次分析的时间。同时,观察3 号和4 号峰可知,随着磷酸二氢钾浓度的升高,3 号和4 号峰的峰形也越差,且当磷酸二氢钾的浓度为0.08 mol/L 时,基线出现下偏。因此,本研究选择0.01 mol/L 的磷酸二氢钾溶液作为流动相。
2.1.3 流动相pH 值的选择
pH 值为 2.30、2.50 和 2.90 的磷酸二氢钾流动相对4 种有机酸保留时间及分离效果的影响如图3所示。
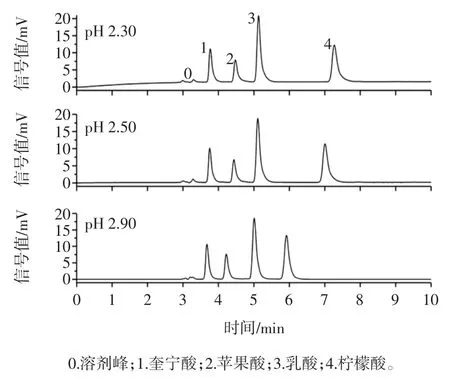
图3 流动相pH 值对4 种有机酸分离效果的影响Fig.3 Effect of pH of mobile phase on the separation of 4 kinds organic acids
由图3 可知,流动相的pH 值对4 种有机酸的保留时间和峰形均存在较大的影响,对比不同pH 值的色谱图可知,随着pH 值的上升4 种有机酸的保留时间均有较大的缩短,特别是柠檬酸的保留时间由7.20 min缩短至5.90 min。由图3 亦可知,当pH 值为2.30 时,基线并不稳定,而有向上漂移的趋势;当pH 值为2.50时,3 号峰和4 号峰的分离度过大,保留时间相对较长,且对比 3 个图发现,pH 值为 2.30 和 2.50 时,均出现不同程度的拖尾现象。因此,本研究选择磷酸盐溶液的pH 值为2.90。
2.1.4 流动相中有机相比例的选择
调节乙腈和磷酸盐溶液的体积比分别为0 ∶100、5 ∶95 和 10 ∶90,研究其对 4 种有机酸保留时间及分离效果的影响,结果如图4所示。
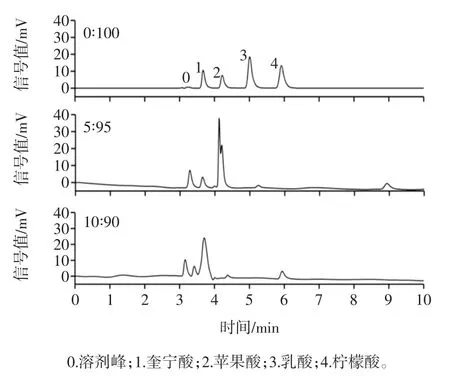
图4 流动相中乙腈比例对4 种有机酸分离效果的影响Fig.4 The effect of acetonitrile percentage in mobile phase on the separation of 4 kinds organic acids
由图4 可知,随着有机相比例的不断增加,4 种有机酸的保留时间也不断缩短,且峰形、分离度和响应信号均发生了较大变化。对比3 个图可知,当乙腈添加比例为0 时,4 种有机酸能达到很好的分离效果;而当乙腈的添加比例为5%或10%时,4 种有机酸并不能达到相应的分离效果,且与不添加乙腈相比,添加乙腈以后的检测基线并不稳定且噪音较大。因此,本研究选择不添加乙腈。
2.1.5 流速的选择
流动相流速为 0.05、0.80、1.00、1.20 mL/min 时对 4种有机酸保留时间及分离效果的影响如图5所示。
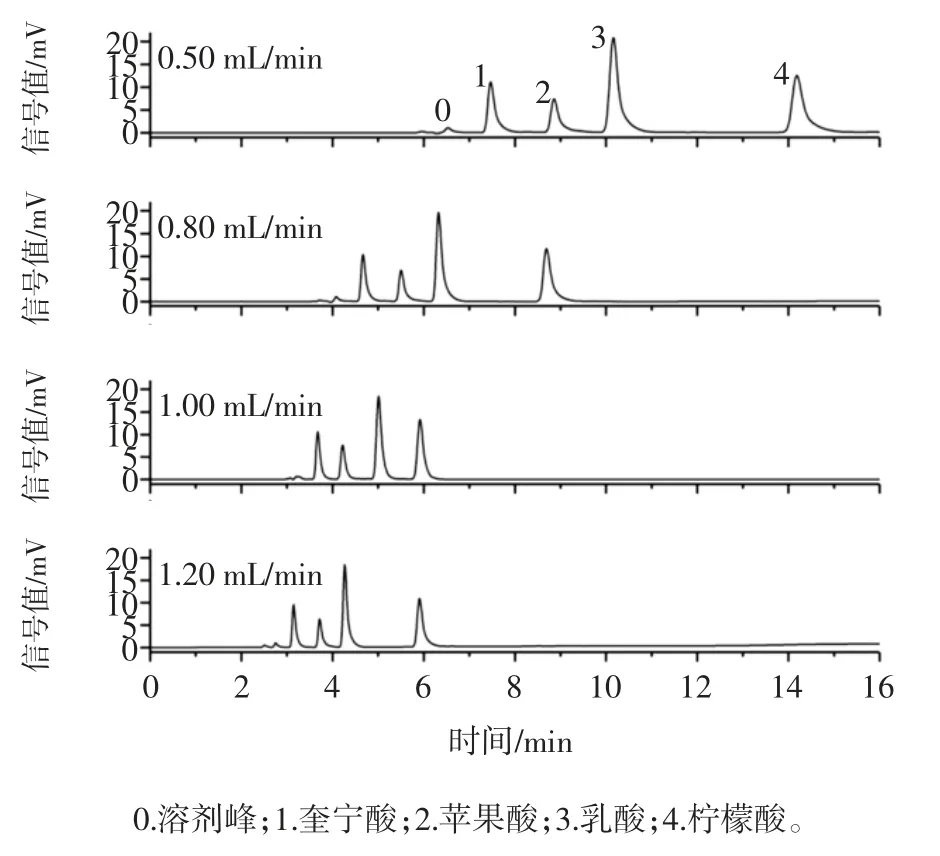
图5 流动相流速对4 种有机酸分离效果的影响Fig.5 Effect of flow rate of mobile phase on the separation of 4 kinds organic acids
由图5 可知,流速对4 种有机酸的保留时间的峰形具有较大影响,随着流速的增加,4 种有机酸的保留时间会有明显的缩短,值得注意的是,当流速为1.00 mL/min和1.20 mL/min 时,柠檬酸的保留时间并没有较大差异。由图5 亦可知,随着流速的降低,4 种有机酸峰宽逐渐增加,且出现较为明显的拖尾现象,而对比流速为1.00 mL/min 和1.20 mL/min 时的色谱图发现,流速为1.20 mL/min 时柠檬酸的峰形较差且压力相对较高。因此,本研究选择流速为1.00 mL/min。
2.1.6 柱温的选择
柱温箱的温度为25、30、35 ℃时对4 种有机酸保留时间及分离效果的影响如图6所示。

图6 柱温对4 种有机酸分离效果的影响Fig.6 Effect of column temperature on the separation of 4 kinds organic acids
由图6 可知,柱温对于奎宁酸、苹果酸和乳酸的保留时间并没有较大影响,而对柠檬酸的保留时间影响却较大,当柱温为30 ℃时,单次分析时间最短。由图6亦可知,当柱温为25 ℃和35 ℃,苹果酸、乳酸和柠檬酸的峰形相较于30 ℃时的峰形差。因此本研究选择柱温为30 ℃。
2.2 猕猴桃酒中4 种有机酸含量的测定
2.2.1 标准回归方程
分别以4 种有机酸的浓度为自变量x,色谱峰面积为因变量y 进行标准曲线回归方程的计算,结果如表1。

表1 4 种有机酸回归方程Table 1 Linear regression equations of detection for 4 kinds organic acids
由表1 可知,4 种有机酸的线性回归方程的相关系数均在0.999 0 以上,可见各有机酸在浓度范围内具有良好的线性关系。同时其检出限在4.50 mg/L~6.60 mg/L 之间,具有较高的精度,可以满足试验要求。
2.2.2 猕猴桃酒中4 种有机酸含量的测定
使用HPLC 法对10 个猕猴桃酒样品中4 种有机酸测定的结果如表2所示。
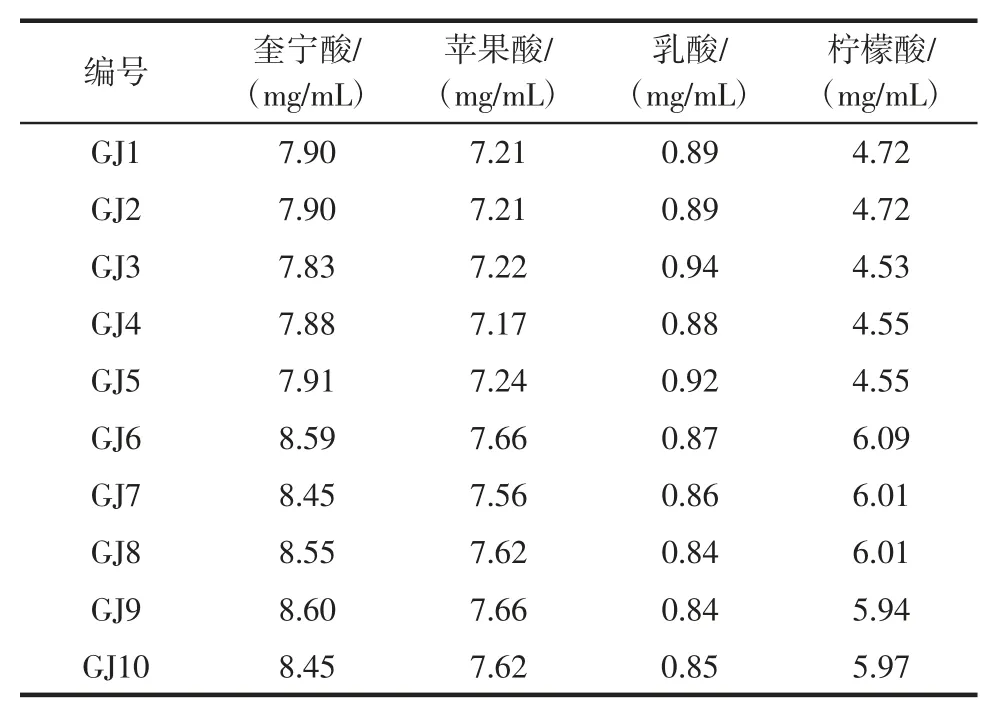
表2 HPLC 法测定猕猴桃酒中4 种有机酸含量(n=10)Table 2 Contents of 4 kinds organic acids in 10 kiwifruit wine samples(n=10)
由表2 可知,10 种猕猴桃酒中均检测出奎宁酸、苹果酸、乳酸和柠檬酸,其含量范围分别为7.83 mg/mL~8.60 mg/mL、7.17 mg/mL ~7.66 mg/mL、0.84 mg/mL ~0.94 mg/mL 和 4.53 mg/mL~6.09 mg/mL。由此可见,奎宁酸、苹果酸和柠檬酸为猕猴桃酒中的主要有机酸。
2.3 方法性能研究
2.3.1 精密性试验结果
将1.2.1.2 中的供试样品溶液连续进样7 次,分别对4 种有机酸的峰面积进行测定,然后计算其相对标准偏差值(relative standard deviation,RSD),精密度试验结果如表3所示。
由表3 可知,奎宁酸、苹果酸、乳酸和柠檬酸的相对标准偏差值均在0.10%以下,因而使用本研究优化的色谱条件测定猕猴桃酒中4 种有机酸时具有良好的精密性。
2.3.2 重复性试验结果
按照1.2.2.2 中的色谱条件对GJ1 猕猴桃果酒中各有机酸含量进行测定,试验重复操作7 次,计算4 种有机酸峰面积的RSD,重复性试验结果如表4所示。
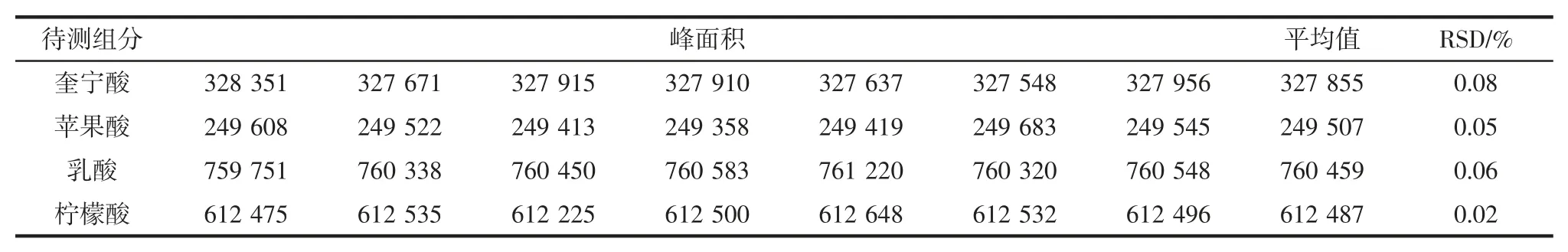
表3 精密度试验结果Table 3 Precision experiment results
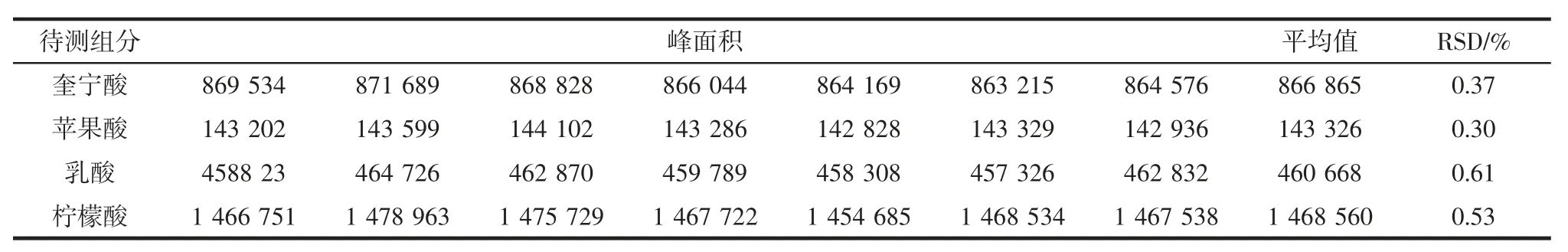
表4 重复性试验结果Table 4 Repetitive test results
由表4 可知,奎宁酸、苹果酸、乳酸和柠檬酸的相对标准偏差值均在1.00%以下,因而使用本研究优化的色谱条件测定猕猴桃酒中4 种有机酸时具有良好的重复性。
2.3.3 加标回收试验结果
参照1.2.2.2 中的色谱条件进行加标回收率试验,其结果如表5所示。
由表5 可知,奎宁酸、苹果酸、乳酸和柠檬酸其平均回收率分别为100.19%、99.64%、99.25%和99.67%,因而使用本研究优化的色谱条件测定猕猴桃酒中4 种有机酸时可以很好的满足试验要求。
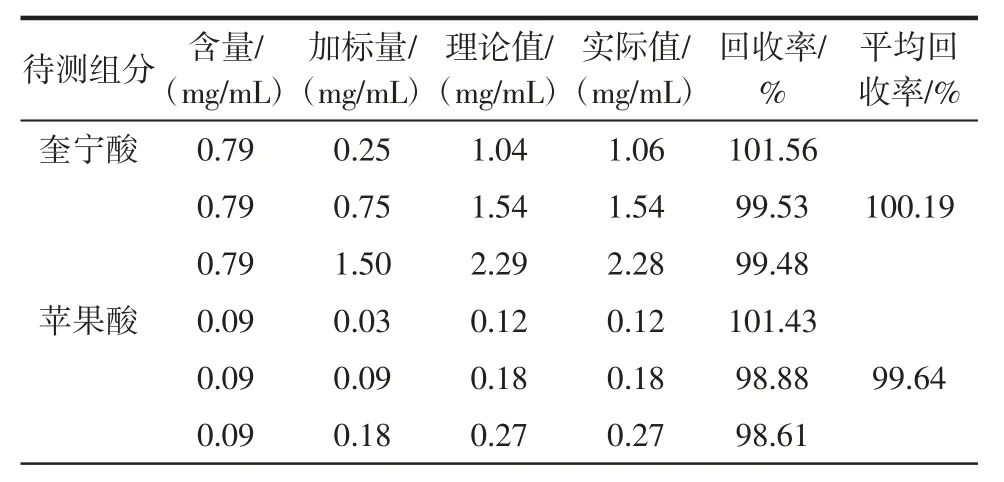
表5 加标回收率试验结果Table 5 Spiking recovery test results

续表5 加标回收率试验结果Continue table 5 Spiking recovery test results
3 结论
本研究建立了反相高效液相色谱法快速测定猕猴桃酒中奎宁酸、苹果酸、乳酸和柠檬酸的方法,流动相为0.01 mol/L 磷酸二氢钾,pH 值2.90,色谱柱为InertSustainSwift C18(250 mm×4.6 mm,5 μm),流速为1.00 mL/min,柱温为 30 ℃,进样量为 20 μL,检测波长为215 nm,采用该方法分析发现,奎宁酸、苹果酸和柠檬酸为猕猴桃酒中的主要有机酸。
——CIPAC分析手册 O卷的分析方法

