HIF-1α对大鼠创伤后认知功能障碍的影响研究
张启财,张 赛,孙中磊
研究表明颅脑创伤(Traumatic Brain Injury,TBI)可增加认知功能障碍发生的风险[1,2]。认知功能障碍的主要表现为Aβ升高,尤其是Aβ的寡聚形式在神经元中的毒性作用,最终导致神经突触传递失败[3,4]。神经细胞生理需要持续供应氧和葡萄糖,TBI后的大脑组织中发现有氧糖酵解减少,导致细胞存活机制丧失,这与其他潜在的致病过程结合,最终导致神经变性增加认知功能障碍的风险[5]。代谢减退可能改变淀粉样蛋白β前体蛋白(amyloid β precursor protein,APP)的表达和转换,最终导致Aβ的产生和清除失衡[6,7]。APP的过度表达、Aβ的产生和清除的不平衡可能是由于认知功能障碍患者的额叶、顶叶、枕叶皮质和纹状体的葡萄糖代谢缺乏所致,认知功能障碍患者大脑皮质存在氧化能代谢缺陷[8]。这种与能量相关的代谢应激导致APP代谢改变并导致认知功能障碍中的淀粉样变性[9]。
脯氨酸羟化酶(Prolyl Hydroxylase,PHD)可以识别低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)odd区脯氨酸残基Pro402和N-TAD区的Pro564,使之发生羟基化,进而经过希佩尔林道蛋白介导而进行泛素化降解。在缺氧条件或PHD抑制剂存在时,PHD羟基化活性下降,阻碍了HIF-1α的降解,使HIF-1α稳定表达并积累,从而激活下游靶基因[10]。因此,PHD抑制剂被本研究采用作为提高HIF-1α水平的药物。
缺氧诱导因子(HIF)是以适应缺氧改善葡萄糖代谢的细胞转录因子。在其他几种疾病中发生作用,包括癌症炎症反应、抗细胞凋亡、血管生成和恶性细胞增殖[11,12]。虽然最近的实验研究证明其稳定表达在大脑中具有神经保护作用,但它在认知功能障碍中的确切作用很少[13]。因此,关于HIF在认知功能障碍中作为神经保护剂的可能对医学研究具有重要意义。本研究探讨了HIF在认知功能障碍中的作用及其未来前景。
1 材料和方法
1.1 材料
1.1.1 实验动物 SPF级雄性SD大鼠60只,6~8周龄,体重200~300 g,由人民解放军军事医学科学院动物实验中心提供,SCXK-(军)2012-0004,饲养环境为清洁级动物室(SPF级)。
1.1.2 主要实验器材与材料 电子脑皮质撞击仪(eCCI,Custom&Design),石蜡切片机(Leica),荧光显微镜(OLYMPUS),低温离心机(深圳柯俊公司粉碎仪,Morris水迷宫(上海欣软科技有限公司),PHD抑制剂(MK-8617,MedchemExpress),Anti-Rabbit Aβ1-42(Abcam),Anti-Rabbit tau(Abcam),Anti-Rabbit β-Tubulin(Abcam),Anti-Rabbit HIF-1α(Abcam),Anti-Rabbit - VEGF(Abcam),Anti-Rabbit- EPO(Abcam),TUNEL荧光试剂盒(Roche)。
1.2 方法
1.2.1 建立TBI大鼠模型 将大鼠随机分为sham组(20只)、TBI组(20只)、PDH抑制剂组(10只)。采用皮质撞击致伤法建立大鼠TBI模型[8],术前6h禁食水。实验组大鼠经4%水合氯醛10 ml/kg腹腔注射麻醉后,头部剃毛,取俯卧固定于立体定向仪上,常规消毒铺巾。沿矢状切开头皮,剥离骨膜,以囟点为原点(AP:-2.5 mm L:2.5 mm)(AP:-2.5 mm R:2.5 mm)分别行颅钻钻孔(直径约4.0 mm),显露硬脑膜,并保持其完整无损。将eCCI打击壁调整至与垂直方向呈20°角,使用3 mm打击帽精确打击右侧大脑皮质以造成弥漫性轴索损伤。实验组的打击参数为(AP:-2.5 mm R:2.5 mm H:3 mm),打击速率均为5 m/s,打击最低点持续时间均为200 ms。TBI后处理创口彻底止血,缝合头皮。sham组仅磨除颅骨,不进行打击操作。
1.2.2 PDH抑制剂干预 大鼠造模后PHD抑制剂组给予15 mg/kg腹腔注射[14],1次/d,连续3 d。sham组和TBI组分别注射等体积的生理盐水。
1.2.3 Western blot法检测大鼠海马组织淀粉样蛋白β1-42(β-amyloid peptide1-42,Aβ1-42)、tau、HIF-1α、促血管内皮生长因子(Vascular endothelial growth factor,VEGF)、促红细胞生成素(erythropoietin,EPO)用BCA蛋白质测定试剂盒评估蛋白质浓度。使用十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳分离蛋白质并转移至聚偏二氟乙烯膜。用含0.1%牛血清白蛋白磷酸盐缓冲盐水(PBS)在室温下将膜封闭1h,然后PBST洗涤后与PBST中的下一级抗体温育过夜:兔抗Aβ1-42(1∶1000),兔抗tau(1∶1000),兔抗tau(1∶1000),兔抗HIF-1α(1∶1000),兔抗VEGF(1∶1000),兔抗EPO(1∶1000),兔抗β-Tubulin(1∶1000)。将膜与山羊抗兔二抗(1∶2000)在室温下孵育1h。使用增强的化学发光系统(ECL试剂盒)检测免疫反应性条带,并使用ImageJ 1.42q软件程序分析图像。
1.2.4 细胞凋亡检测 将脑组织进行抗原修复蛋白酶K(Roche)30 min,然后用PBS洗涤3次。根据分析试剂盒使用说明书进行TUNEL溶液制备和染色。两名观察者使用倒置荧光显微镜在400×放大率下获得CA1区段细胞定量。细胞凋亡(%)等于阳性细胞数/(阳性细胞+阴性细胞)×100%。
1.2.5 大鼠Morris水迷宫试验 水迷宫体直径120 cm,高35 cm。内壁涂黑,宫体内充满自来水,水温保持在25±2 ℃。逃生平台直径10 cm,高30 cm,置于宫体内坐标位置的第一象限,且低于水面0.5 cm。将自由活动的大鼠分别从四个象限随机放入水中,让其在逃生中寻找隐藏平台。大鼠的活动通过水池上方固定的摄像头进行图像采集并用Ethovision3.0软件进行处理。试验包括寻找水下平台的定位航行和去除平台后的空间探索两部分,主要观察指标有:(1)定位航行试验大鼠从31 d开始连续5 d从各个象限找到平台的时间,记录为平均逃避潜伏期;(2)空间探索试验在36 d,撤掉平台,从第Ⅱ象限入水,记录50 s内大鼠在目标象限内游泳时间和穿越目标平台象限次数。
1.2.6 统计处理 采用Graphpad Prism 5.0和SPSS 13.0软件分析数据。组间比较采用t检验或单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
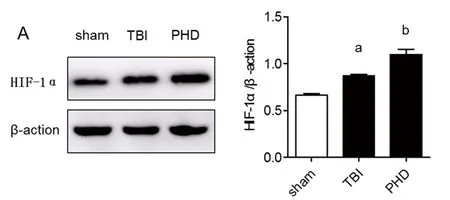
2.1 PHD抑制剂提高TBI大鼠海马组织HIF-1α表达水平 与sham组相比,TBI组HIF-1α水平明显升高(P<0.01),差异具有统计学意义;与TBI组比,PHD抑制剂组HIF-1α水平明显升高(P<0.01),差异具有统计学意义。结果表明PHD抑制剂可使TBI模型大鼠脑组织中HIF-1α的水平升高(见表1、图1)。
2.2 提高HIF-1α表达促进海马组织VEGF、EPO表达水平 与sham组相比,TBI组VEGF、EPO水平明显升高(P<0.01),差异具有统计学意义;与TBI组比,PHD抑制剂组VEGF、EPO水平明显升高(P<0.01),差异具有统计学意义。结果表明提高HIF-1α水平可使TBI模型大鼠脑组织中VEGF、EPO的水平升高(见表2、图2)。

表1 各组大鼠海马组织HIF-1α蛋白相对含量
注:TBI组与sham相比a:P<0.01;PHD抑制剂组与TBI组相比b:P<0.01
TBI组与sham组相比a:P<0.01;PHD抑制剂组与TBI组相比b:P<0.01
图1 PHD抑制剂促进海马组织HIF-1α表达水平

表2 各组大鼠海马组织VEGF、EPO蛋白相对含量
注:TBI组与sham相比a:P<0.01;PHD抑制剂组与TBI组相比b:P<0.01

TBI组与sham相比a:P<0.01;PHD抑制剂组与TBI组相比b:P<0.01
2.3 提高HIF-1α表达抑制海马组织Aβ1-42、tau表达水平 与sham组相比,TBI组Aβ1-42、tau水平明显升高(P<0.01),差异具有统计学意义;与TBI组比,PHD抑制剂组Aβ1-42、tau水平明显降低(P<0.01)。结果表明PHD抑制剂可抑制TBI模型大鼠脑组织中Aβ1-42、tau水平表达水平(见表3、图3)。
2.4 HIF-1α减少TBI后神经细胞凋亡 与sham组相比,TBI组细胞凋亡比率明显升高(P<0.01),差异具有统计学意义;与TBI组相比,PHD抑制剂组细胞凋亡比率明显降低(P<0.01),差异具有统计学意义。结果表明提高HIF-1α水平抑制TBI模型大鼠海马组织早期神经细胞凋亡(见图4)。

表3 各组大鼠海马组织tau、Aβ1-42蛋白相对含量
注:TBI组与sham相比a:P<0.01;PHD抑制剂组与TBI组相比b:P<0.01

TBI组与sham相比a:P<0.01;PHD抑制剂组与TBI组相比b:P<0.01

TBI组与sham相比a:P<0.01;PHD抑制剂组与TBI组相比b:P<0.01
2.5 HIF-1α改善大鼠神经功能
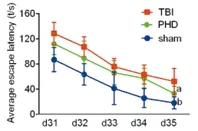
2.5.1 缩短TBI大鼠逃避潜伏期 在5 d时的定位航行的实验中,与sham组相比,TBI组大鼠的逃避潜伏显著延长(P<0.01);与TBI组相比,PHD组的逃避潜伏期显著缩短(P<0.01)(见表4、图5)。
2.5.2 缩短TBI大鼠在目标象限内游泳时间和穿越目标平台象限次数 与sham组相比,TBI组大鼠在目标象限内游泳时间及跨越隐匿平台的次数显著减少(P<0.01),与TBI组相比,PHD组在目标象限内游泳时间及跨越隐匿平台的次数显著增加(P<0.01)(见表5、图6)。

表4 各组大鼠逃避潜伏期
注:TBI组与sham相比a:P<0.01;PHD抑制剂组与TBI组相比b:P<0.01
TBI组与sham相比a:P<0.01;PHD抑制剂组与TBI组相比b:P<0.01
图5 各组大鼠逃避潜伏期

表5 各组大鼠在目标象限内游泳时间和穿越目标平台象限次数
注:与sham相比a:P<0.01;与TBI组相比b:P<0.01

与sham组相比a:P<0.01;与TBI组相比b:P<0.01
图6 各组大鼠在目标象限内游泳时间和穿越目标平台象限次数
3 讨 论
TBI导致的缺血缺氧性改变是TBI后认知功能障碍的诱因。缺氧是运动神经元死亡的主要原因,已在各种神经退行性疾病中得到证实。这种效应归因于缺乏葡萄糖和氧气难以满足运动神经元的能量需求[15]。根据Schubert等的研究,Aβ参与星形胶质细胞活化与HIF-1α表达的长期下降有关[16]。为此,本研究通过提高HIF-1α的表达水平初步探索其对认知功能障碍的影响及其机制。
最近的体外和体内研究证明了HIF-1α对Aβ诱导的海马细胞凋亡的改善作用,HIF-1和HIF-2均被发现在发育中的大脑缺氧缺血损伤的急性和晚期阶段作为保护剂[17]。Liu等研究表明认知功能障碍患者的脑HIF-1α水平降低与葡萄糖转运蛋白-1和葡萄糖转运蛋白-3的下调相关,HIF-1α水平降低损害葡萄糖摄取和代谢,最终导致O-乙酰氨基葡萄糖降低和tau的进一步过度磷酸化[18]。这一研究结果也得到了Deng等的进一步证实[19]。并且在本研究的结果中(见图2)也证实了提高HIF-1α水平能有效抑制tau及Aβ1-42的水平。
Aβ积聚和低灌注可能引起VEGF的上调[20],而VEGF诱导的血管生成可以增加运动神经元的血液供应,这一点从使用带有突变型超氧化物歧化酶的腺病毒载体的研究中可见证实[21]。Lunn等表明VEGF可以增加轴突生长,促进神经发生,抑制caspase-3诱导的细胞凋亡,这种作用是通过PI3K/Akt信号传导介导的[22]。此外,VEGF的过度表达可导致微血管的形成,从而延缓小鼠神经元的死亡[23]。除此之外,EPO也可以介导神经保护作用。重组人EPO能够预防运动神经元炎症和凋亡[24]。其机制是通过介导脑源性神经营养因子的形成;促进抗凋亡蛋白如Bcl-2和Bcl-XL表达[25]。这在本研究中的蛋白免疫印迹实验及荧光TUNEL实验中得到了证实,提高HIF-1α水平促进VEGF和EPO的表达水平(见图1),有效抑制TBI后神经细胞的凋亡(见图3),从分子水平上为大鼠TBI后神经功能恢复提供了有力的依据。并且大鼠的Morris水迷宫试验同样支持提高HIF-1α水平有效改善TBI大鼠记忆功能这一论断(见图4、图5)。
大鼠TBI与认知功能障碍的发生有直接关系。而提高HIF-1α水平可以有效的减少TBI引起的Aβ1-42和tau蛋白水平的升高,为预防和治疗TBI后认知功能障碍提供了新的思路。因此,我们推断提高HIF-1α水平对大鼠TBI后认知功能障碍可起到有效的预防和治疗作用。

