利用AtLUP1超量表达体系在拟南芥中合成羽扇豆醇
黄凤珍,高润昕,李 萌,许 岗,纪小敏,曹福祥,3
(1.中南林业科技大学 生命科学与技术学院,湖南 长沙 410004;2.湖南省环境资源植物开发与利用工程技术研究中心,湖南 长沙 410004;3.湖南农业大学 园艺园林学院,湖南 长沙 410128;4.湖南福来格生物技术有限公司,湖南 长沙 410100)
羽扇豆醇属于三萜类化合物,是植物特有的次级代谢产物,广泛存在于水果、蔬菜和中草药植物中[1]。在对一些植物组织,例如细叶杜香叶、竹节蓼、柚花、木棉树皮等的化学成分进行分析时都发现了羽扇豆醇的存在[2-5]。羽扇豆醇由于其抗氧化、诱导凋亡、抗恶性肿瘤增殖、抗基因突变以及抗炎症和抑制肿瘤细胞生长等活性而广泛应用于肿瘤的预防和治疗[6]。恶性肿瘤是目前危害人类健康的主要疾病之一。化学药物虽然对癌症疗效显著,但存在较大的毒副作用,相比之下天然抗癌药物在相同疗效的前提下毒副作用更低,具有更高的开发潜力[7-8]。但是此类化合物大多是从植物中直接提取,并且产量极低,对植物资源有很高的依赖性和破坏性[9]。使用生物技术手段既可以提高其产量,又可以降低成本,是目前工业化生产生物活性物质的的主要方向。
羽扇豆醇合酶(LUP)是将鲨烯转化成羽扇豆醇的关键酶。植物体内的羽扇豆醇合成途径如图1:首先由法尼基焦磷酸合成酶(FPS)将异戊烯焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP)异构化生成法尼基焦磷酸(FPP),然后FPP在角鲨烯合酶(SQS)的作用下转化成角鲨烯,接着角鲨烯在角鲨烯环化酶(SQE)的催化下转化成2,3-环氧鲨烯,最后氧化鲨烯环化酶(OSC)使2,3-氧化角鲨烯以阳离子中间体的形式环化成三萜醇或醛[10]。其中阳离子中间体可在羽扇豆醇合酶的催化下转化成羽扇豆醇。
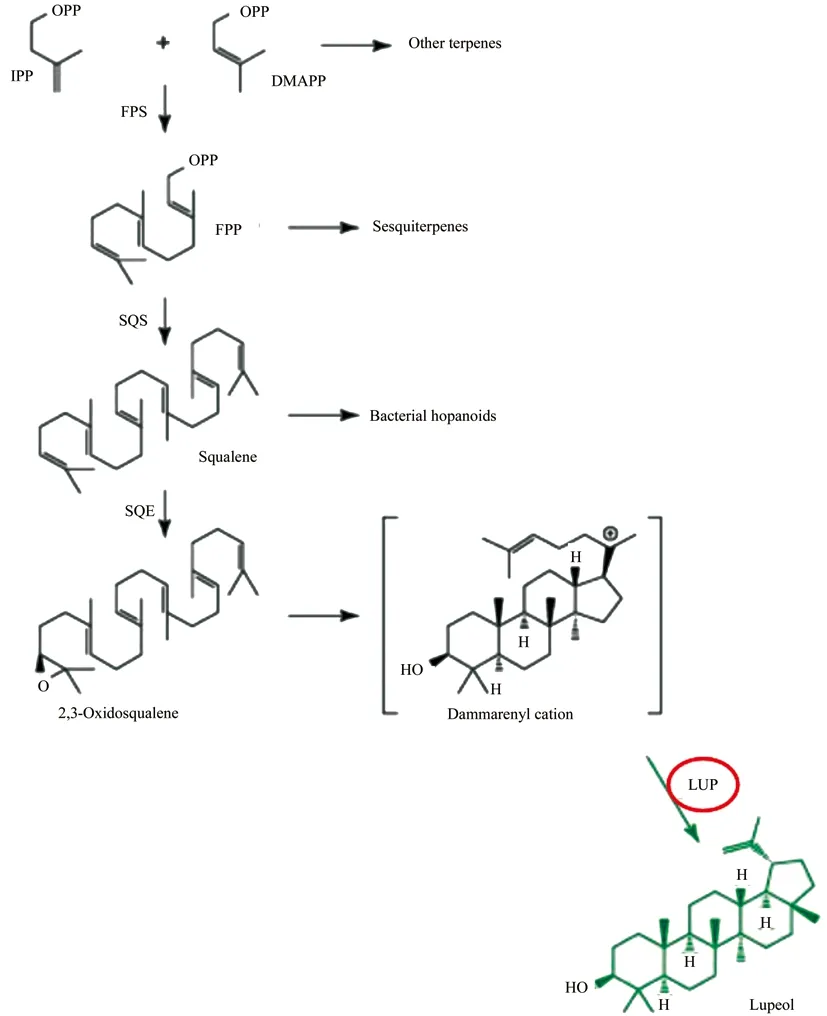
图1 羽扇豆醇合成途径Fig.1 The synthesis pathway of Lupeol
高量表达羽扇豆醇合成途径中的关键基因以实现羽扇豆醇在细菌或酵母中的异源合成是目前羽扇豆醇工业化生产的一个重要思路。王冬在三萜底盘细胞BY-T3 的rDNA 多拷贝位点引入乌拉尔甘草来源的羽扇豆醇合酶基因(LUP)及MVA途径限速酶3-羟基-3-甲基戊二酰辅酶A 还原酶基因(tHMG1),初步获得了可生产桦木酸前体羽扇豆醇的底盘细胞BY-LUP02[11]。林庭庭尝试通过创建酿酒酵母细胞工厂NK2-LUP 发酵生产羽扇豆醇,然而该工程菌株中羽扇豆醇的转化率及产量均很低[12]。笔者前期也进行了羽扇豆醇合酶基因在大肠杆菌和酵母中的异源表达,但均未能获得具有生物活性的目标蛋白。前期研究发现拟南芥基因组中虽然存在羽扇豆醇合酶基因,但在拟南芥中不能检测到羽扇豆醇。因此,本研究尝试直接以拟南芥为受体,构建AtLUP1 超表达体系,在拟南芥中超量表达AtLUP1 基因,并检测转基因植株中羽扇豆醇的含量,观察提高该基因的表达量是否能促进植物细胞中羽扇豆醇的合成,为羽扇豆醇的工业化生产提供新思路。
1 材料与方法
1.1 材 料
拟南芥(Columbia-0)野生型由本实验室保存。播种种子于混合泥土(蛭石∶优质土=1∶3)中,置于光照培养箱(MGC-250HP-2)中,培养条件为:光照时间16 h(黑暗8 h);光照强度100~150 μmol/m2·s;培养室温度为光照条件下20~22 ℃,黑暗条件下18~20 ℃;相对湿度70%。
1.2 方 法
1.2.1 拟南芥基因组DNA 的提取
选取约0.5 mg 拟南芥幼嫩叶片,加入液氮快速研磨成粉,采用植物基因组DNA 提取试剂盒(天根)提取拟南芥总DNA。提取完成后,使用1%琼脂糖凝胶电泳检测其完整性,并使用紫外分光光度计测定DNA 浓度。
1.2.2 引物设计及目标基因的克隆
根据AtLUP1 基因序列设计特异引物AtLUP1-Fw/Rs(引物序列见表1),分别在引物两端加入BamHI 和SacI 酶切位点,以拟南芥基因组DNA为模板进行PCR 扩增。克隆片段连接TA 载体后,送往铂尚生物技术有限公司测序,测序无误后将载体命名为pMD18-T/LUP1。由于AtLUP1 基因片段过长,故设计检测引物LUP1-T-F/R,克隆AtLUP1基因中长度约500 bp 的部分片段,在后续实验中使用该引物进行PCR 以验证AtLUP1 基因的存在。

表1 本研究所用的引物序列Table 1 Primer sequences used in this study
1.2.3 植物表达载体的构建及农杆菌介导的拟南芥遗传转化
载体将含有目标基因的载体与植物表达载体pBI121 分别用内切酶BamHI 和SacI 双酶切,将酶切获得的目标片段切胶回收后用T4 DNA 连接酶连接,获得含有35S 强启动子与目标基因的植物双元表达载体(构建过程如图2)[13]。然后,将重组质粒转化农杆菌感受态GV3101,拟南芥遗传转化参照Zhang[14]的方法进行。
1.2.4 转基因植株的筛选与鉴定
收取T0 代种子,于含有卡那霉素(kan,50 mg/L)及头孢霉素(cef,200 mg/L)的MS 筛选培养基中进行筛选,在筛选平板中挑取且生长状态良好的幼苗转移至7 cm×7 cm 培养盒中,待其成熟后取叶片,提取DNA,使用表1中的引物NPT-L/R 进行PCR 检测。
1.2.5 GC 分析测定转基因植株中羽扇豆醇的总量
样品制备:取T1 代转基因拟南芥植株0.1 g,液氮研磨后,加入2 mL 乙酸乙酯萃取,振荡器震荡20 min,离心,去上清液,真空抽干,抽干后加入100 μL BSTFA,80℃,30min。再加入等体积的氯仿,进气相进行分析。
标准品羽扇豆醇的制备:准确称取羽扇豆醇标准品10 mg 于25 mL 容量瓶中,用乙醇溶解并定容。移取1 mL 于试管中,真空抽于后加入100 μL BSTFA,80 ℃,30 min。再加入等体积的氯仿,进气相进行分析。
气相分析采用日本岛津GC-2014C气相色谱仪;色谱柱为毛细管色谱,HP-5MS 30 m×0.25 mm× 0.25 μm;进样口温度250 ℃;柱温0 min 80 ℃,以25 ℃/min 升至300 ℃,保留15 min;检测器:310℃;柱流量1.5 mL /min,分流比10∶1;载气为N2,流速为1.2 mL/min。
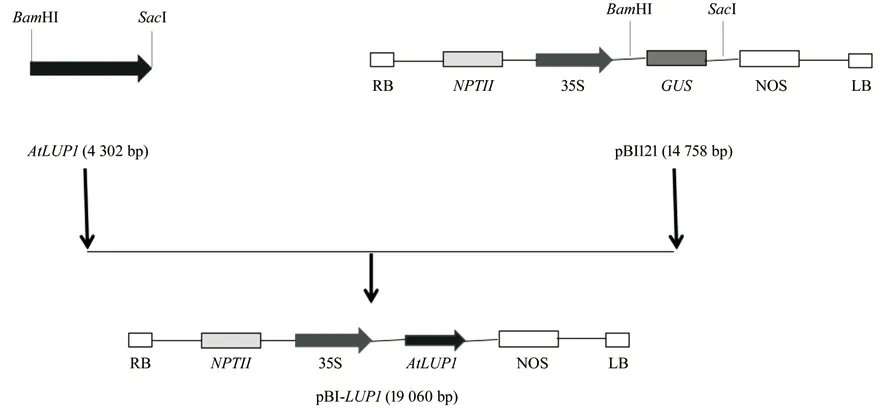
图2 双元表达载体pBI-LUP1 的构建流程简图Fig.2 The construction process of the binary expression vector pBI-LUP1
2 结 果
2.1 拟南芥基因组DNA 的提取及及目标基因的克隆
取拟南芥植株新鲜叶片,提取基因组DNA,稀释至终浓度为100 μg/mL。然后以稀释后DNA为模板进行PCR 扩增,获得约5 000 bp 的扩增产物,经过测序,序列长度为4 302 bp,与已知的AtLUP1 基因序列一致(图3)。
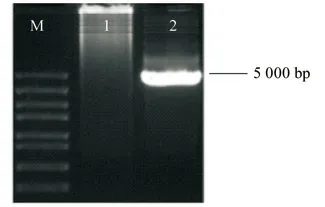
图3 AtLUP1 基因的克隆Fig.3 Cloning of the AtLUP1 gene
2.2 AtLUP1 基因序列信息
AtLUP1 基因序列全长4 302 bp;该段DNA序列中包含16 个内含子,17 个外显子,CDS 序列长度为2 274 bp(图4);编码757 个氨基酸。
2.3 植物表达载体的构建
将质粒pBI121 使用内切酶BamHI 和SacI进行双酶切(图5A),切胶回收后用T4 DNA连接酶与同样使用BamHI 和SacI 双酶切质粒pMD18-T/LUP1的产物(图5B)连接,将连接成功的质粒pBI-LUP1(图5C)转化农杆菌GV3101,用检测引物LUP1-T-F/R(引物序列见表1)PCR 检测筛选阳性克隆斑(图5D)。
2.4 转基因植株的鉴定与形态学分析
从Kan 抗性平板中筛选抗性植株,培养于混合泥土(蛭石∶优质土=1∶3)中,约一月后,提取DNA,PCR 检测NPT Ⅱ基因以筛选阳性植株(图6A)。经PCR 检测确认,共获得18 株转基因植株。对转基因植株与野生型植株的生理及形态进行观察(图6B),发现转基因植株与野生型植株的生长状态并无明显差异,转基因植株在营养生长和生殖生长阶段也与野生型植株没有明显差异,超量表达AtLUP1 基因对拟南芥的生长发育未观察到明显影响。
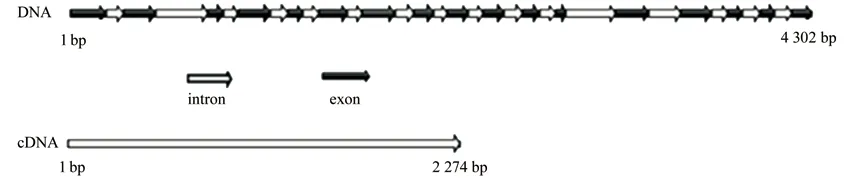
图4 AtLUP1 DNA 序列结构Fig.4 The DNA sequence structure of AtLUP1
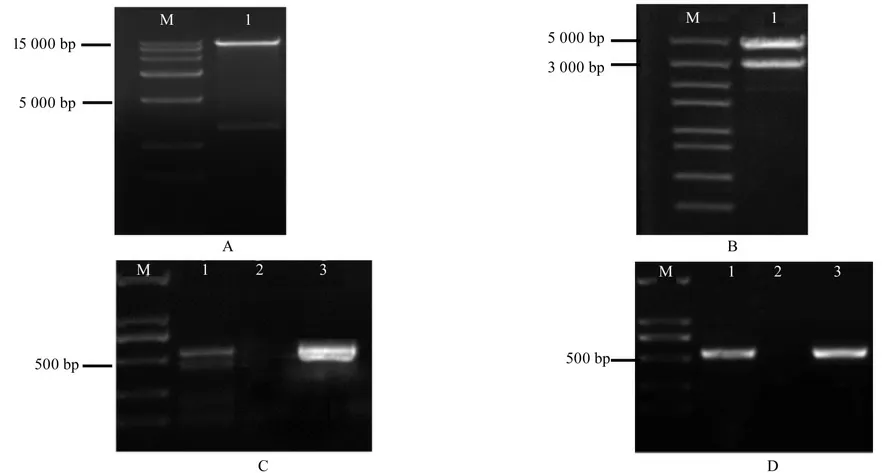
图5 植物表达载体的构建Fig.5 Construction of plant expression vector
2.5 羽扇豆醇含量的测定
通过GC 对野生型和转基因拟南芥植株中的羽扇豆醇含量进行分析,当t=22.535 min 时,Lupeol出峰,图7A 为羽扇豆醇标品图谱,图7B 为野生型样品图谱,图7C 为样品48 号样品气相图谱,根据图谱中峰面积大小,计算出每个样品中羽扇豆醇含量,并做成柱形图(7D)。结果表明:野生型拟南芥(样品编号1)中羽扇豆醇含量最低;转基因植株羽扇豆醇含量超过0.1 mg/g 的有3 株;其余15 株含量低于0.1 mg/g,但仍高于野生型;48 号植株羽扇豆醇含量最高,达0.915 5 mg/g。
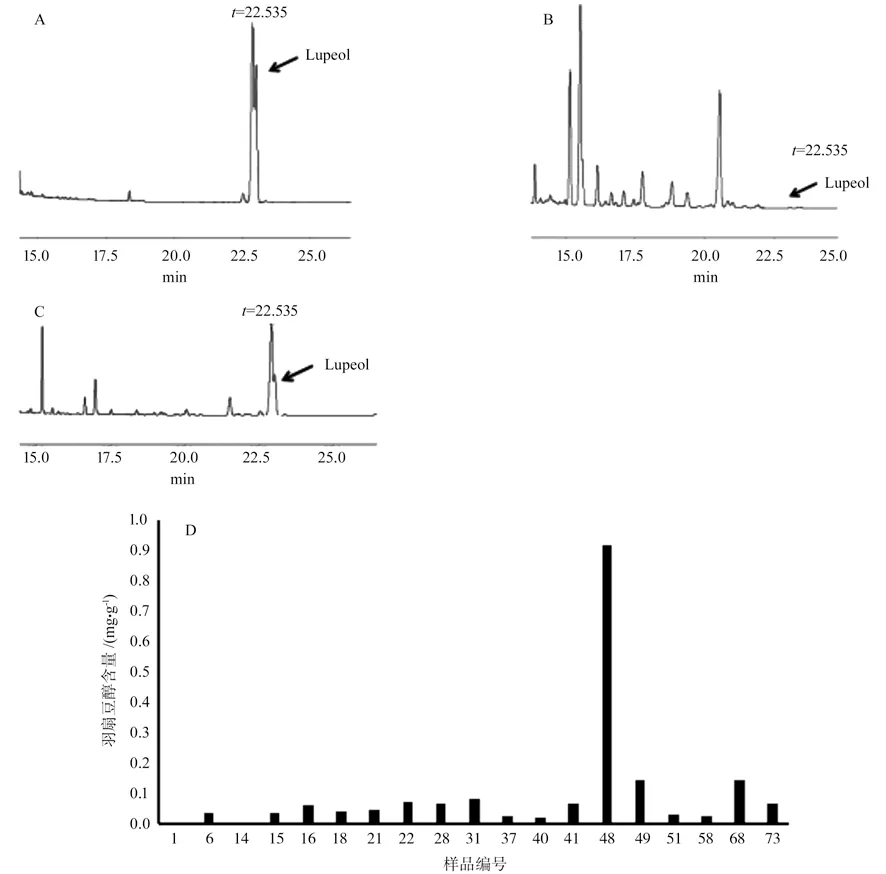
图7 野生型拟南芥和转基因植株中的羽扇豆醇含量Fig.7 Lupeol content in wild-type and transgenic plants
3 结论与讨论
本研究在拟南芥中成功克隆到AtLUP1 基因,该基因CDS 序列为2 274 bp,编码757 个氨基酸;通过遗传转化,获得AtLUP1 超量表达拟南芥植株18 株;通过气相色谱检测拟南芥中羽扇豆醇含量,发现其中48号植株中羽扇豆醇含量为0.915 5 mg/g,显著高于野生型。
近年来关于羽扇豆醇抗肿瘤作用及其作用机理的报道屡见不鲜,引起了国内外学者的关注。唐泽言研究表明羽扇豆醇能够抑制人肝癌细胞Huh-7 的增殖,可能与其介导caspase 活化具有一定的相关性[15]。郭敏发现羽扇豆醇具有抑制膀胱癌T24 细胞增殖能力,其作用机制与调控p53 /miR-34a 通路有关[16]。王明发现羽扇豆醇在体外能够有效地抑制人乳腺癌MDA-MB-231 细胞的侵袭和转移,可能与抑制COX-2、MMP-2 和MMP-9 的蛋白表达有关,其机制可能是抑制了核转录因子NF-KB 信号途径[17]。除了抗癌之外,羽扇豆醇也有其他功效,郭秀春利用高效液相色谱法分离测定了锦鸡儿中白桦脂酸、齐墩果酸、熊果酸和羽扇豆醇的含量,除白桦脂酸外,其他3 种化合物均表现出良好的对α-葡萄糖苷酶抑制活性,有望开发成为新的降血糖药物[18]。但要实现这些功能的前提就是有足够量的羽扇豆醇,因此,本研究有一定的实际意义。
羽扇豆醇合酶基因主要存在于豆科植物中,在其他植物如蓖麻,白桦,百脉根等植物中也存在,并且已经成功克隆[19-21]。本研究从拟南芥中克隆到的AtLUP1,该基因CDS 序列为2 274 bp,编码757个氨基酸。成功构建了羽扇豆醇合酶超量表达体系,得到18 株转基因拟南芥植株。观察转基因植株和野生型的生理形态(图6B)发现,两者在生理和形态上并无明显差异,可以推测该基因并不是拟南芥正常生长的必需基因,且该基因过量表达也不会影响拟南芥的正常生长发育和生物质积累,该结论与陆捡花[22]所得出的结论相符。通过GC 对野生型和转基因拟南芥植株中的羽扇豆醇含量进行分析(图7D),发现大多数转基因株系中的羽扇豆醇含量均高于野生型,其中转基因植株48 号植株中羽扇豆醇含量为0.915 5 mg/g,显著高于野生型,表明超量表达AtLUP1 基因可以在拟南芥中促进羽扇豆醇的合成。但是该研究有一定的局限性,虽然得到了18 株转基因植株,但是只发现1 株具有较高的羽扇豆醇含量,推测该基因的表达及后期加工比较复杂,基因拷贝数、表达量、插入位点等因素均可能影响其表达及蛋白产物的合成[23]。另一方面,羽扇豆醇的生物合成可能还需要其他酶的参与,同时提高多个关键酶的表达量可能会对羽扇豆醇的合成产生加成作用[11]。Costas Delis 对羽扇豆醇合酶在百脉根不同组织中的表达量分析发现,该基因在百脉根的叶中不表达,但在幼嫩的根和根瘤中大量表达,说明羽扇豆醇合酶基因的表达具有组织特异性[21],因此后续研究可以分析转基因植株的不同组织(根、茎、叶、花)中的羽扇豆醇的含量,以及不同组织在不同发育时期的羽扇豆醇含量,以设计最佳的工业应用方法。也可以继续筛选羽扇豆醇含量较高的转基因株系并进行细胞培养,使其扩大培养,为工业化生产羽扇豆醇提供一个新的思路。

