响应面法优化罗汉松总二萜提取及抗氧化研究
袁堂丰,瞿利民,郭 婕,2
(1.吉首大学林产化工加工工程湖南省重点实验室,湖南 张家界 427000;2.湖南省植物功能成分利用协同创新中心,湖南 长沙 410428)
罗汉松Podocarpus macrophyllus (Thunb.) D.Don 是罗汉松科Podocarpaceae 罗汉松属Podocarpus 常绿乔木植物,主要分布在我国江南各省及台湾地区[1]。该植物有多种药用价值,其根皮有活血止痛、治疗跌打损伤的疗效;其叶子能治疗风湿;其种子有补血益气、补肾益肺的功效[2]关于罗汉松的研究,目前主要集中在遗传多样性及快速繁殖技术。近年来,随着植物药用成分分离技术水平的提高,国内外学者对罗汉松及其同属其它植物的化学成分和生物活性研究渐多,化学成分类型涉及二萜、二萜内酯以及双黄酮等成分[3-6],生物活性研究表明这些化合物具有不同程度的杀虫、昆虫拒食、抑菌、抗氧化及抗肿瘤等活性[7-11]。
本文前期对罗汉松属植物的二萜成分做了大量调研和总结,发现其二萜类骨架主要有松香烷型和桃拓烷型,这些二萜表现出良好的抗肿瘤、抗氧化和抗炎等活性[5],结构上具有多取代苯环的苯基型二萜的特征[12],有相似的分子结构式和发色团,所以这类二萜化合物在同一波长处具有相似的紫外吸收特征和相同的吸收系数,都存在两个主要的吸收带:峰带Ⅰ(210~220 nm)和峰带Ⅱ(270~280 nm)。目前有关罗汉松中总二萜含量测定和提取工艺尚未见报道。因此本文选择以桃拓酚为对照品,采用紫外分光光度法测定罗汉松提取物的总二萜含量,并通过响应面法对罗汉松总二萜提取工艺进行优化,建立简便、稳定、可靠的总二萜检测方法,同时也为其它罗汉松属植物总二萜含量的检测提供参考。
1 材料与方法
1.1 材料与设备
样品于2017年8月采自湖南省张家界市锦程园艺公司,经吉首大学谷伏安副教授鉴定为罗汉松科植物罗汉松。
桃拓酚标准品购自云南昆明西力生物科技有限公司;无水甲醇、乙酸乙酯、石油醚均为国产分析纯试剂;实验用水均为超纯水。
Thermo Evolution 220 紫外可见分光光度计;IKA RV 10 Digital V 旋转蒸发仪;XO-5200DT 超声清洗机;平凡TD5A 台式低速离心机;GZX-9146MBE 型数显鼓风干燥箱(上海博迅实业有限公司医疗设备厂);AEL-40SM 型十万分之一电子天平;AEG-220 型万分之一天平(日本SHIMADZU)。
1.2 实验方法
1.2.1 罗汉松总二萜的测定
1.2.1.1 罗汉松总二萜提取
将罗汉松放入鼓风干燥箱50℃干燥72 h,用粉碎机粉碎后过80 目筛子。取5 g 罗汉松粉末,分别按不同的提取温度,甲醇浓度和液料比,超声提取若干次,每次若干分钟,然后5 000 r/min离心5 min,合并上清液,旋蒸除去溶剂得浸膏。将浸膏悬于200 mL 超纯水中先用石油醚萃取除去脂类,再用乙酸乙酯萃取3 次,每次100 mL,收集合并上层液,旋蒸除去乙酸乙酯,然后用无水甲醇定容至100 mL,得到罗汉松提取液。准确量取1 mL 罗汉松提取液置于50 mL 容量瓶中,用无水甲醇定容至刻度备用。
1.2.1.2 标准溶液的制备准确称取6.10 mg 桃拓酚对照品于25 mL 容量瓶中,无水甲醇定容至刻度,摇匀,配得浓度为0.244 mg/mL 的对照品储备液。分别量取1.00、2.00、3.00、4.00、5.00、6.00 mL 置 于10 mL 容量瓶中用无水甲醇定容至刻度,分别得到浓度为0.024 4、0.048 8、0.073 2、0.097 6、0.122 0、0.146 4 mg/mL 的系列桃拓酚标准液。
1.2.1.3 测定波长的选择
取浓度为0.073 2 mg/mL 桃拓酚标准液,以无水甲醇为空白对照,在200~800 nm 范围内扫描,确定其最大吸收波长为278 nm,见图1。
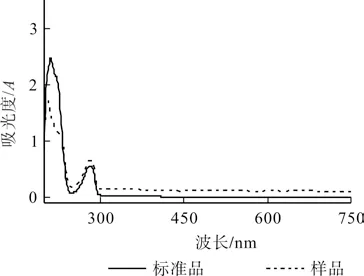
图1 紫外吸收光谱Fig.1 UV absorption spectra
1.2.1.4 标准曲线的绘制
取上述系列浓度标准品溶液,以无水甲醇作为空白对照,在278 nm 处测定吸光度A。以测定的吸光度A 为纵坐标,溶液浓度C 为横坐标绘制标准曲线,得到线性回归方程:A=0.007 4C+0.002 3,R2=0.999 8,结果表明桃拓酚标准液在0.024 4~0.146 4 mg/mL范围内吸光度与浓度呈良好线性关系。
1.2.1.5 总二萜含量测定
量取适量的样品溶液,以无水甲醇为空白对照,于278 nm波长下测定其吸光度,带入回归方程,求出样品溶液中总二萜质量浓度。
1.2.2 罗汉松总二萜提取条件单因素试验设计
以提取温度、甲醇浓度、液料比、提取次数、提取时间为影响因素,研究不同水平下各因素对罗汉松总二萜得率的影响。
总二萜得率=(CV/M)×100%。
式中:C 为提取液浓度,g/mL;V 为提取液体积,mL;M 为罗汉松粉末质量,g。
1.2.3 响应面法分析试验[13]
在单因素试验基础上,选择提取温度、甲醇浓度、和液料比为考察因素,以总二萜得率设计响应面因素水平表,见表1。
1.2.4 方法学试验
按照1.2.1.1 的方法,参照响应面优化后的工艺条件制备样品,按照1.2.1.5 的方法进行精密度、重复性、稳定性、回收率等方法学验证试验。
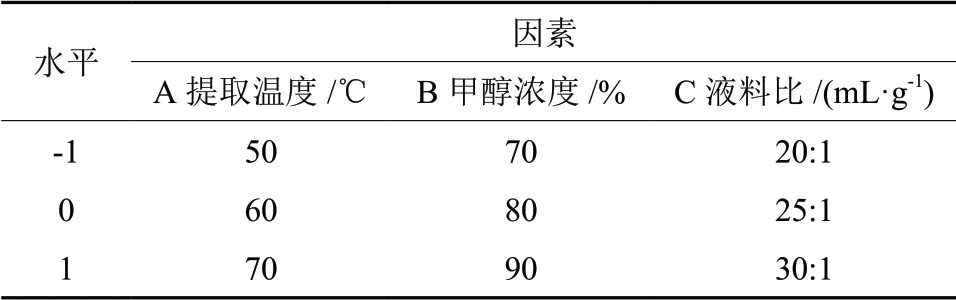
表1 Box-Behnken试验因素与水平Table 1 Factors and levels of Box-Behnken
1.2.5 罗汉松总二萜的抗氧化活性试验
1.2.5.1 DPPH 自由基清除活性测定
分别取2.0 mL 不同质量浓度的样品溶液,加入0.2 mmol/L DPPH 甲醇溶液2.0 mL,摇匀,室温下避光30 min,以无水甲醇作对照,于517 nm处测定吸光度A1。对照组以无水甲醇代替DPPH甲醇溶液,测定其吸光度A2。空白组以无水甲醇代替样品溶液,测定其吸光度A0。以相应质量浓度的Vc 作阳性对照,按公式(1)计算出DPPH 自由基的清除率,考察罗汉松总二萜清除DPPH 自由基能力的强弱。每组做3 次平行试验,取平均值。

式中:A0为空白组的吸光度;A1为样品组的吸光度;A2为对照组的吸光度。
1.2.5.2 羟自由基清除活性测定
罗汉松二萜对羟自由基的清除作用参照文献[14]稍作修改,在10 mL 的具塞试管中依次加入9.0 mmol/L 的FeSO4溶 液2.0 mL,8.8 mmol/L 的H2O2溶液2.0 mL,9.0 mmol/L 的水杨酸-甲醇溶液2.0 mL,最后分别加入不同质量浓度的样品溶液2.0 mL,37 ℃恒温水浴加热15 min 后,在510 nm波长下测其吸光度A0′,对照组以无水甲醇代替水杨酸-甲醇溶液,测定其吸光度A2′,空白组以无水甲醇代替样品溶液,测定其吸光度A0′。以相应质量浓度的Vc 作阳性对照,按下列公式(2)计算出样品对羟自由基的清除率Y′,考察罗汉松总二萜清除羟自由基能力的强弱。每组做3 次平行试验,取平均值。
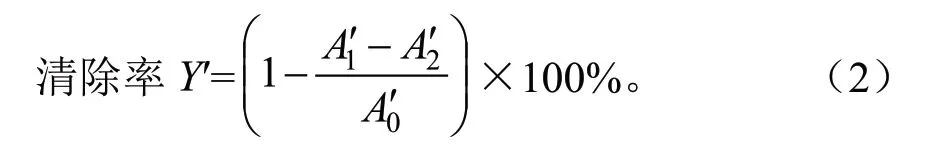
式中:A0′为空白组的吸光度;A1′为样品组的吸光度;A2′为对照组的吸光度。
1.2.5.3 超氧阴离子自由基清除活性测定,
采用邻苯三酚自氧化法,配置1 mL 不同质量浓度的样品,分别加入4.5 mL pH 为8.2,浓度为50.0 mmol/L 的Tris-HCl 缓冲液,并置于25 ℃水浴锅中20 min,然后加入25 ℃预热过的7.0 mmol/mL邻苯三酚0.2 mL,混合均匀后反应4 min,最后用0.5 mL 浓盐酸终止反应。以超纯水为参比溶液,于320 nm 处测定吸光度值A1″,空白组以Tris-HCl缓冲溶液代替样品溶液测定吸光度值A0″,对照组以Tris-HCl 缓冲溶液代替邻苯三酚盐酸溶液,测定吸光度值A2″。根据公式(3)计算出样品羟自由基的清除率Y″,考察罗汉松总二萜清除超氧阴离子能力的强弱。每组做3 次平行试验,取平均值。

式中:A0″为空白组的吸光度;A1″为样品组的吸光度;A2″为对照组的吸光度。
2 结果与分析
2.1 单因素实验结果分析
2.1.1 提取次数的影响
按照1.2.1.1 的方法制备样品,在液料比为30∶1(mL/g),甲醇浓度为80%,提取温度为50 ℃,每次提取时间30 min 的条件下考察不同提取次数(2、3、4、5 次)对罗汉松总二萜得率的影响,所有单因素试重复3 次,取其平均值,结果见图2a。由图2a可知,当提取次数超过3 次时总二萜得率没有明显变化,同时在悬蒸时发现,浓缩后浸膏质量不在有所增加,证明提取3 次已经能够将罗汉松中大部分二萜类成分提取出来,从节约试剂的角度考虑,将提取次数固定为三次。
2.1.2 提取时间的影响
按照1.2.1.1 的方法制备样品,在液料比为30∶1 (mL/g),甲醇浓度为80%,提取温度为50 ℃,提取次数为3 次的条件下考察不同提取时间(15、20、25、30、35 min)对罗汉松总二萜得率的影响,结果见图2b。由图2b可知,提取时间超过20 min后,总二萜得率基本不变,为提高工作效率,将提取时间固定为20 min。
2.1.3 提取温度的影响
按照1.2.1.1 的方法制备样品,在液料比为30∶1(mL/g),甲醇浓度为80%,提取次数3 次,每次20 min 的条件下考察不同提取温度(40、50、60、70、80 ℃)对罗汉松总二萜得率的影响,结果见图2c。由图2c可知,随着温度的升高,总二萜得率逐渐增大,当温度为60 ℃最为适宜,继续升高温度,二萜得率反而变小,可能是高温造成部分二萜发生降解。因此选取50、60、70 ℃这3 个水平进行响应面试验。
2.1.4 甲醇浓度的影响
按照1.2.1.1 的方法制备样品,在提取温度为60 ℃,液料比为30∶1(mL/g),提取次数3 次,每次20 min 的条件下考察不同甲醇浓度(60%、70%、80%、90%和100%)对罗汉松总二萜得率的影响,结果见图2d。由图2d 可知,当甲醇浓度从60%升高至80%时,总二萜得率明显增加,继续提高甲醇浓度,又开始变小,这可能是由于甲醇的渗透能力较强,提高甲醇浓度能加速目标成分在提取液和细胞质基质之间的溶解平衡。因此选取70%、80%和90%这3个水平进行响应面试验。

图2 提取次数(a)、提取时间(b)、提取温度(c)、甲醇浓度(d)、液料比(e)对总二萜得率的影响Fig.2 Effect of extraction times (a),extraction time (b),extraction temperature (c),methanol concentration (d),liquid-solid ratio (e) on the yield of diterpenoids
2.1.5 液料比的影响
按照1.2.1.1 的方法制备样品,在提取温度为60 ℃,甲醇浓度为80%,提取次数3 次,每次20 min 的条件下考察不同液料比(20∶1、25∶1、30∶1、35∶1、40∶1)(mL/g)对罗汉松总二萜得率的影响,结果见图2e。由图2e 可知随着液料比逐渐增大,总二萜得率显著增加,继续增大液料比,二萜得率基本保持不变。因此,为了满足较高的得率和节约溶剂损耗两方面因素,同时考虑到浓缩回收的工作量,这里我们选择20∶1、25∶1、30∶1(mL/g)这3 个水平进行响应面试验。
2.2 响应面分析优化工艺
2.2.1 响应面回归模型的方差分析
在单因素试验基础上,采用Box-Behnken 设计法,对罗汉松总二萜进行三因素三水平优化试验设计,结果见表2。
应用Design-Expert 8.0.6.1 软件对将所得的实验数据进行回归分析,得多元二次回归方程Y=1.12+0.078A+0.031B+0.069C-0.020AB+0.005AC- 0.033BC-0.150A2-0.150B2-0.100C2方差分析结果见表3。
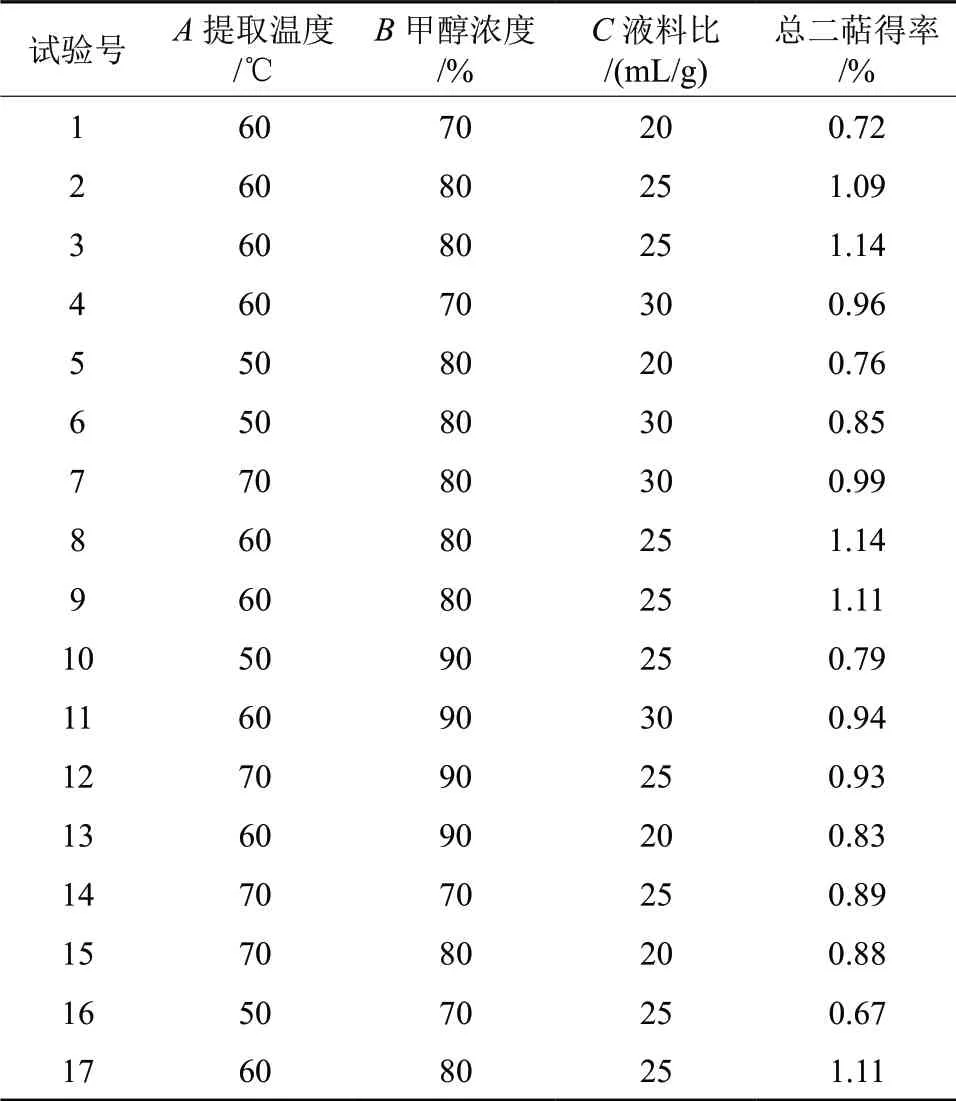
表2 响应面试验设计及结果 Table 2 Effect design and results of Box-Behnken experiments
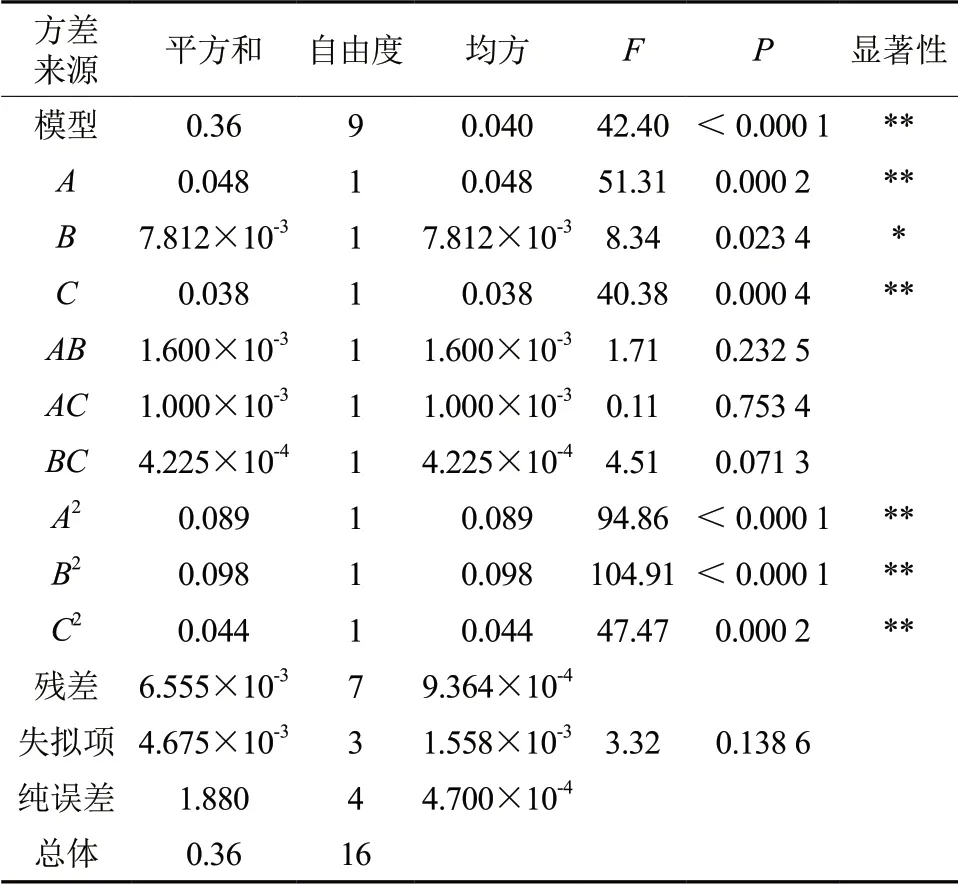
表3 回归模型方差分析†Table 3 Variance analysis of regression model
由 表3可 知,该 模 型F=42.10,P <0.001,表明该模型高度显著,方差分析结果F=3.32,P=0.1386,表明该模型失拟不显著。模型充分拟合试验数据,其响应值得率变化与所选变量提取温度(A)、甲醇浓度(B)、液料比(C)高度相关,拟合程度良好,试验误差小,可用此模型对提取罗汉松总二萜的得率进行分析和预测。模拟回归方程的系数显著性检验如下:一次项A,C,二次项A2,B2,C2对总二萜得率的影响是极其显著的,一次项C 对总二萜得率的影响是显著的。各因素对总二萜得率的影响的大小顺序为提取温度>液料比>甲醇浓度。
2.2.2 响应面图分析
在回归模型分析的基础上,运用Design-export 8.0.6.1 软件绘制三维响应面图(图3)可更直观地反映交互因素对罗汉松总二萜得率的影响。等高线的形状可以反映交互相的强弱,椭圆形表示两因素交互作用明显,而圆形则与之相反[15-16]。图3a和3c显示曲面较为陡峭、等高线呈现椭圆形,说明提取温度和甲醇浓度、液料比和甲醇浓度的交互作用对罗汉松总二萜得率的影响比较明显;图3b等高线趋近于圆形,说明提取温度和液料比交互作用不明显。
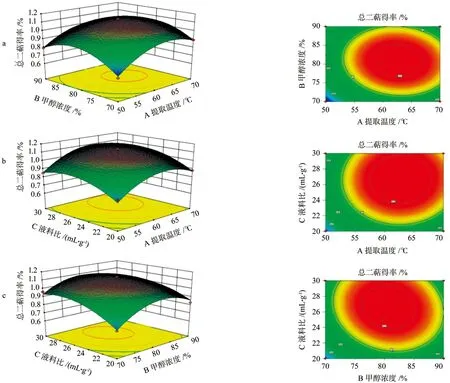
图3 不同因素对罗汉松总二萜得率的影响Fig.3 Response surface plots illustrating the mutual effects of factors on the yield of diterpenoids
再对回归模型进行进一步典型性分析,得到最佳提取工艺条件为提取温度为62.68 ℃、甲醇浓度80.46%、液料比26.34(mL/g),预测值为1.140 2%。为方便操作,将最优方案定为提取温度63.00 ℃、甲醇浓度80.00%、液料比26.00∶1(mL/g)。按最优方案中的条件进行验证试验,平行试验3 次,试验结果分别为1.14%、1.13%、和1.12%,取平均值 1.13%(RSD=0.89%)。验证试验结果与模型预测十分接近,表明试验拟合程度好,试验误差小,因此基于响应面法分析得到的优化提取工艺参数准确可靠,具有使用价值。
2.3 测定方法评价
2.3.1 精密度试验
取浓度为0.073 2 mg/mL 桃拓酚标准液,以无水甲醇为空白对照,按照1.2.1.5 的方法,连续测定6 次,记录数据,计算其RSD 值为0.2%,表明精密度良好。
2.3.2 重复性试验
按照1.2.1.1 的方法,参照响应面优化后的工艺条件制备样品,按照1.2.1.5 的方法,连续测定6 次,记录数据如表4,计算其RSD 值,结果见表4。由表4可知,该标准偏差为0.000 8,RSD 值为0.193 3%,呈现出良好的重复性。
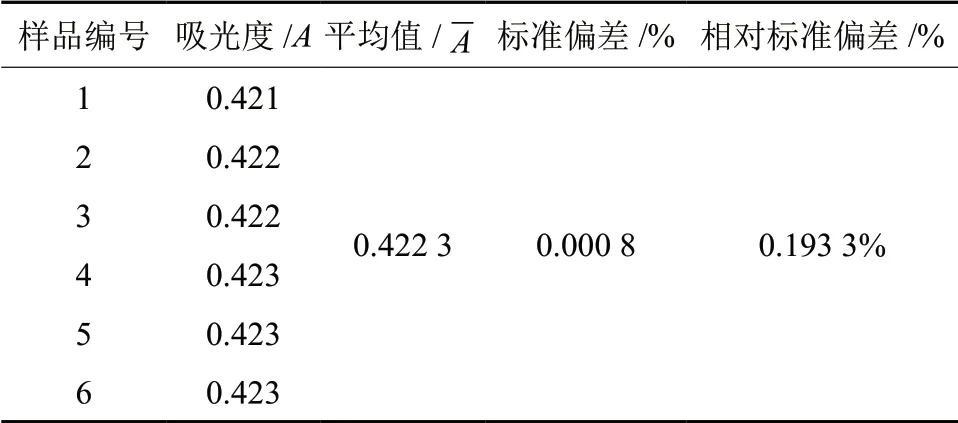
表4 重复性试验Table 4 Repeatability tests of the determination results
2.3.3 稳定性试验
按照1.2.1.1 的方法,参照响应面优化后的工艺条件制备样品,按照1.2.1.5 的方法,在120 min内定时测量其吸光度,记录数据,计算其RSD 值,结果见表5。由表5可知标准偏差为0.001 0,RSD值为0.235 3%,表明样品在2h 内检测稳定。
2.3.4 回收率试验
按照1.2.1.1 的方法,参照响应面优化后的工艺条件制备样品,分别量取10 mL 样品溶液,共6 份,每份加入1.2 mg 桃拓酚对照品,充分溶解,按照1.2.1.5 的方法,分别测定其吸光度,记录数据,并计算出混合后的总二萜含量以及RSD 值,结果见表6。由表6可知,RSD 值为0.266 5%,具有较高的回收率99.67%。
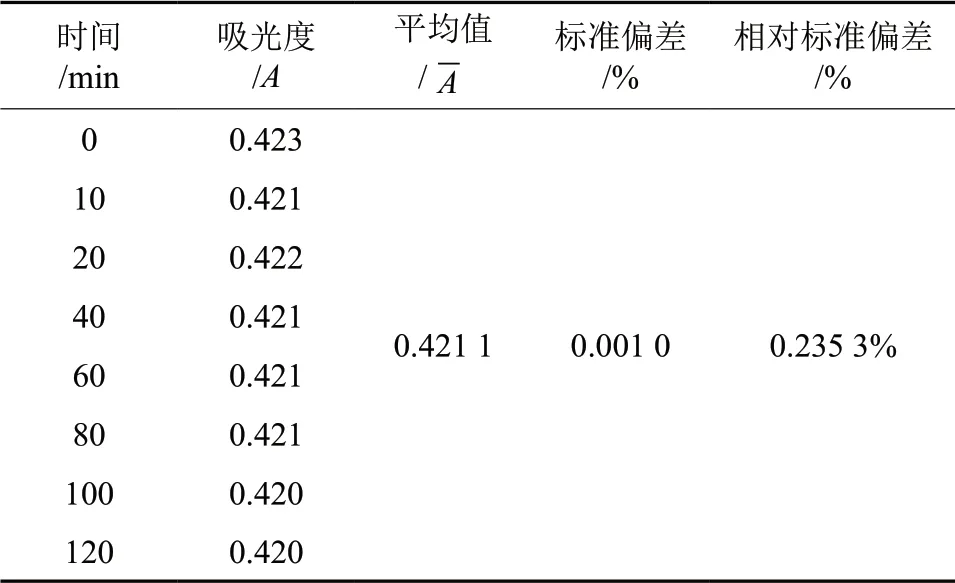
表5 稳定性试验Table 5 Stability tests of the determination results
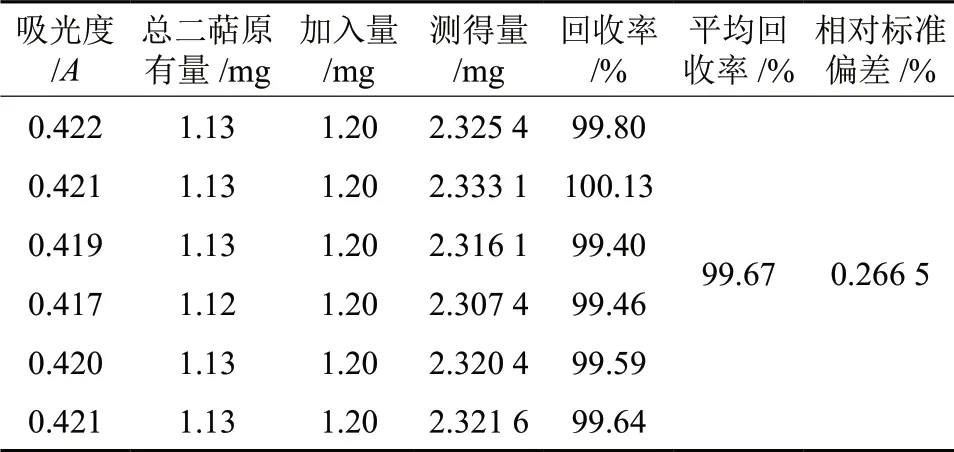
表6 回收率试验(n = 6)Table 6 Recovery tests of gallic acid (n = 6)
2.4 抗氧化活性测定
2.4.1 罗汉松总二萜清除DPPH 自由基能力
根据1.2.5.1的方法分别计算出罗汉松总二萜、Vc 对DPPH 自由基清除率,得到两种抗氧化剂的清除曲线,如图4所示。

图4 DPPH 自由基清除能力曲线Fig.4 Curve of DPPH scavenging rate
由图4可以看出,在试验设计质量浓度范围内,总二萜提取液对DPPH 自由基具有良好的清除能力,且清除能力随着溶液质量浓度的增加而增强。当质量浓度为0.59 mg/mL 时,总二萜提取液对DPPH 自由基的清除率达到了81.71%,而在试验设计质量浓度范围内,Vc 清除DPPH 自由基的能力始终强于总二萜提取液。通过拟合曲线计算总二萜提取物清除DPPH 自由基的IC50为0.28 mg/mL。
2.4.2 罗汉松总二萜清除羟自由基能力
根据1.2.5.2的方法分别计算出罗汉松总二萜、Vc 对羟自由基的清除率,得到两种抗氧化剂的清除曲线,如图5所示。
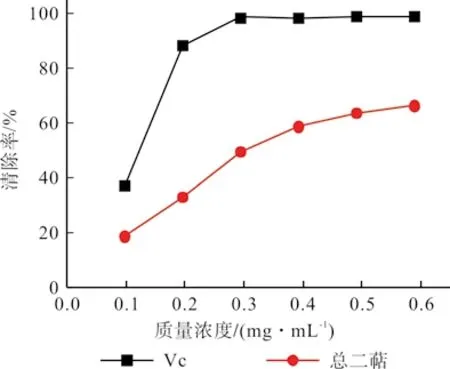
图5 羟自由基清除能力曲线Fig.5 Curve of hydroxyl free radical scavenging capacity
由图5可以看出,在试验设计质量浓度范围内,总二萜提取液对羟自由基的清除能力随着质量浓度的增加而增强,存在明显的量效关系。当质量浓度为0.59 mg/mL 时,总二萜提取液和Vc 对羟自由基的清除率分别为66.27%、98.87%,通过拟合曲线计算出两者的IC50分别为0.37 mg/mL、0.12 mg/mL。与Vc 相比,总二萜提取液对羟自由基的清除能力较弱。
2.4.3 罗汉松总二萜清除超氧阴离子能力
根据1.2.5.3的方法分别计算出罗汉松总二萜、Vc 对超氧阴离子的清除率,得到两种抗氧化剂的清除曲线,如图6所示。
由图6可以看出,在试验设计质量浓度范围内,总二萜提取液和Vc 对超氧阴离子具有不同程度的清除能力,且清除能力随着质量浓度的增加而增强,存在量效关系。当质量浓度为0.59 mg/mL 时,总二萜提取液和Vc 对超氧阴离子的清除率分别为38.60%、97.13%,总二萜提取液对超氧阴离子的清除能力明显弱于Vc,但仍有一定的清除活性。
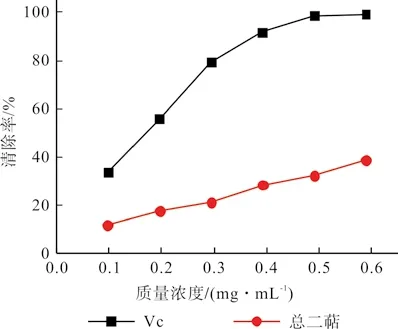
图6 超氧阴离子清除能力曲线Fig.6 Curve of superoxide anion radical scavenging capacity
3 结论与讨论
本研究在单因素试验的基础上,根据Box-Behnken 试验设计原理,通过响应面分析法对罗汉松总二萜提取工艺进行优化,通过分析试验结果得到,影响罗汉松总二萜得率的因素主次顺序为:提取温度(A)>液料比(C)>甲醇浓度(B),最佳提取条件为:提取次数3 次、每次20 min、提取温度63.00 ℃、甲醇浓度80.00%、液料比26.00∶1(mL/g),总二萜得率为1.13%,与预测值基本一致,说明该模型可靠性较高,能很好的预测各因素与得率间的关系。抗氧化活性试验结果表明,罗汉松总二萜对DPPH 自由基、羟自由基、超氧阴离子3 种自由基具有不同程度的清除能力,当质量浓度达到0.59 mg/mL 时,清除率分别为81.71%、66.27%、38.60%,抗氧化活性较好。苯基二萜除了具有良好的抗氧化活性外,还有着显著的抗肿瘤、抗病毒等活性[17],极具开发价值。本研究已初步证明罗汉松总二萜提取物具有良好的抗氧化活性,但总二萜的其他生物活性及单体二萜的纯化和生物活性有待进一步研究。

