宜昌百合胚性愈伤组织诱导及植株再生体系的研究
张 璐 潘远智 刘柿良 陈 源 申理嘉
(四川农业大学风景园林学院,成都 611130)
在组织培养中,离体再生有器官发生(organogenesis)和体细胞胚发生(somatic embryogenesis)两种途径。器官发生是指离体器官或组织上直接再生出不定芽或不定根和形成非胚性愈伤组织(non-embryonic callus)再生出不定芽或不定根从而形成完整植株的过程;体细胞胚发生是指植物体细胞脱分化直接诱导产生体细胞胚发育成完整植株,或形成胚性愈伤组织(embryonic callus)后,再通过类似于合子胚的发育方式再生为完整植株的过程[1]。体胚发生途径是目前植物实现无性繁殖的重要生物技术手段之一[2]。相对于器官发生方式来说,体细胞胚再生途径具有数量多、结构完整、再生率高的优点[3],同时也为基因转化、原生质体融合、超低温保存、人工种子的生产提供必要的技术前提。
近年来,利用百合体细胞胚发生方式建立植株再生体系的研究日益增多且研究对象主要是切花百合[4~7]。对于野生百合体细胞胚胎发生途径的研究却不多。目前通过体细胞胚发生途径获得再生植株的野生百合有麝香百合、龙牙百合、细叶百合和兰州百合等[8~10]。宜昌百合是我国特有野生种,具有耐性强、观赏度高等优良性状,是百合育种的优良亲本材料[11]。但其自然结实率低、繁殖系数小,因此它在自然条件下数量越来越少[12]。目前国内外对于宜昌百合组织培养的研究主要集中在不定芽发生和直接体细胞胚发生上,薛晓娜[12]以秦岭野生宜昌百合为研究对象,通过不定芽发生途径建立了其再生体系;孙安妮[3]以秦岭宜昌百合无菌苗的鳞片为试材,通过直接途径获得了体细胞胚胎,但增殖系数均不高。已有研究证明,通过建立高质量的胚性愈伤诱导体系,能够使体胚发生途径中获得的再生植株数量更多、遗传性质更加稳定[13]。而要建立高质量的胚性愈伤诱导体系,则与培养基中激素种类与质量浓度[14~16]、光暗培养条件息息相关,前人的研究表明麝香百合、平陆百合[8,17]适合光培养,东方百合[18]适合暗培养。但针对宜昌百合的相关研究未见系统、全面的报道。因此,本文采用宜昌百合鳞片为外植体,分别在光照和黑暗的培养条件下,采用不同激素种类与质量浓度配比的培养基,诱导胚性愈伤组织,通过间接体细胞胚胎发生途径建立其植株再生体系,通过石蜡切片对愈伤组织进行细胞学观察与鉴别,建立离体培养条件下的高效率和持续稳定的无性繁殖体系,以期为宜昌百合种质资源保存及遗传育种提供有益参考。
1 试验材料与方法
供试材料宜昌百合(Liliumleucanthum)采自四川省成都市龙泉山(104°19′E,30°32′N),经四川农业大学风景园林学院潘远智教授鉴定为宜昌百合。
1.1 外植体的选择与处理
选取“宜昌百合”鳞茎内层的干净鳞片,于流水下连续冲洗12 h后在超净工作台上用70%的酒精灭菌30 s,用无菌水冲洗4~5遍,然后用1 g·L-1的升汞溶液灭菌15 min,再用无菌水冲洗6~7遍。
1.2 胚性愈伤组织诱导
以MS为基本培养基,蔗糖30 g·L-1,琼脂6 g·L-1,培养基pH值5.8~6.0。将消毒好的鳞片切成0.5 cm×0.5 cm小块,分别接种于添加有不同质量浓度的TDZ、NAA、2,4-D的培养基中(表1)。每处理42块鳞片,重复3次。光照条件温度控制在(25±1)℃,光照14 h·d-1,光照强度1 600~2 100 lx。黑暗条件温度(20±1)℃,用黑色薄膜覆盖。35 d后统计胚性愈伤组织诱导率,观察愈伤组织形态及生长情况。
表1 宜昌百合诱导胚性愈伤组织试验因素水平表
Table 1 L9(34) orthogonal design for callus induction inL.leucanthum
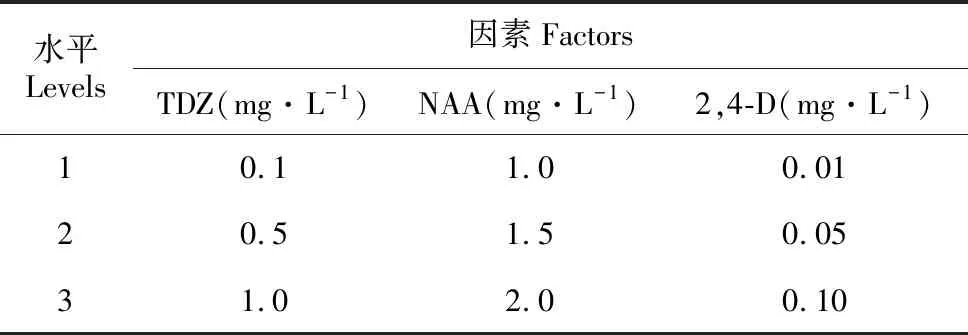
水平Levels因素FactorsTDZ(mg·L-1)NAA(mg·L-1)2,4-D(mg·L-1)10.11.00.0120.51.50.0531.02.00.10
1.3 愈伤组织切片观察与鉴别
选取不同类型的愈伤组织材料,置于FAA固定液中,经过固定→番红固绿染色→脱水→透明→浸蜡→包埋→切片贴片展片→脱蜡→封片等步骤,在OLYMPUS BX53上观察。
1.4 胚性愈伤组织的的分化培养
将胚性愈伤组织转移到MS+TDZ 0.5 mg·L-1+NAA 1.0 mg·L-1+2,4-D 0.05 mg·L-1,蔗糖30 g·L-1、琼脂6g·L-1的培养基上进行分化培养。温度控制在(25±1)℃,光照14 h·d-1,光照强度1 600~2 100 lx。
1.5 壮苗生根培养及炼苗移栽
取分化培养60 d后形成的小鳞茎进行壮苗及生根培养。以1/2MS为基本培养基,附加0、0.1、0.2、0.4、0.6、0.8、1.0 mg·L-1NAA和1 g·L-1AC(表2)。每种培养基接种10瓶,每瓶3苗。35 d后统计生根率。培养室温度控制在(25±1)℃,光照14 h·d-1,光照强度1 600~2 100 lx。
当再生植株长到4~7 cm且根系生长良好时进行炼苗,8~10 d后取出植株,用清水洗净根部琼脂,移栽至草炭∶蛭石∶珍珠岩=1∶1∶1基质中,确保湿度为70%~90%,温度20℃左右,35 d后统计成活率。
1.6 数据整理与统计分析
胚性愈伤组织诱导率(%)=产生胚性愈伤组织的外植体数/接种外植体总数
(1)
生根率(%)=生根小鳞茎数/接种小鳞茎总数
(2)
成活率(%)=成活的幼苗数/移栽幼苗总数
(3)
所得数据采用SPSS(19.0)和Excel软件进行处理分析。
2 结果与分析
2.1 激素浓度及其配比对宜昌百合愈伤组织诱导的影响
将消毒好的鳞片接种于正交试验设计的培养基中,统计结果见表2,方差分析结果见表3~4。
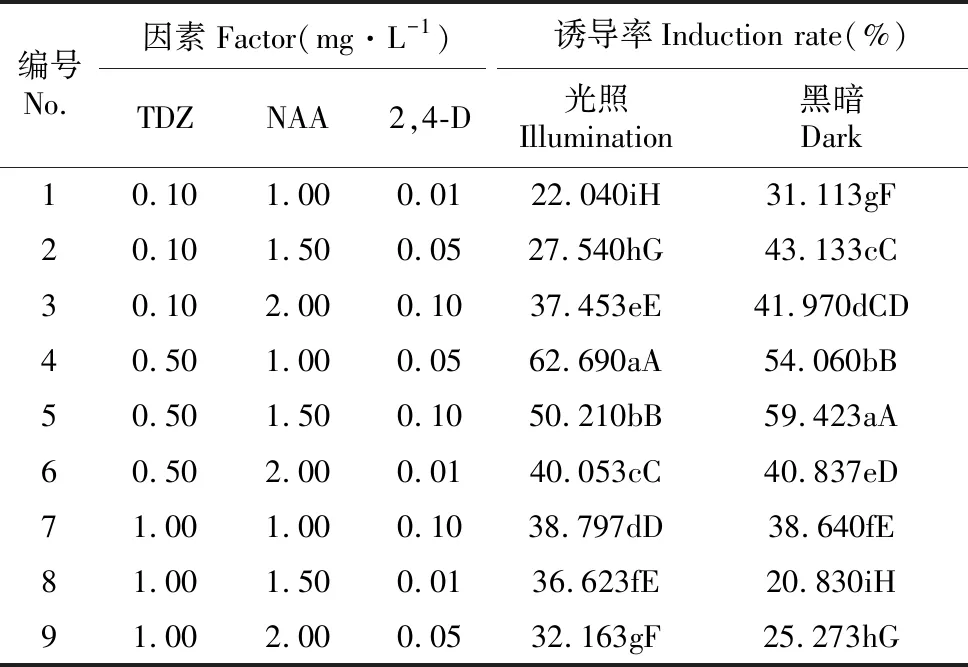
表2 宜昌百合愈伤组织诱导率
注:实际外植体数为除去污染的外植体总数;大写字母表示差异显著(0.05水平);小写字母表示差异极显著(0.01水平) 下同。
Note:The actual number of explant for total number of explant get rid of pollution;The different lowercase letters in the same column indicated the significant difference at 0.05;The different uppercase letters in the same column indicated the significant difference at 0.01 The same as below.
表3 宜昌百合愈伤诱导率的直观分析
Table 3 Audio-visual analysis for callus induction ofL.leucanthum
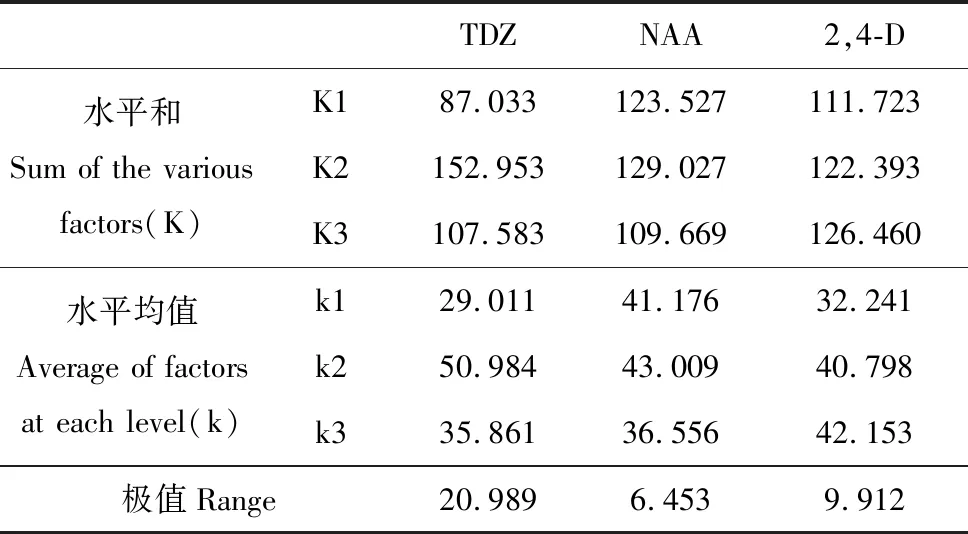
TDZNAA2,4-D水平和Sum of the various factors(K)K187.033123.527111.723K2152.953129.027122.393K3107.583109.669126.460水平均值Average of factors at each level(k)k129.01141.17632.241k250.98443.00940.798k335.86136.55642.153极值Range20.9896.4539.912
注:K.各因素在各个水平诱导率的总和;k.各因素在各个水平的平均值;R.极差 下同。
Note:K.Sum of the various factors in each level; k.Average of factors at each level; R.Indicate range The same as below.
表4 宜昌百合平均诱导率方差分析
Table 4 Variance analysis for average induction rate ofL.leucanthum
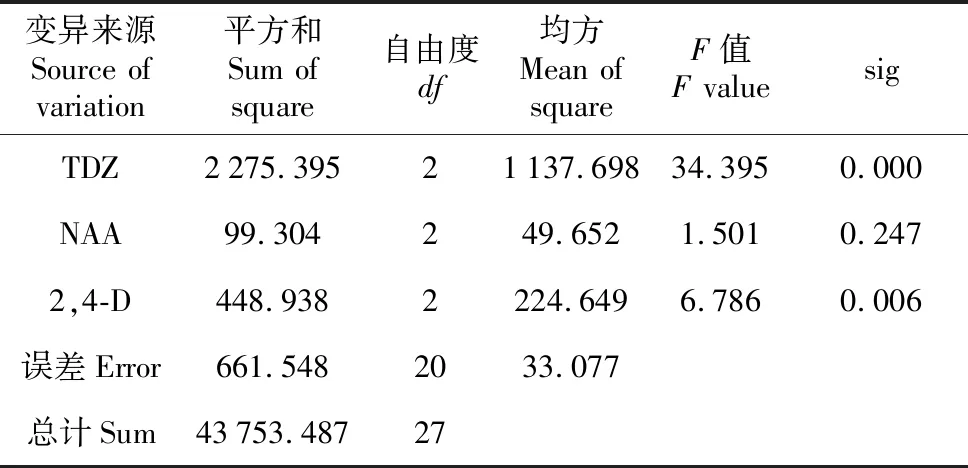
变异来源Source of variation平方和Sum of square自由度df均方Mean of squareF值F valuesigTDZ2275.39521137.69834.3950.000NAA99.304249.6521.5010.2472,4-D448.9382224.6496.7860.006误差Error661.5482033.077总计Sum43753.48727
2.1.1 光照条件下激素质量浓度及其组合对宜昌百合愈伤组织诱导的影响
宜昌百合鳞片接种后于光下培养,由表3~4可得TDZ、NAA、2,4-D的极差分别是21.937、4.175、14.437。说明TDZ对宜昌百合愈伤组织的诱导作用最大,NAA的诱导作用最小。由此可见,本试验中3种激素对宜昌百合愈伤组织诱导作用大小关系依次是TDZ>2,4-D>NAA。不同浓度TDZ、2,4-D对宜昌百合愈伤组织诱导率有极显著差异(P<0.01),NAA对宜昌百合愈伤组织诱导作用差异不明显(表4)。综合可得在光照条件下,诱导宜昌百合愈伤组织的最佳培养基组合为MS+TDZ 0.5 mg·L-1+NAA 1.0 mg·L-1+2,4-D 0.05 mg·L-1。光照条件下,在此培养基中培养10 d后,鳞片膨大,表面形成黄绿色、颗粒状排列紧密的愈伤组织,并且愈伤组织表面出现透明突起(图1:A~B)。40 d后,有体胚苗形成(图1:C)。
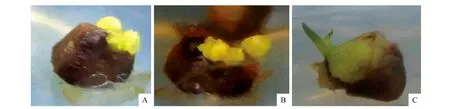
图1 光照条件培养10和40 d后愈伤组织生长状况 A-B.培养10 d后,鳞片膨大,表面形成黄绿色、排列紧密的颗粒状的愈伤组织;C.培养40 d后,愈伤组织上分化成苗Fig.1 Callus growth after cultivating for 10 and 40 d in light condition A-B.After Training 10 d,the scale expands,the surface yellow-green,granular callus of closely packed;C. training after 40 d,callus tissue differentiation into seedlings

图2 黑暗条件培养10和40 d后愈伤组织生长状况 A.培养10 d后,鳞片膨大,表面形成愈伤组织;B.40 d后愈伤组织明显增殖Fig.2 Callus growth after cultivating for 10 and 40 d in the dark condition A.After cultivating for 10 d,scales enlargement,surface form callus; B.After cultivating for 40 d,callus proliferation significantly
2.1.2 黑暗条件下激素质量浓度及其组合对宜昌百合愈伤组织诱导的影响
宜昌百合鳞片接种后于黑暗下培养,由表5可知,TDZ、NAA、2,4-D的极差分别是22.429、11.244、15.751。说明NAA对愈伤组织的诱导作用最小,各激素诱导作用大小依次分别是TDZ>2,4-D>NAA。由表6可见, 不同浓度的3种激素对宜昌百合愈伤组织诱导率都是极显著(P<0.01),综合可得,黑暗条件下,诱导宜昌百合愈伤组织的最佳培养基组合为MS+TDZ 0.5 mg·L-1+NAA 1.5 mg·L-1+2,4-D 0.1 mg·L-1。黑暗条件下,在此培养基中培养10 d后,鳞片膨大,表面形成黄色絮状排列紧密的愈伤组织,并且愈伤组织表面出现白色透明突起(图2:A)。40 d后,愈伤组织呈黄色,增殖良好,基本覆盖整个鳞片(图2:B)。
表5 宜昌百合愈伤诱导率的直观分析
Table 5 Audio-visual analysis for callus induction ofL.leucanthum
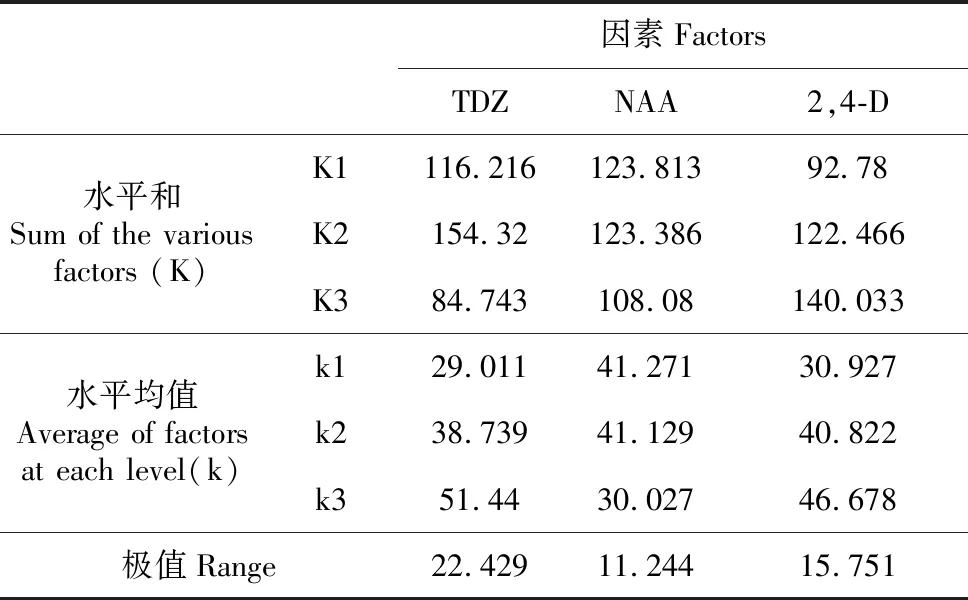
因素FactorsTDZNAA2,4-D水平和Sum of the various factors (K)K1116.216123.81392.78K2154.32123.386122.466K384.743108.08140.033水平均值Average of factors at each level(k)k129.01141.27130.927k238.73941.12940.822k351.4430.02746.678极值Range22.42911.24415.751
表6 宜昌百合愈伤组织平均诱导率方差分析
Table 6 Variance analysis for average induction rate ofL.leucanthum
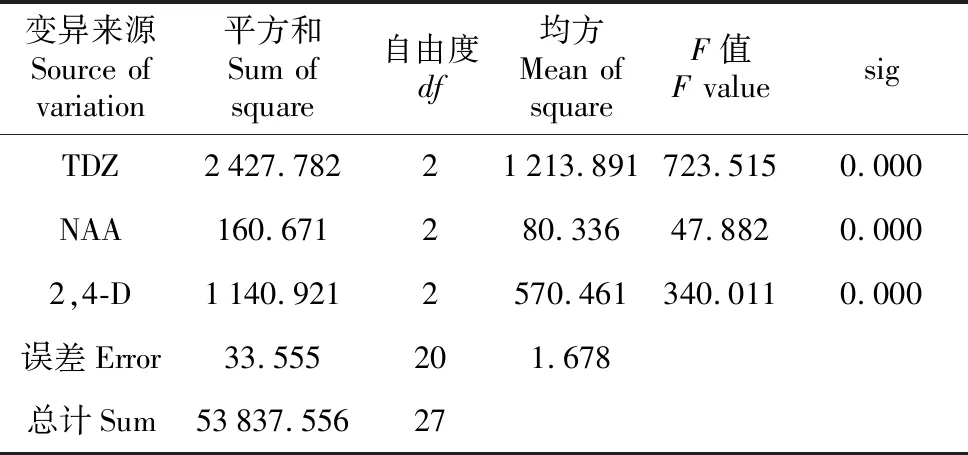
变异来源Source of variation平方和Sum of square自由度df均方Mean of squareF值F valuesigTDZ2427.78221213.891723.5150.000NAA160.671280.33647.8820.0002,4-D1140.9212570.461340.0110.000误差Error33.555201.678总计Sum53837.55627
2.2 不同类型愈伤组织形态学差异及其分化
2.2.1 不同愈伤组织的形态学差异
通过形态学观察,愈伤组织主要分为两种不同类型:一种是黄绿色致密、表面分布有颗粒状或瘤状半透明突起的愈伤组织,另一种为深绿色、疏松易碎、呈水渍状的愈伤组织(图3:A)。石蜡观察发现:前者愈伤组织由胚性细胞(EC)和非胚性细胞(NEC)组成,胚性细胞体积小且排列紧密,显微测距显示其直径在50~80 μm,细胞核大、细胞质浓、染色较深、且细胞内有大量淀粉粒积累(图3:B,D)。非胚性细胞较大,直径100~180 μm,未见明显细胞核或细胞核小,细胞高度液泡化(图3:C,E)。
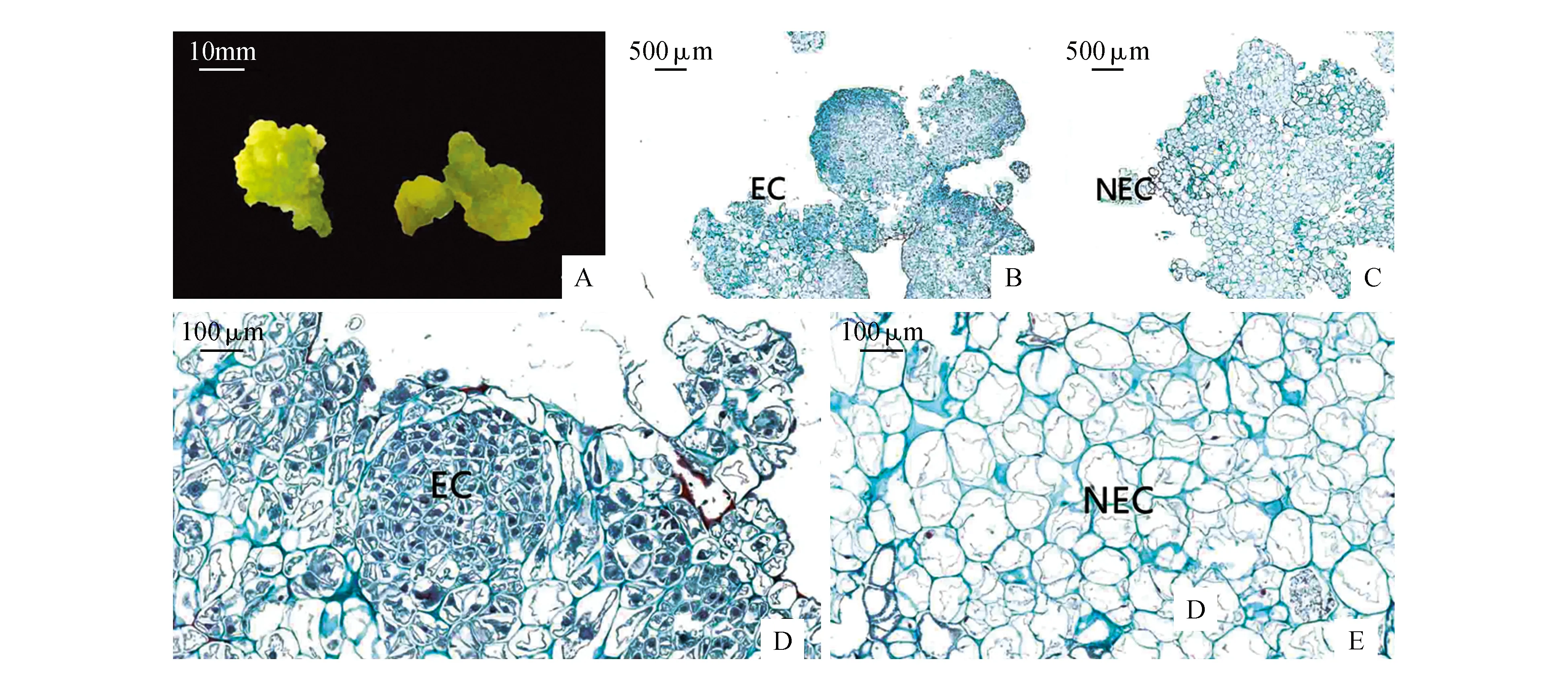
图3 不同类型愈伤组织形态学及组织学观察 EC.胚性细胞;NEC.非胚性细胞Fig.3 Tissue paraffin section and morphology observation of different types of callus EC.Embryonic cell;NEC.Nonembryonic cell

图4 分化培养时体胚苗的生长情况Fig.4 Differentiation culture in different periods of the embryo seedlings growth
形态学观察的基础上,结合石蜡切片的组织学观察,进一步确认宜昌百合的鳞片作为外植体,光照培养条件下,在MS+TDZ 0.5 mg·L-1+NAA 1.0 mg·L-1+2,4-D 0.05 mg·L-1培养基中,胚性愈伤组织诱导率最高。
2.2.2 胚性愈伤组织的分化培养
将胚性愈伤组织转入分化培养基培养15 d后,愈伤组织表面浅黄色颗粒状明显,并有胚状体出现(图4:A)。第30 d时,愈伤组织表面呈深绿色(图4:B),胚状体数量增多。45 d时,愈伤组织颜色变为浅黄色,疏松易碎,其表面生长了很多完整植株,并且与愈伤组织相对独立,易于剥离(图4:C),石蜡切片观察到体胚苗与愈伤组织相对独立,产生生殖隔离(图4:E)。第60 d时,将小植株剥离愈伤组织后,发现根尖已出现腐烂的情况,颜色为褐色(图4:D)。
2.3 壮苗生根与移栽
选取生长一致的体胚苗进行壮苗生根,结果表明,在不添加生长激素的空白对照的培养基中,生根率在70%以上,其他附加不同质量浓度NAA的培养基中成苗率达80%以上(图5,表7)。但从生长情况来看,具有明显差异。在4、5号培养基中,小鳞茎基部产生大量愈伤组织,根系短且根毛呈簇团状生长。在2号培养基中,鳞茎生长良好,鳞茎基部无愈伤组织产生,根系粗壮发达,根毛茂盛,根长且壮,最长根达到10.55 cm,根毛较多,基部无愈伤,生根率高达100%,且整个植株生长健壮。故用该培养基作为宜昌百合壮苗生根培养基。生根培养35 d后,将小苗移入草炭∶蛭石∶珍珠岩=1∶1∶1的混合基质中,成活率达90%(图6)。

图5 不同浓度NAA处理后宜昌百合小鳞茎生长情况Fig.5 Bulblet of L.leucanthum after different concentrations of NAA processing

图6 草炭、蛭石、珍珠岩混合基质中生长的移栽苗Fig.6 Transplanting seedlings growing in mixed matrix of peat,vermiculite and pearlite
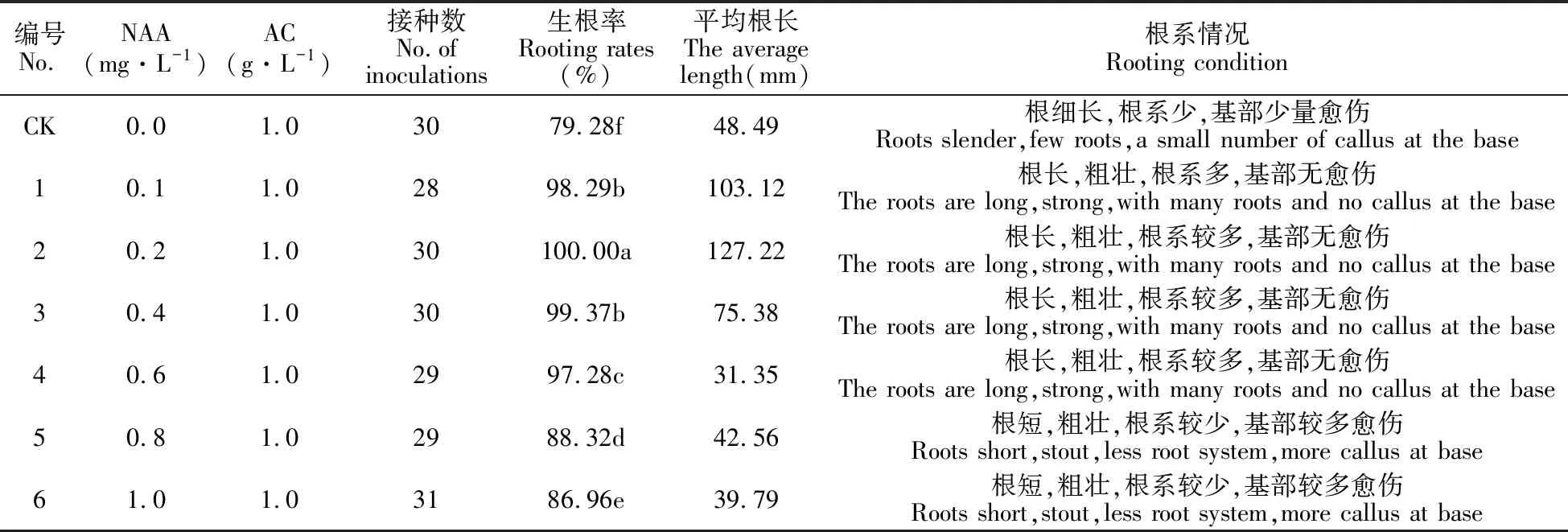
表7 AC和不同质量浓度NAA对宜昌百合壮苗生根的影响
注:同列中不同小写字母表示处理间在0.01水平上差异极显著。
Note:Different lowercase letters indicate that there is a significant difference between the 0.01 level.
3 讨论
激素种类与质量浓度是影响胚性愈伤组织发生的诸多因素中最关键的,在百合的愈伤组织诱导中通常使用的生长调节剂有2,4-D、NAA、TDZ、PIC等。其中TDZ是被广泛用于体细胞胚诱导的高效生长调节剂,Capelle等[19]的研究表明TDZ诱导愈伤组织生长的速率是其他植物生长调节剂的30倍。它兼有生长素与分裂素的双重作用。本研究中,宜昌百合胚性愈伤组合的诱导率主要受到TDZ质量浓度的影响,在一定范围内(0.1~0.5 mg·L-1),诱导率随着浓度的升高而升高。当浓度高于1.0 mg·L-1时,愈伤组织的发生受到抑制,诱导率显著下降,这与张翔宇[20]的研究结果一致。Muhammad[21]在对柚木愈伤诱导的实验中发现,TDZ中浓度(0.1、1 μmol·L-1)下愈伤组织诱导率达到100%。本研究中较适宜的TDZ浓度为0.5 mg·L-1。2,4-D对愈伤组织的诱导具有双重效应,低浓度能够促进鳞片外植体产生愈伤组织,而高浓度又抑制胚性愈伤组织形成体细胞胚,或者会引起体细胞无性系变异[1]。适宜浓度的2,4-D的添加能有效地促进胚性愈伤组织的形成。杨柏云[9]发现影响龙牙百合体细胞胚胎发生方式的关键因素是2,4-D,当2,4-D浓度低于0.5 mg·L-1时,体细胞胚以直接方式发生,当2,4-D浓度适中时,体细胞胚以间接方式发生。此现象在其他百合种中也十分普遍,如绿花百合[22]、西伯利亚百合[23]等。本试验中2,4-D质量浓度为0.05 mg·L-1时配合另两种激素使用对胚性愈伤组织的形成具有明显的促进作用。NAA作为生长素能促进细胞的分裂和扩大,因此在愈伤组织的诱导和分化中起着必不可少的作用,林娅[24]等人在研究蔷薇愈伤组织诱导和分化的试验中发现,当愈伤组织发生后立即去掉生长素会导致其停止生长和分化,并逐渐死亡。实验结果表明,最适宜诱导宜昌百合胚性愈伤组织的培养基为MS+TDZ 0.5 mg·L-1+NAA 1.5 mg·L-1+2,4-D 0.1 mg·L-1。
光照条件影响愈伤诱导率,一般而言,黑暗条件有利于愈伤组织的诱导,光照条件有利于愈伤组织分化成苗,张艺萍[19]等研究发现暗培养东方百合愈伤组织更易形成。任建宏[18]等对平陆百合的研究中发现光照条件下愈伤组织诱导率更高,推测可能与百合品种有关。王杰[8]等研究发现光培养对麝香百合胚性愈伤组织长势、体积增长、增殖系数有显著的促进作用。高永超[25]等研究认为光照条件下能诱导产生促进愈伤组织形成的相关内源激素。本研究中,在光照条件下,宜昌百合胚性愈伤组织的诱导率更高,与王杰、高永超等人的研究结果一致。胚性愈伤组织在进一步分化培养形成小植株的过程中,根部生长不良甚至变黄萎蔫。推测原因可能是培养基中含有NAA有利促进了胚状体的前期发育,但到后期,2,4-D,TDZ等分裂素又抑制了根的进一步发育。因此,诱导体胚苗生根是获得完整再生植株的重要环节[26],适宜的生长素种类和浓度是促进体胚苗正常生根的重要条件。有研究表明,高生长素浓度下,幼苗生根时会产生大量愈伤,从而影响移栽成活率[27]。本研究中,当NAA浓度较低时,植株矮小,根细长易断。而NAA浓度较高时,鳞茎基部大量愈伤,移栽后根易腐烂,严重限制了移栽成活率。因此,适宜宜昌百合小鳞茎生根培养基为1/2MS+NAA 0.2 mg·L-1+AC 1 g·L-1,而李伟[27]对西葫芦胚状体生根培养、孔凡芹等[28]对楤木壮苗和生根培养研究中认为培养基中添加0.1 mg·L-1NAA诱根效果最好。分析原因一是由于植物基因型差异所导致的[29];二是内源激素有所差异的原因[30]。
胚性愈伤组织及体胚发生过程不仅是胚性愈伤组织形成及体细胞胚的发生过程不仅是细胞分裂和外部形态上的变化,更重要的是内部组织细胞的不断分化和发育[31]。对于胚性愈伤组织的观察,不同植物,甚至同一植物不同品种的描述不尽相同,涂红艳等[32]发现在白姜花的愈伤组织诱导过程中,发现三类愈伤:一类浅黄色松散易碎,具有胚性细胞的特征;一类白色疏松半透明,呈水渍状,为典型的非胚性细胞状态;还有一类黄色致密颗粒状,镜检发现其介于胚性细胞核非胚性细胞之间。曹雨等[33]观察发现墨西哥玉米草胚性愈伤组织呈嫩黄色致密状态,表面有一层粘液包裹,非胚性愈伤组织生长缓慢,易褐化。袁雪等[34]试验中观察到铁炮百合非胚性愈伤组织白色,致密且坚硬,无颗粒状;薛冰洋[10]在研究兰州百合和细叶百合的体细胞胚发生时发现培养6 d的百合鳞片,少量细胞变得密集,与周围细胞相比细胞形状较小且狭长,核仁明显,染色深,且细胞中的淀粉粒要比培养3 d时的淀粉粒数量多,说明淀粉粒的积累是胚性细胞开始的物质基础。本研究中发现宜昌百合愈伤组织主要以2种形态混合存在组培条件下,其中一种类型是胚性愈伤组织黄绿色或深绿色,颗粒状明显,另一种是非胚性愈伤组织,其松散易碎、呈水渍状;经石蜡切片观察可观察到胚性愈伤组织细胞核大、胞质浓,且细胞内含丰富淀粉,细胞直径为50~80 μm。非胚性愈伤组织细胞较大,未见明显细胞核,直径为100~180 μm。40 d后,将胚性愈伤组织移至新鲜的诱导培养基中可大量分化出小鳞茎。本研究以宜昌百合鳞片为外植体,通过不同激素种类和浓度的组合进行正交试验,诱导愈伤组织。通过石蜡切片技术辅助观察确定了诱导胚性愈伤组织的最佳培养基为MS+TDZ 0.5 mg·L-1+NAA 1.5 mg·L-1+2,4-D 0.1 mg·L-1。在此基础上系统地建立了高效的百合体胚间接再生体系。大量研究证明,与不定芽发生相比,体胚发生来源于单细胞,具有遗传稳定,数量多,适于外源基因转化受体系统等优点。然而,在长期的继代或在特定激素诱导条件下,细胞伸长和分裂加速,胚性细胞团可能会很快减少,最终失去体胚发生的潜能,因此,对于宜昌百合在愈伤组织再分化过程中的胚性保持、体胚发生过程中的有关机理有待进一步研究。

