天然次生林植物叶片生态化学计量特征及光合特性对长期N沉降的响应
万雪冰 王庆贵 闫国永 邢亚娟
(黑龙江大学农业资源与环境学院,哈尔滨 150080)
截至目前,由于全球气候变化和人类活动引起的大气N沉降浓度升高已经成为不争的事实,并已引起各国学者广泛关注[1]。就中国而言,其N沉降速度在1980~2010年期间,平均每年以0.08 g·m-2的量持续增加[2],已经成为继美国,欧洲之外的第三大N沉降区[3]。N沉降量在中国南北差距较大,在南方有些区域N沉降量已高达63.53 kg·hm-2·a-1[4]。相比之下,我国东北和青藏高原地区N沉降量较小,但我国N沉降量至今依然在攀升。由于人类活动引起的N输入已经成为生态系统中N元素的重要来源[5],N沉降的增加将不可避免地对森林生态系统物质循环和能量流动产生深远的影响,亟待开展深入研究。
N沉降影响着森林生态系统养分循环的整个过程,尤其是养分在植物体内的分配转移和再吸收[6]。一些野外试验结果显示,N添加会显著增加乔木优势种的叶片N含量,并且改变叶片P含量导致化学计量比发生变化[7~8],致使叶片营养元素失衡。也有研究发现,N沉降会通过降低植物的C∶N,提高植物的C∶P和N∶P,改变土壤养分状况,进一步改变鲜叶的养分再吸收机制从而影响凋落叶的分解[9~13]。N沉降还会通过增加生态系统的N输入,影响群落的化学计量特征[14~15]。化学计量学作为一种可靠的手段能准确解释消费者驱动的养分循环和生态系统养分供应、需求的平衡,阐明陆地生态系统植被对碳、氮的吸收及释放机制,并揭示元素相互作用和制约变化规律[16]。因此通过化学计量手段研究对植物凋落叶和鲜叶的养分吸收和释放机制,具有重要意义[17]。
大量研究结果表明N作为植物体内核心组成元素是植物生长、发育过程的重要参与者,也是陆地生态系统初级生产力的主要限制因子,因此外源N输入大小直接影响植物各器官对N素吸收和转移,进而影响植物光合特性[18]。一般而言,增N会提高鲜叶的净光合速率(Pn)[19],也有学者认为无相关性[20],认为这种关系随叶片原有N含量、光合N利用效率(PNUE)等因素的改变而变化。在植物叶片比叶重(LMA)较高的情况下,其具有较高的细胞壁组份和C含量,但叶片水分和N含量较低,因此认为叶片N含量(Nc)与LMA呈负相关关系[21~22],但也有研究表明植物叶片三者(Pn、LMA、Nc)之间均无显著相关性[20]。总体而言,外源N输入在不同气候带、不同树种、不同林型植物体内化学计量特征也不尽相同,至今未能得出统一的结论[14~15]。由此可见,长期施N条件下,植物叶片的养分调控机制和生理光合特性还需进一步研究。
国内关于N沉降对植物生态化学计量特征和光合特性的研究主要集中在亚热带森林生态系统以及西北荒漠生态系统和草原生态系统[20~21,23~26],有关长白山地区天然次生林化学计量特征和光合特性对N沉降响应的研究未见系统报导。由于长白山地区独特的地理气候条件,加之天然次生林占主导地位,对该区域碳循环起重要影响。此外,天然次生林对于维持和提高生态环境效益方面也起到不可忽视的作用[27]。鉴于此,本研究采取长期N添加试验,以长白山天然次生林两种先锋树种作为试验对象,旨在分析N沉降对两种植物叶片化学C、N、P生态化学计量特征的变化以及对其生长和光合特性的影响机制,为未来大气N沉降持续增加背景下天然次生林植物养分获取和光合作用的响应机制提供基础数据。
1 材料与方法
1.1 试验地点
试验样地位于吉林省白山市抚松县露水河林业局(42°82′49″N,128°85′45″E)。海拔920 m,属典型季风性气候,冬季寒冷干燥,春、秋季短暂而干燥,夏季潮湿温暖。年平均气温和降水量分别为2.78℃和871.6 mm。土壤为山地深棕色森林土壤,基岩为覆盖着砾石和黄土的花岗岩,上层主要为黄土。属于天然次生阔叶林,主要树种有白桦(B.platyphylla)、山杨(P.davidiana)、加杨(P.koreana),伴有散生的水曲柳(Fraxinusmandschurica)、红松(Pinuskoraiensis)、色木槭(Acermono)、簇毛槭(A.barbinerve)、旱柳(Salixmatsudana)、枫桦(B.costata)、榆树(Ulmusjaponica),平均树龄约40年。主要灌木树种是珍珠梅(Sorbariasorbifolia)、东北山梅花(Philadelphusschrenkii)、五味子(Schisandrachinensis)、溲疏(Deutziascabra)、卫矛(Euonymusalatus)。
1.2 试验设计
试验样地中共设置了9个30 m×30 m的样方,样方间设置20 m缓冲带,并用聚乙烯塑料板隔断,以防样地间土壤径流引起的氮互通。试验设置3个N添加梯度,分别为0、2.5、5.0 g·N(m-2·a-1),以NH4NO3为外施N源,用于模拟研究当地未来大气N沉降浓度升高1和2倍情况下对植物叶片化学计量特征的影响[28]。样地于2006年5月开始模拟N沉降试验,每年施N从5月开始到9月结束,分5个月份平均喷施。为排除水分的差异,对照地喷施等量纯净水。
1.3 样品采集和指标测定方法
在2017年7月28日(天气晴朗),在样方内,用(CI-340便携式光合作用测定仪,America)对山杨、白桦鲜叶进行净光合速率(Pn,μmol·m-2·s-1)测定,选用标准光源,控制光强为1 600 μmol·m-2·s-1。测定时根据不同层次(高、中、低)、不同方位(东、西、南、北)用高枝剪剪下树枝,选取成熟完整的新鲜叶片(每株4片)[29],从8:30开始测定,每个处理测定7~8个重复,每个新鲜叶片待光合仪数据显示稳定后重复计数5~8次。叶片温度控制在24℃,相对湿度为65%,开放式气路,测量过程保持大气CO2浓度。所有测定工作在2 h之内完成。
叶片气体交换数据测定后,立即将所测定的鲜叶摘下,并且在样方凋落物筐内多点采集同期凋落叶,然后进行分类。采集的样品质量为30 g左右。将采集回的新鲜叶片立刻用(CanonLide 120,Japan)扫描仪完成图像扫描,扫描完成的图像采用(WinRHIZO,America)软件进行分析,直接获取叶面积数据。随后将鲜叶在烘箱里105℃下杀青15 min,然后置于65℃烘箱内烘干至恒重后用电子天平称重,比叶重LMA(g·cm-2)=叶片干重/叶面积。
已称重鲜叶、凋落叶用粉碎机粉碎、过筛,用TOC/TN分析仪(Multi N/C 3100,Analytikjene AG,Germany)灼烧测得样品全C含量。选取3mg采用H2SO4-HCIO4法[30],用TOC/TN分析仪(Multi N/C 3100,Analytikjene AG,Germany)测得样品全N含量。使用钼锑抗比色法测定样品全P含量[31]。
光合氮利用效率:
PNUE=Pn/(Nc×LMA)
(1)
式中:Nc为叶片N含量,LMA为比叶重。
养分重吸收率用凋落叶和鲜叶中养分浓度的百分之差来估算[18],可按下式计算:
R%=(T叶-T枯)/T叶×100
(2)
式中:R为养分重吸收率;T叶为正常生长鲜叶中养分含量(mg·g-1);T枯为凋落叶中养分含量(mg·g-1)。
1.4 数据分析
用Excel 2013(Microsoft Corporation,Redmond,WA)进行数据整理。用SPSS20.0(SPSS Inc.,Chicago,IL,USA)进行数据分析,采用单因素方差(One-way ANOVA)分析不同施N处理对植物叶片养分含量、光合特性以及养分重吸收率的影响,显著性水平设为P=0.05,采用相关性分析计算两种叶片养分、养分再吸收率及化学计量比的相关性,利用Oringe 8.5和SPSS20.0(SPSS Inc.,Chicago,IL,USA)绘图。
2 结果与分析
2.1 不同施N水平下植物鲜叶、凋落叶C、N、P含量及化学计量比的变化
由测定结果可知, 模拟N沉降处理下白桦和山杨鲜叶的C含量较对照均无显著影响。白桦鲜叶C含量在513.99~523.04 mg·g-1,山杨鲜叶的C含量在461.06~472 mg·g-1,两种植物鲜叶C含量整体表现为白桦>山杨,差异显著(P<0.05)(图1:A)。白桦鲜叶的N含量在11.43~12.73 mg·g-1,表现出随施N浓度增大而增加的趋势,HN显著增加了白桦鲜叶的N含量(P<0.05),N含量变幅为11.22%~12.76%,HN处理的是LN的6.12倍;山杨鲜叶N含量在9.30~9.93 mg·g-1,LN处理下N含量显著低于CK处理(P<0.05),降幅为2.79%,HN处理与CK和LN两个处理间均无显著差异,两种植物鲜叶N含量整体表现为白桦>山杨,差异显著(P<0.05),施N梯度下两种植物鲜叶之间C、N含量差异显著(P<0.05)(图1:B)。白桦鲜叶P含量在1.08~1.11 mg·g-1,LN处理下相较CK处理时增加,但不显著;HN处理P含量相较LN处理显著下降(P<0.05),降幅为8.7%;山杨鲜叶的P含量在0.92~1.03 mg·g-1,LN处理时P含量相较CK处理显著下降(P<0.05),降幅为10.8%,HN处理下P含量相较LN增加,但无显著影响,CK和LN处理下两种鲜叶之间有显著差异(图1:C)。同一施N浓度处理下,同一树种植物鲜叶的C、N、P含量没有表现出明显的规律性(一致的)变化。
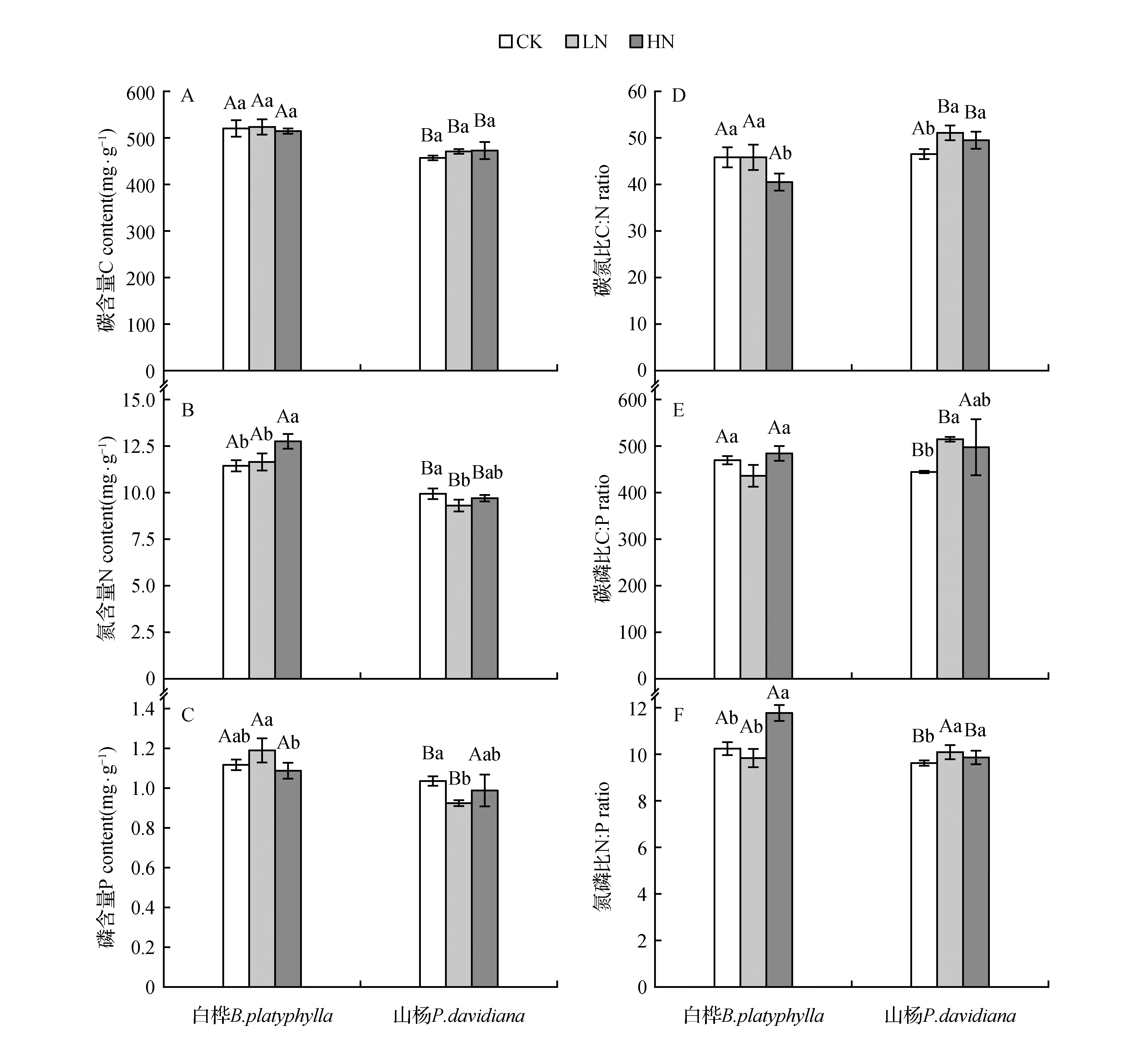
图1 N添加对白桦、山杨鲜叶养分含量变化的影响 CK.对照处理;LN.低氮处理;HN.高氮处理 不同大写字母表示不同树种在施N处理下的差异显著;不同小写字母表示同一树种在不同施N梯度处理间养分含量差异显著(P<0.05)。下同。Fig.1 Effects of N addition on nutrient content of fresh leaves of B.platyphylla and P.davidiana CK.Comparison treatment;LN.Low nitrogen deposition treatment;HN.High nitrogen deposition treatment Different capital letters indicate that different species differ significantly under N application. Different lowercase letters indicate significant differences in nutrient contents between different N gradient treatments for the same species(P<0.05).The same as below.

图2 N添加对白桦、山杨凋落叶养分含量变化的影响Fig.2 Effects of N addition on nutrient content of litter leaves of B.platyphylla and P.davidiana
LN处理下白桦鲜叶的C∶N相较CK处理无显著影响,HN处理下C∶N(40.59∶1)显著低于CK处理(45.59∶1)(P<0.05);山杨鲜叶的C∶N相较CK(46.19∶1)处理来说,在LN(50.77∶1)和HN(49.17∶1)处理下均显著增加(P<0.05),变幅为46.39%~51.13%,其中LN处理是HN的1.54倍,在LN和HN处理下,两种鲜叶之间的C∶N有显著差异(P<0.05)(图1:D)。白桦鲜叶的C∶P相较CK(467.34∶1)处理,在LN(434.39∶1)处理下显著下降(P<0.05),降幅为7.05%,HN处理相较CK处理无显著影响,相较LN处理显著增加(P<0.05),增幅为11.09%;而山杨的C∶P相反,相较CK(442.90∶1)处理,在LN(512.97∶1)处理下显著增加(P<0.05),增幅为15.82%,HN(495.91∶1)处理相较LN处理下降,但不显著,在CK和LN处理下,两种鲜叶之间的C∶P有显著差异(P<0.05)(图1:E)。白桦鲜叶的N∶P相较CK(10.26∶1)处理,在LN(9.84∶1)处理下降低,差异不显著,在HN(11.77∶1)处理下显著增加(P<0.05),增幅为14.75%;山杨鲜叶的N∶P相较CK(9.62∶1)处理,在LN(10.11∶1)、HN(9.86∶1)处理下均显著增加(P<0.05),其中LN处理的增幅是HN处理的2.02倍,LN和HN处理之间无显著影响,并且在CK和HN处理下,两种鲜叶之间的N∶P有显著差异(P<0.05)(图1:F)。
白桦凋落叶C含量在495.33~514.23 mg·g-1,山杨凋落叶的C含量在496.25~503.76 mg·g-1,山杨凋落叶CK处理的C含量显著低于白桦C含量(P<0.05),其余各施N处理均无显著差异(图2:A)。N添加显著增加了白桦和山杨凋落叶的N含量(P<0.05),呈现出随施N浓度增加N含量增加的趋势,变幅分别为10.71%~12.85%和11.37%~15.37%,其中,白桦HN处理的是LN的1.95倍,山杨HN处理的是LN的1.5倍(图2:B)。白桦和山杨凋落叶中P含量相较CK处理,在LN处理下均显著增加(P<0.05),白桦增幅是山杨的2.27倍;HN处理下仅山杨P含量显著下降(P<0.05),两种植物凋落叶P含量呈现出随施N浓度的增大先增加后下降的趋势(图2:C)。除CK处理外,两种植物之间凋落叶的N、P含量均存在显著差异(P<0.05)。
白桦和山杨凋落叶之间的C∶N存在显著差异(P<0.05),并且均呈现出随N素添加显著下降的趋势(图2:D)。白桦凋落叶的C∶P相较CK处理,在LN处理下显著下降(P<0.05),HN处理下显著增加(P<0.05);山杨凋落叶的C∶P相较LN处理,在HN处理下显著增加(P<0.05)(图2:E)。白桦凋落叶HN处理的N∶P显著高于CK和LN处理(P<0.05),CK和LN处理间无显著影响;山杨凋落叶的N∶P随施N浓度增大而显著增加(P<0.05),HN处理的增幅是LN处理的2.76倍,除CK处理外,两种植物之间凋落叶的N∶P存在显著差异(P<0.05)(图2:F)。
2.2 白桦、山杨鲜叶和凋落叶N、P重吸收率与C∶N∶P化学计量特征的相关性分析
总体来说,白桦养分重吸收率都较山杨高,LN和HN处理下两种植物鲜叶的NRE(N重吸收率)显著低于CK处理(P<0.05),LN和HN处理之间无显著影响。其中,CK处理下白桦鲜叶NRE为(6.46±4.84)%,LN处理下NRE为(-2.49±2.73)%,HN处理下NRE为(1.3±1.67)%,白桦CK处理的NRE分别是LN和HN处理的1.39和0.80倍。CK处理下山杨鲜叶NRE为(-15.26±4.17)%,LN处理下NRE为(-48.57±5.03)%,HN处理下NRE为(-54.39±5.06)%。山杨CK处理的NRE分别是LN和HN处理的2.18和0.12倍。两种植物的PRE(P重吸收率)与NRE具有相同的变化趋势,均呈现出随N添加浓度升高而下降的趋势,白桦CK处理的PRE分别是LN和HN处理的8.17和5.1倍,山杨CK处理的PRE分别是LN和HN处理的2.55和0.28倍。白桦和山杨之间除HN处理下PRE无显著差异外,其余各梯度均具有显著差异(P<0.05)。
白桦鲜叶N、P重吸收率与C∶N∶P化学计量比均不存在显著相关性(表1);而山杨鲜叶的NRE与其C∶N、C∶P呈显著负相关关系(P<0.05),相关系数分别为-0.785、-0.691(P<0.05),与其N∶P不存在显著相关性;山杨鲜叶PRE与其C∶N呈极显著负相关关系,相关系数为-0.808(P<0.01),与C∶P、N∶P均不存在显著相关性;并且,山杨鲜叶NRE与PRE之间相关系数为0.719,呈显著正相关关系(P<0.05)(表2)。
表1 白桦鲜叶养分、养分再吸收率及化学计量比的相关性分析
Table 1 Correlation analysis of nutrient,nutrient resorption efficiency and stoichiometric ratio of fresh leaves ofB.platyphylla
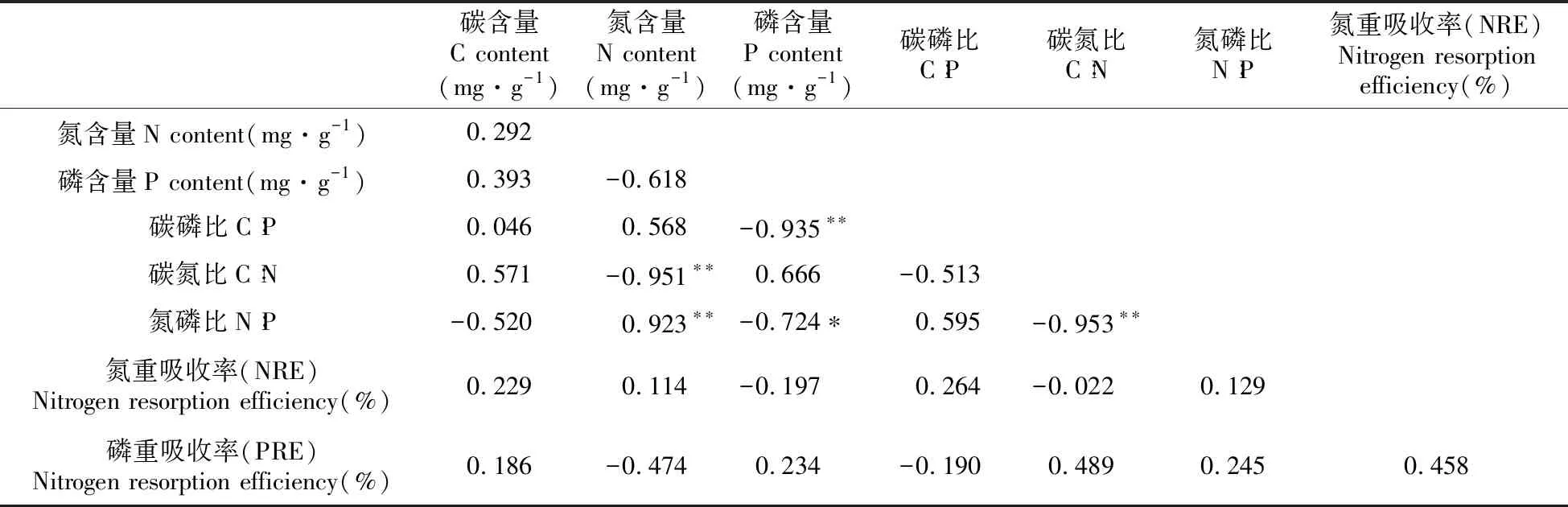
碳含量C content(mg·g-1)氮含量N content(mg·g-1)磷含量P content(mg·g-1)碳磷比C∶P碳氮比C∶N氮磷比N∶P氮重吸收率(NRE)Nitrogen resorption efficiency(%)氮含量N content(mg·g-1)0.292磷含量P content(mg·g-1)0.393-0.618碳磷比C∶P0.0460.568-0.935∗∗碳氮比C∶N0.571-0.951∗∗0.666-0.513氮磷比N∶P-0.5200.923∗∗-0.724∗0.595-0.953∗∗氮重吸收率(NRE)Nitrogen resorption efficiency(%)0.2290.114-0.1970.264-0.0220.129磷重吸收率(PRE)Nitrogen resorption efficiency(%)0.186-0.4740.234-0.1900.4890.2450.458
注:*表示0.05显著差异;**表示0.01极显著差异 下同。
Note:*indicates the significant level of 0.05;**indicates the significant level of 0.01.The same as below.

表2 山杨鲜叶养分、养分再吸收率及化学计量比的相关性分析
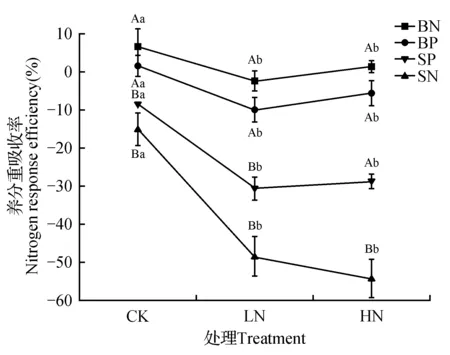
图3 不同N添加下白桦、山杨N、P重吸收率 BN.白桦NRE;BP.白桦PRE;SP.山杨PRE;SN.山杨NREFig.3 N,P resorption efficiency in B.platyphylla and P.davidiana leaf of different N addition BN.B.platyphylla NRE;BP.B.platyphylla PRE;SP.P.davidiana PRE;SN.P.davidiana NRE
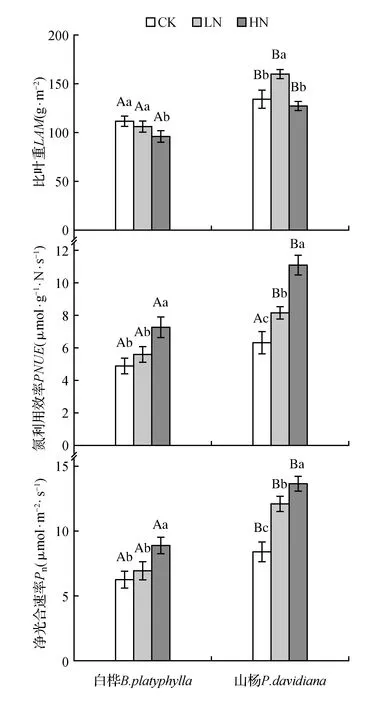
图4 不同N添加下白桦、山杨鲜叶比叶重、氮素利用效率、净光合速率的变化Fig.4 Changes of LMA,PNUE and Pn in leaves of B.platyphylla and P.davidiana under different N addition
2.3 N添加对山杨、白桦鲜叶光合特性的影响
白桦鲜叶LMA随N浓度的增加而下降,HN(96.27 g·m-2)处理显著低于CK(111.74 g·m-2)和LN(106.33 g·m-2)处理(P<0.05),CK和LN处理之间无显著影响。山杨鲜叶LMA相较CK(134.43 g·m-2)处理,在LN(159.76 g·m-2)处理下显著增加(P<0.05),增幅约18.85%,HN处理下无显著影响(图4:A)。两种植物鲜叶的Pn和PUNE均呈现出随N浓度增大而增加的趋势,其中白桦鲜叶的Pn和PNUE在LN处理下无显著影响,HN处理下显著增加(P<0.05),增幅相较CK处理分别约42.09%和48.47%,山杨的Pn和PNUE在LN、HN处理下均显著增加(P<0.05),山杨的Pn相较CK处理,HN处理的增幅是LN的1.41倍,山杨的PNUE相较CK处理,HN的增幅是LN的2.63倍(图4:B~C)。两种植物鲜叶之间的LMA和PNUE差异显著、Pn在LN和HN处理下差异显著(P<0.05)。
结果显示,白桦鲜叶N和LMA、Pn、PNUE均有相关性(表4),其中N和LMA呈显著负相关,相关系数为-0.905(P<0.05);N和Pn、PNUE均呈现极显著正相关,相关系数分别为0.735、0.758(P<0.01)。白桦鲜叶N∶P和LMA、Pn、PNUE均有相关性,其中N∶P和LMA呈极显著负相关,相关系数为-0.721(P<0.01);和Pn、PNUE均呈现极显著正相关,相关系数分别为0.733、0.718(P<0.01)。白桦鲜叶LMA和Pn呈显著负相关,相关系数为-0.675(P<0.05);LMA和PNUE呈极显著负相关,相关系数为-0.770(P<0.01),白桦鲜叶Pn和PNUE呈极显著正相关,相关系数为0.982(P<0.01)。白桦鲜叶P和LMA、Pn、PNUE均无相关性。山杨鲜叶N和LMA呈显著负相关,相关系数为-0.683(P<0.05),Pn和PNUE呈极显著正相关,相关系数为0.950(P<0.01)(表5)。由此表明,与山杨相比,白桦鲜叶化学计量比与光合特征相关性更强。

表3 不同N添加对白桦、山杨鲜叶各性状的影响
注:不同字母代表在P<0.05水平上的差异显著。
Note:Different letter mean significant atP<0.05 level.
表4 白桦鲜叶化学计量特征与光合特性的相关性分析
Table 4 Correlation analysis between the stoichiometric characteristics and photosynthetic characteristics of fresh leaves ofB.platyphylla

碳含量C content(mg·g-1)氮含量N content(mg·g-1)磷含量P content(mg·g-1)碳磷比C∶P碳氮比C∶N氮磷比N∶P比叶重LMA(g·m-2)净光合速率Pn(μmol·m-2·s-1)氮含量N content(mg·g-1)-0.405磷含量P content(mg·g-1)-0.393-0.607∗碳磷比C∶P-0.0550.510-0.938∗∗碳氮比C∶N0.3900.606∗-0.2110.372氮磷比N∶P-0.5630.865∗∗-0.619∗0.467-0.496比叶重LMA(g·m-2)0.454-0.905∗∗0.560-0.4570.561-0.721∗∗净光合速率Pn(μmol·m-2·s-1)-0.1670.735∗∗-0.3990.397-0.4490.733∗∗-0.675∗光合氮利用效率PUNE(μmol·g-1 N·s-1)-0.2110.758∗∗-0.4350.426-0.4480.718∗∗-0.770∗∗0.982∗∗
3 讨论
3.1 不同施N水平下植物鲜叶、凋落物C、N、P含量及化学计量比的变化
两种植物鲜叶C∶N∶P化学计量学研究表明,模拟N沉降处理下显著改变了白桦、山杨两种植物鲜叶的N、P含量,但并没有明显改变C含量(图1:A~C),因为C在植物体内主要起到骨架的作用,作为结构性物质,其受环境影响较小从而含量相对稳定[32]。白桦和山杨鲜叶平均N含量11.43和9.93 mg·g-1,明显低于全国尺度的20.24 mg·g-1[33]及全球植被水平的20.10 mg·g-1[34~35];白桦、山杨鲜叶平均P含量分别为1.11和1.03 mg·g-1,低于全球[7]、中国东部南北样带[36]的叶片P含量(1.77、1.28 mg·g-1),也低于Wu[37]等对中国东南部42种植物叶片的研究结果(2.24 mg·g-1)。这表明本地区植物鲜叶N、P含量相对较低,具体来说,这可能和次生林生长周期以及该地区的温度与降水量影响的土壤养分有关。并且,白桦鲜叶的N含量表现出随N沉降浓度升高而增加的趋势,这表明N沉降在一定浓度范围内(5.0 g·N·m-2·a-1)对白桦的N素吸收存在正效应,在N输入持续增加直到饱和之前,大部分输入的N会被植物体吸收,未来N沉降的适量增强可能会强化白桦鲜叶对N的吸收和积累。白小芳[38]也观测到随N素添加量的增大,华北落叶松针叶(Larixprincipis-rupprechtii)N含量显著增加,这与Aerts[18]等和Graciano[39]等的研究结果相同。白桦P含量在LN处理下显著高于CK和HN处理(P<0.05)(图1:C),这说明在LN(2.5 g·N·m-2·a-1)处理下白桦鲜叶对P的养分吸收达到最佳,而当N沉降浓度过量时,则会影响鲜叶的养分吸收机制。山杨鲜叶N、P含量在LN处理下显著下降(P<0.05),这可能是由于LN处理下外源N的输入刺激了山杨根系和茎的生长,使更多的光合产物分配到根中,与鲜叶之间产生了对养分利用的竞争[40]。这与刘洋等[41]关于氮添加对巨桉幼苗(Eucalyptusgrandis)N素分配的影响情况相似。
表5 山杨鲜叶化学计量特征与光合特性的相关性分析
Table 5 Correlation analysis between the stoichiometric characteristics and photosynthetic characteristics of fresh leaves ofP.davidiana
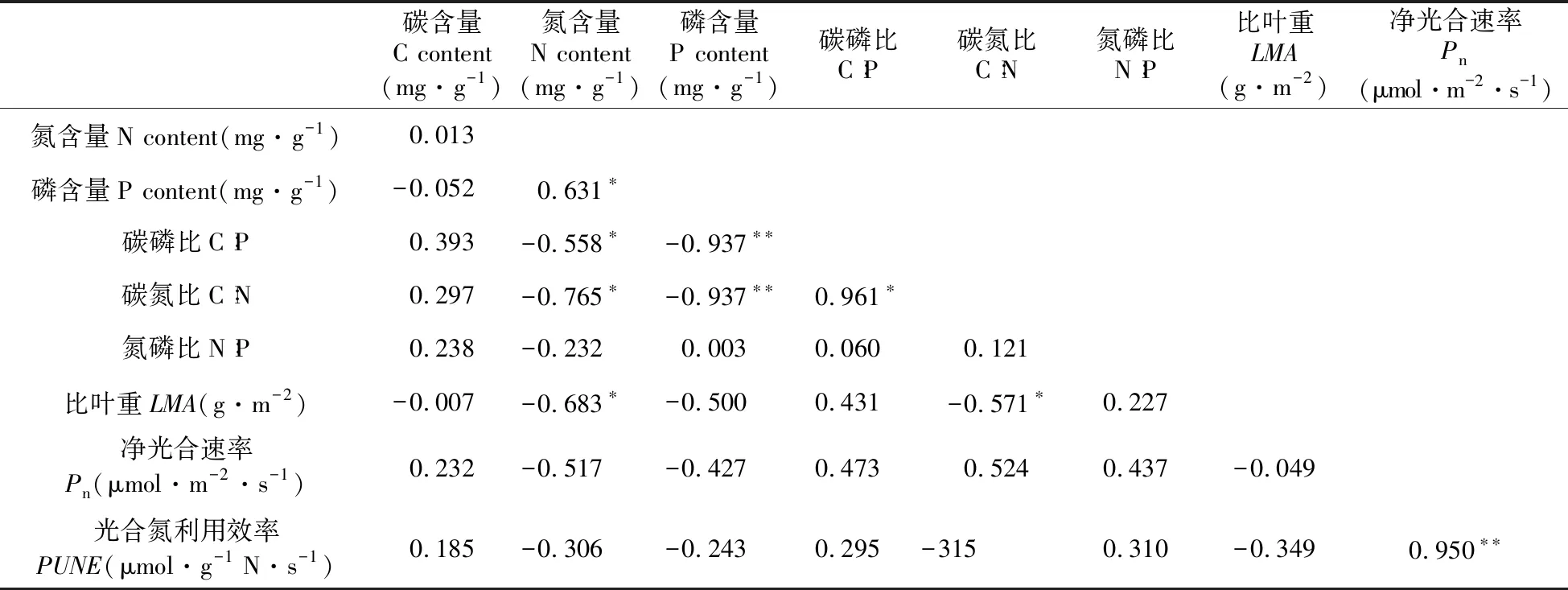
碳含量C content(mg·g-1)氮含量N content(mg·g-1)磷含量P content(mg·g-1)碳磷比C∶P碳氮比C∶N氮磷比N∶P比叶重LMA(g·m-2)净光合速率Pn(μmol·m-2·s-1)氮含量N content(mg·g-1)0.013磷含量P content(mg·g-1)-0.0520.631∗碳磷比C∶P0.393-0.558∗-0.937∗∗碳氮比C∶N0.297-0.765∗-0.937∗∗0.961∗氮磷比N∶P0.238-0.2320.0030.0600.121比叶重LMA(g·m-2)-0.007-0.683∗-0.5000.431-0.571∗0.227净光合速率Pn(μmol·m-2·s-1)0.232-0.517-0.4270.4730.5240.437-0.049光合氮利用效率PUNE(μmol·g-1 N·s-1)0.185-0.306-0.2430.295-3150.310-0.3490.950∗∗
白桦鲜叶C∶N在HN处理下显著降低(P<0.05)(图1:D),这表明外源N输入能够缓解对白桦的N限制,使得白桦生长加快,但是当N素积累量超过了鲜叶的生长需求时,N的利用率就会降低,进而导致白桦鲜叶C∶N减小。白桦鲜叶C∶P在LN处理时显著降低(P<0.05),HN时显著增加(P<0.05)(图1:E),这与增N条件下P的吸收策略大致相同,LN时P含量最高,土壤中营养元素充足,导致对P的利用效率低,在HN处理时,N的输入会刺激植物鲜叶对P的吸收来维持化学计量稳态,所以P的利用效率显著提高。安卓等[42]也发现随N素添加量的增加,长芒草(Stipabungeana)的C∶N逐渐降低,而C∶P逐渐升高,表明N素添加也降低了N的利用效率而提高了P的利用效率,本实验结果与之相似。与白桦相反,山杨鲜叶C∶N和C∶P在LN处理下显著增加,HN处理时降低(图1:D~E)。但对于N、P等养分的吸收机制和白桦类似,LN时土壤对鲜叶N、P的供应未达到山杨的生长需求,以至于对N、P的利用效率增大,而在HN处理时,土壤中N、P含量的增加满足了山杨鲜叶对养分的补充,导致对N、P的利用效率变低。
一般认为植物鲜叶的N∶P是表征植物繁殖和更新的重要参数[43],可以较好的反映植物的养分限制情况,很多学者认为当N∶P低时,植物生长受到N限制,N∶P高时植物受到P限制[12]。本试验中,不同N沉降水平处理下白桦鲜叶N∶P变化范围为9.8~12.02,山杨鲜叶N∶P变化范围为9.66~10.12,明显低于Han[33]等对我国753个植物种研究得出的平均值(14.40)和全球植物的平均值(13.80)[44]。这表明天然次生林先锋树种白桦、山杨普遍受到N限制。本试验发现不同N添加处理下,两种鲜叶N∶P仍小于14,说明长白山天然次生林中先锋树种白桦、山杨的生长仍受N限制,未来一定程度的N沉降范围内有利于促进其生长,并且积累更多的生物量C。此外,白桦、山杨鲜叶的C∶P和N∶P随着施N浓度升高成增加趋势(图1:E~F),与“生长速率假说”中生长率较高的生物具有较低的C∶P和N∶P不相符。然而,Matzek[45]等的研究发现植物生长速率并不是绝对的与化学计量比有关系,又或许是被某些植物储存养分的器官所掩盖了[46],可见植物是否遵循生长速率假说与植物自身有较大的关系,而一旦受到气候变化引起的诸如N沉降等因素的影响,迫使植物营养吸收条件改变,则可能呈现不同的生长模式,对于气候变化下植物的生长模式还有待进一步深入研究。
外源N的输入能够显著增加白桦和山杨凋落叶的N含量,引起凋落叶C∶N显著下降(图2:B~D)。研究表明[47~48]:C∶N越低分解越快,但过量的N沉降会使微生物降解中C的限制加剧,从而会降低凋落叶的分解速率。那么N添加降低C∶N将有利于白桦、山杨凋落叶的分解,促使凋落叶养分回归土壤,使白桦、山杨可从土壤中获取更多的养分来维持体内的元素平衡,从而加快林地的养分循环速率。
3.2 白桦、山杨鲜叶和凋落叶N、P重吸收率与C∶N∶P化学计量特征的相关性分析
一般而言,植物从凋落的叶片组织中转移养分的策略被称为“养分再吸收”,直接影响着植物的生态化学计量特征[49]。本实验中白桦、山杨鲜叶NRE、PRE都在LN处理下显著下降(P<0.05)(图3),且白桦鲜叶养分再吸收率较山杨高,逐渐变为负值,可见白桦山杨凋落叶养分转移能力较差,这说明在N添加下,土壤中的可利用N、P养分能够满足植物的生长需求时,植物养分吸收的主要来源仍然依靠土壤供给,植物以提高N吸收能力的方式来适应环境,不再需要从衰老的叶片组织中吸收养分[50],从而导致植物再吸收效率降低,甚至可能出现累积现象,而当土壤养分不足时才会触发叶片养分横向转移机制[47,51]。
植物体内的C∶N代表植物吸收营养所能同化C的能力,通常可以反映植物体N的利用效率,一定程度上也反映了土壤中N的利用效率[52]。植物叶片C∶N越高,表示植物对N元素的利用效率越高,本试验中山杨鲜叶的NRE、PRE为负值,N、P表现为富集状态,较低的NRE、PRE也就意味着较低的C∶N,但山杨鲜叶C∶N在施N处理下显著增加(P<0.05)(图1:D),因此山杨鲜叶C∶N与NRE、PRE呈显著负相关关系(P<0.05)。山杨鲜叶NRE的降低会使得鲜叶中N含量减少,而有相当一部分N元素参与合成RNA以及RNA转录合成的蛋白质中,而RNA又是P养分库[53~54],也就是说山杨鲜叶养分NRE即N利用效率的降低,会使得山杨鲜叶P含量也相应减少,也就意味着C∶P的增加,因此不同施N条件下山杨鲜叶C∶P与NRE呈显著负相关关系。本研究中,山杨鲜叶N、P再吸收效率之间呈现显著线性正相关(表2),表明山杨鲜叶中N、P元素的再吸收具有协同效应。
3.3 N添加对山杨、白桦鲜叶光合特征的影响
白桦鲜叶LMA随N浓度的增加而下降,山杨LN处理下LMA显著增大;HN处理下相较LN显著降低(图4:A)。这可能是因为N是叶绿素的重要组成部分,施N能促进植物叶片叶绿素的合成,但过量的N素添加可能会通过加大植物暗呼吸消耗能量从而降低叶绿素合成能力。因此,在一定范围内,N添加会引起植物叶片养分保持能力下降以及加重群落物种间光竞争,继而会根据自身情况调整其养分利用策略,例如通过增大叶面积(LMA降低)以获取更多的叶绿素和光资源提高光合能力从而提升竞争力[20]。本试验中两种叶片N含量与LMA均呈显著负相关关系,也支持以上观点。
目前有大量研究显示,Pn和PNUE是与叶片生理、形态及适应环境机制有关的重要指标,植物PNUE较高,意味着其生长较快,生产力较高。单位叶片N含量所固定的C量就是植物的PNUE,任何影响光合和叶片N含量的因素都将引起PNUE的变化[20]。本试验研究结果表明,白桦和山杨的Pn、PNUE与其鲜叶C∶N呈负相关关系,与C∶P呈正相关关系,但均不显著。并且白桦和山杨的Pn、PNUE随施N浓度的增加而增大(图4:B~C),这与Nakaji[55]等对赤松幼苗(Pinusdensiflora)的研究结果一致。这可能是由于处于先锋阶段的山杨和白桦生长和发育未达到稳定状态,对养分的吸收和代谢效率比老林龄高,因此外源氮的添加增大了Pn和PNUE[56]。可见随着施N量的增加,促使两种植物N浓度增大,加速其光合速率过程和对C的同化,进而对植物的PNUE产生积极影响。大部分研究认为光饱和点下的Pn与N含量成线性正相关关系[57~59],本试验白桦鲜叶Pn和鲜叶N含量呈极显著正相关(P<0.01)(表4),也支持以上观点。就白桦鲜叶PNUE与Pn之间的关系,PNUE的大小取决于Pn与Nc的相对变化,Pn和N含量与PNUE均有着显著的正相关关系(P<0.05),白桦、山杨鲜叶Pn、PNUE随N添加量的增加而增大,进而促进光合作用。郑淑霞等[60]对不同功能型植物的叶片参数进行分析得到PNUE的值与净光合速率的值呈显著正相关(P<0.05),这与本文研究结果相似;与孙金伟等[61]对长白山阔叶红松林两种幼苗光合生理生态特征结果也相同。叶片N在光合器与非光合器之间的分配模式,决定了植物在增大PNUE以提高光合效率与增加LMA以提高防御能力之间的关系较为矛盾,以至白桦鲜叶PNUE和Pn均与LMA呈负相关关系。目前,多数研究都支持此观点[62~64]。
4 结论
本研究对长白山试验样地内白桦和山杨鲜叶、凋落叶元素化学组分和光合性状测定后,得到结论如下:模拟N沉降处理下对白桦、山杨鲜叶、凋落叶化学计量特征有显著影响;白桦、山杨鲜叶N、P重吸收率在LN处理时显著下降,表现出较低的再吸收能力,在生长季,白桦、山杨鲜叶中N、P均表现为富集状态,土壤养分及外源N可供林木较快吸收并促进其生长,无需从凋落叶中吸收养分,并且山杨鲜叶中N、P元素的再吸收具有协同效应;N添加可以提高山杨和白桦鲜叶PNUE、Pn,增强其鲜叶的光合性能,促进植物养分吸收和叶片发育;HN对长白山天然次生林的生长有促进作用。但N沉降浓度继续升高所带来的生态后果还需长期定位研究,可能会改变森林群落结构和植物光合能力和养分利用策略。

