干巴菌菌丝生物学特性及生长条件研究
张 琦, 王 航, 刘 琨, 王秋颖
(中国医学科学院 北京协和医学院药用植物研究所, 北京 100193)
干巴菌(ThelephoraganbajunZang)在分类上隶属于担子菌门(Basidiomycota)、革菌目(Thelephorales)、革菌科(Thelephoraceae)、革菌属(Thelephora)[1-2]。该菌主要分布于我国西南地区,是当地一种珍贵的食用真菌[3]。干巴菌营养丰富,含有粗蛋白、粗脂肪、总糖、灰分等营养元素,同时还含有16种氨基酸,多种微量元素、维生素以及其特有的具有很高营养保健价值的革菌酸[4-5]。干巴菌还具有重要的药用价值,其含有的抗氧化物质对三苯化合物,能够清除人体内的自由基,具有延缓衰老的功效[6-7];含有的核苷酸、多糖等物质有助于降低胆固醇,其多糖还是医药方面最强的免疫剂与调节剂,虽然对癌细胞没有直接的致死作用,但能刺激抗体形成,调节机体内部的防御功能,达到抗癌的作用[8]。干巴菌尚未实现人工养殖,目前市面上销售的干巴菌均为野生资源[9]。该菌人工栽培困难的原因一是生长环境较为复杂,子实体中常常夹杂着大量杂菌和其他杂质,很难获得纯菌种,分离过程中污染严重[10];二是干巴菌菌根营养方式复杂,脱离宿主植物不能独立生存[11]。因此,实现干巴菌的人工栽培,还需要大量的实践与研究。研究组在我国湖北成功分离得到干巴菌的菌丝,并对其进行生物学特性研究,以期为实现干巴菌的人工栽培提供理论基础。
1 材料与方法
1.1 菌种及其培养
菌种为2015年采自湖北宜昌野外的干巴菌子实体,并通过组织分离法获得菌丝。
培养基为常规,配方:麦麸50 g(水煮0.5 h,3层纱布过滤,取滤液),葡萄糖20 g,磷酸二氢钾2 g,硫酸镁1.5 g,琼脂15 g,蒸馏水1 000 mL,pH值自然。培养基经高压灭菌30 min(0.12 ~0.15 MPa,121~126℃)后,取直径为9 cm的培养皿20个,将15 mL培养基分别倒入培养皿中备用。将冰箱中保存的干巴菌菌种,经活化后在超净工作台上接种于有培养基的培养皿中,在黑暗室温下(25℃)培养,待培养基长满整个培养皿后,即可用于接种。
1.2 菌丝及菌落形态的观察
在刚接种的干巴菌培养皿中,斜插入无菌的盖玻片,在黑暗室温下(25℃)培养;待菌丝长到盖玻片一半时,观察干巴菌菌丝的生长情况和菌落形态。
1.3 培养温度、 pH和光照条件的筛选
培养温度分别为18℃、22℃、26℃、30℃、32℃和34℃;培养pH分别为4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、9.0、10.0、11.0、12.0;光照为连续光照培养、连续黑暗培养和12 h/12 h光暗交替培养。
培养基为常规培养基,每个处理5次重复。采用平板培养法,取直径9 cm的无菌培养皿,分别倒入已灭菌的各种培养基15 mL,待培养基完全凝固后,在超净工作台上将直径8 mm的菌种块接种于培养皿中部,不同温度处理为黑暗条件下培养18 d,不同pH处理为室温(25℃)黑暗条件下培养12 d,不同光照下培养为室温下(25℃)培养12 d。每处理每天用游标卡尺测量并记录菌丝生长速度,取5组测量的平均值,并观察记录菌落和菌丝生长状态。
1.4 碳源、氮源、微量元素和维生素的筛选
1.4.1 碳源和氮源碳源分别为葡萄糖、蔗糖、麦芽糖、乳糖和可溶性淀粉各20 g,以不加碳源的培养基为对照。除碳源外,还需添加大豆蛋白胨2 g,磷酸二氢钾2 g,硫酸镁1.5 g,琼脂15 g,蒸馏水1 000 mL,pH保持自然。氮源分别为大豆蛋白胨、硝酸钾、硫酸铵、胰蛋白胨、牛肉膏,每种各2 g,以不加氮源的培养基作对照。除氮源外,还需添加葡萄糖20 g,磷酸二氢钾2 g,硫酸镁1.5 g,琼脂15 g,蒸馏水1 000 mL,pH保持自然。
以上培养基配制好后,经高压灭菌锅灭菌30 min(0.12~0.15 MPa,121~126℃,下同)后平板培养。取直径9 cm的无菌培养皿,分别倒入已灭菌的各种培养基15 mL,待培养基完全凝固后,在超净工作台上将直径8 mm的菌种块,接种于培养皿中部,5次重复。接种后,分别于黑暗室温(25℃)下培养13 d,观察记录菌落菌丝形态、生长势和菌落颜色,用游标卡尺测量菌丝生长速度,并计算5次处理的平均值。
1.4.2 微量元素液体基础培养基配方为葡萄糖20 g,大豆蛋白胨2 g,磷酸二氢钾0.46 g,磷酸氢二钾1 g,琼脂15 g,蒸馏水1 000 mL,pH自然。在液体基础培养液中分别加入硫酸铜、硫酸锌、硫酸锰和硫酸镁各0.5 g,以不加微量元素的培养液为对照。将100 mL培养液加入250 mL三角瓶内,每个处理重复5次,经高压灭菌冷却后,在超净工作台上将直径8 mm的菌种块分别接入三角瓶内,于黑暗、恒温(25℃)下摇床培养7 d。将培养7 d后的各处理菌丝分别用抽滤过滤,用蒸馏水洗涤菌丝体,于60℃烘干至恒重,取出分别称量菌丝干重,记录并计算5次处理的平均值。
1.4.3 维生素在液体基础培养液中分别加入维生素B1和维生素B2,每种的量分别为100 mg/L,以不加维生素的培养液为对照。将100 mL培养液加入250 mL三角瓶内,每个处理重复5次,经高压灭菌冷却后,在超净工作台上将直径8 mm的菌种块分别接入三角瓶内,于黑暗、恒温(25℃)下摇床培养7 d。将培养7 d后的各处理菌丝分别用抽滤过滤,用蒸馏水洗涤菌丝体,并于60℃烘干至恒重,取出分别称量菌丝干重,记录并计算5次处理的平均值。
1.5 数据处理
用软件IBM SPSS Statistics V21.0进行数据处理和分析,用软件GraphPad Prism 5.0作图。
2 结果与分析
2.1 菌丝及菌落形态
显微观察显示,干巴菌人工培养的菌丝分枝较多,有膈膜,无锁状联合,未观察到无性孢子(图1)。
干巴菌菌丝形成的菌落较为浓密,绒毛短且略有毛毡状;生长初期(0~5 d),菌丝为纯白色短绒毛状,细密,粗壮;生长中期(6~10 d)菌丝开始出现黄褐色圆环,并且黄褐色圆环上菌丝数量明显减少;生长后期(>10 d)菌丝为白色-黄褐色圆环交替出现,并且在菌落底部产生一些黑色代谢物。
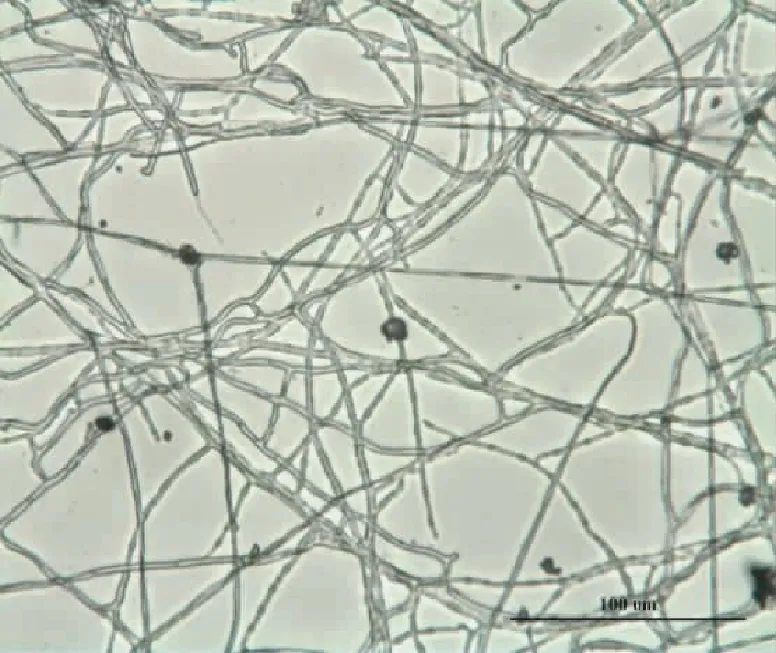
图1干巴菌的菌丝形态
2.2 不同环境条件下干巴菌菌丝的生长情况
2.2.1 温度由表1可知,干巴菌菌丝在18~30℃均能生长,但是不同温度对干巴菌菌丝生长的影响不同。培养温度为18℃时,菌丝生长速度较慢,为(2.49±0.14)mm/d;随着培养温度的升高,菌丝生长的速度逐渐加快,生长势也逐渐增强;温度为30℃时,菌丝的生长速度最快,为(3.93±0.06)mm/d;当温度高于30℃时,菌丝生长速度下降,温度达32℃时,菌丝不生长。培养温度为18℃与其他培养温度之间差异极显著。适合干巴菌菌丝生长的温度为22~30℃。
表1不同温度下干巴菌菌丝的生长情况
Table 1 Growth situation of mycelium ofT.ganbajunZang at different temperature

温度/℃Temperature生长速度/(mm/d)Growth rate生长势Growth vigor18 2.49 ± 0.14 aA+22 3.66 ± 0.14 bB++263.62 ± 0.13 bB++303.93 ± 0.06 bB+++320-340-
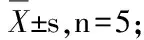
2.2.2 pH由图2和图3可见,干巴菌菌丝在pH 4.5~12.0均可生长,但略有差异。当pH<4.5时培养基过酸而不能凝固,但干巴菌菌丝依依然能生长;当pH在6.0~8.0时,菌丝生长较快,菌落颜色大部分为黄褐色和白色相间,菌落菌丝生长势旺盛且生长浓密,菌丝生长速度间的差异不显著; pH为9.0时,虽然菌丝生长速度仍较快,但是菌落菌丝长势较差;pH>9.0时,干巴菌菌丝生长速度逐渐变慢,菌丝菌落密度和菌丝生长势也减弱,气生菌丝极为稀薄;pH为12.0时,菌丝生长速度仅为(0.96± 0.38)mm/d,与其余pH下的菌丝生长速度差异显著。干巴菌菌丝对pH值适应范围较广,菌丝最适生长pH为6.0~8.0。
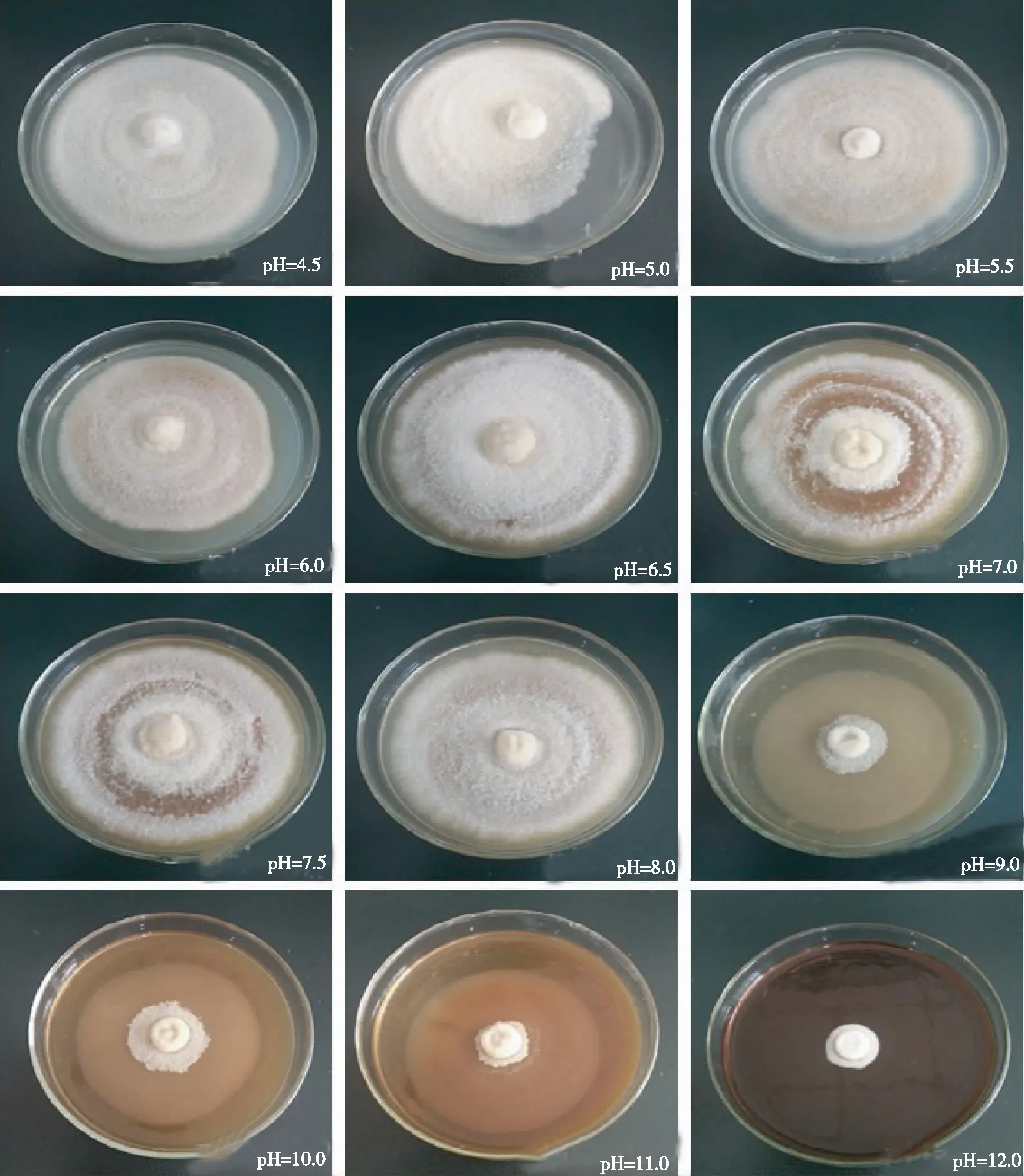
图2 不同 pH培养条件下干巴菌菌丝的菌落形态
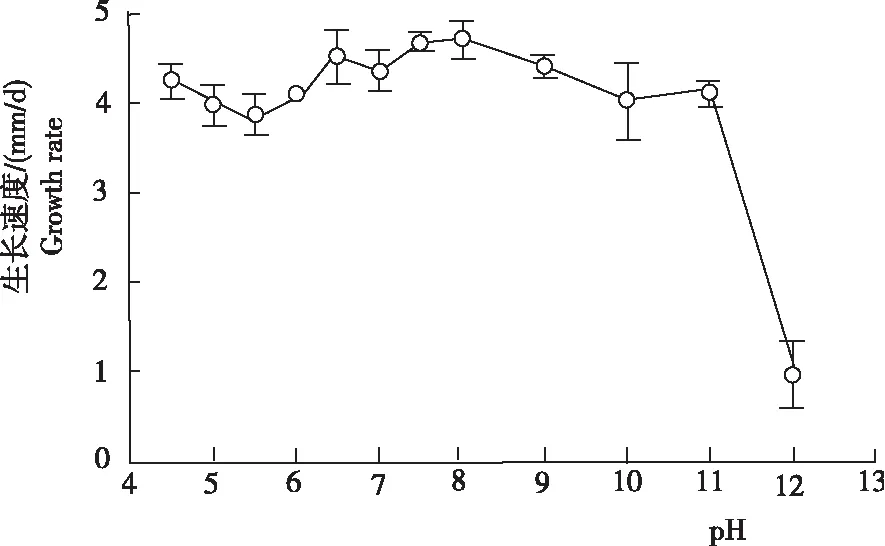
图3不同 pH干巴菌菌丝的生长速度
Fig.3 Growth rate ofT.ganbajunZang at different pH culture conditions
2.2.3 光照由图4可见,不同光照条件对干巴菌菌丝生长的影响存在显著差异,干巴菌菌丝在连续黑暗条件下培养,菌丝的平均生长速度为(3.50± 0.29) mm/d,菌落菌丝生长势旺盛,气生菌丝发达,菌落菌丝浓密,浅黄色和白色相间;12 h/12 h光暗交替培养条件下,菌丝的平均生长速度为(3.14± 0.29) mm/d,菌丝有明显的同心环纹,颜色为深黄褐色和白色相间,菌落菌丝生长势较为旺盛,但是菌丝易老化;连续光照的培养条件下,虽然菌丝生长的平均速度高达(4.49± 0.10) mm/d,但是气生菌丝极不发达,菌落菌丝稀疏,平贴在培养基表面。连续黑暗培养和12 h/12 h光暗交替培养条件下的菌丝生长速度无显著性差异,但均与连续光照培养的菌丝生长速度存在显著性差异。综合菌丝平均生长速度和菌丝生长势,连续黑暗培养是干巴菌菌丝的最佳培养条件。
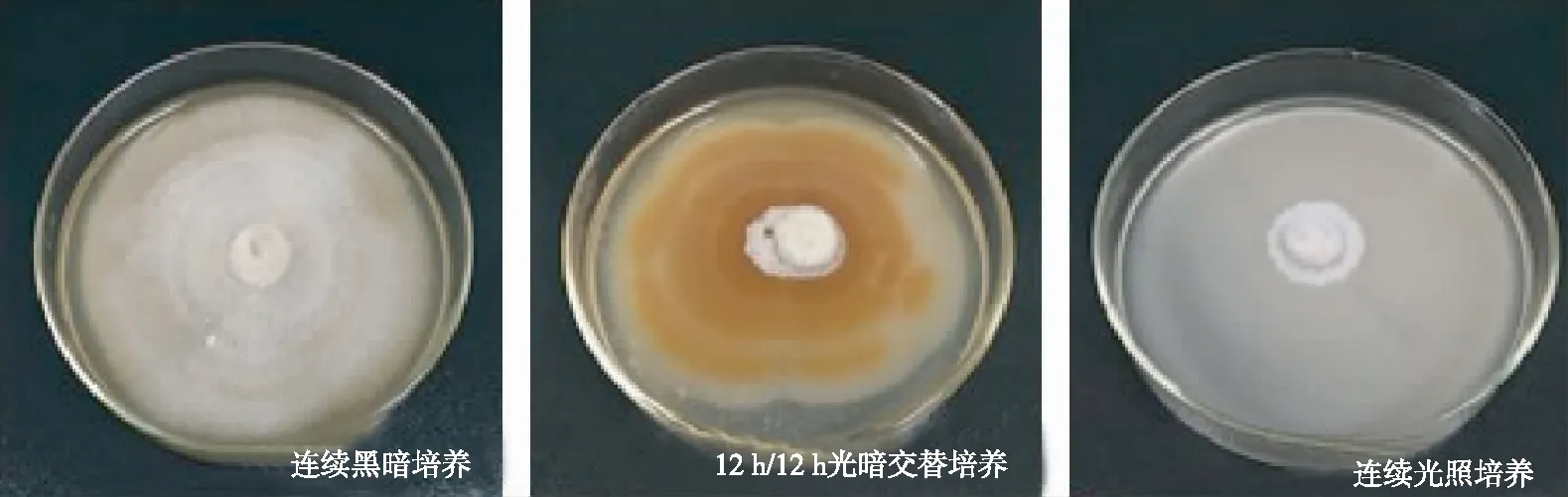
图4不同光照培养条件下干巴菌的菌落形态
2.3 不同营养条件下干巴菌菌丝的生长情况
2.3.1 碳源由图5及表2可见,干巴菌在5种碳源和未加碳源的培养基中均能生长,但是不同碳源对干巴菌生长影响存在差异。可溶性淀粉和乳糖为碳源时,平均生长速度分别达(3.82±0.35)mm/d和(3.80±0.24)mm/d,同时菌落菌丝生长旺盛,菌丝浓密;其次为蔗糖、葡萄糖、麦芽糖作为碳源的处理,菌落菌丝浓密,生长势旺盛;麦芽糖为碳源时效果最差,菌丝的平均生长速度仅(2.70±0.33)mm/d。培养基中无碳源时,干巴菌依然能生长且生长速度最快,达(4.06±0.17)mm/d,但是气生菌丝长势不旺盛,菌落菌丝微稀疏,平贴在培养基表面;除葡萄糖和麦芽糖处理下的菌丝生长速度和无碳源处理的菌丝生长速度存在显著差异外,其余均无明显差异。从菌丝生长平均速度和生长势综合评价,可溶性淀粉、乳糖为干巴菌生长的最适碳源。
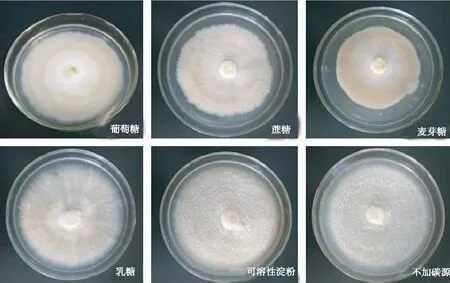
图5 添加不同碳源干巴菌的菌落形态
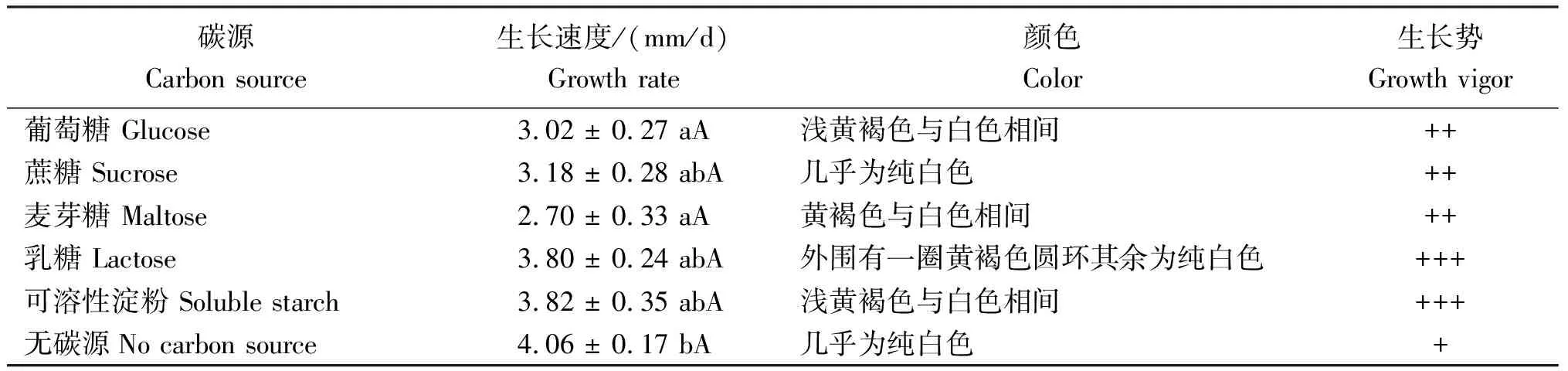
表2 添加不同碳源干巴菌的菌丝生长情况
2.3.2 氮源由图6可知,干巴菌在硫酸铵作为氮源时不能生长,在其他培养基上均能生长。由表3可见,不同氮源对干巴菌生长影响存在差异。胰蛋白胨作为氮源时菌丝生长速度最快,可达(4.12 ± 0.17) mm/d,其次为硝酸钾、牛肉膏、大豆蛋白胨;硝酸铵为氮源时,菌丝生长效果最差,不仅未生长,还发生了萎缩,可能由于硫酸铵中含有两分子的氮元素,导致培养基中氮元素含量过大,反而抑制了干巴菌菌丝的生长。硝酸钾和胰蛋白胨作为氮源时,菌落菌丝生长势旺盛且浓密;大豆蛋白胨和牛肉膏为氮源时菌落菌丝较为浓密,生长势较为旺盛;无氮源时虽然菌丝有所生长,但是气生菌丝极为稀薄,几乎为透明,可见氮源是干巴菌菌丝生长所必须的营养元素。大豆蛋白胨作为氮源和无氮源处理时,与胰蛋白胨作为氮源处理时的菌丝平均生长速度存在显著性差异,其余处理无明显差异。干巴菌不仅能较好利用有机氮,也能利用无机氮,除硫酸铵外的氮源,均对干巴菌的生长具有促进作用。
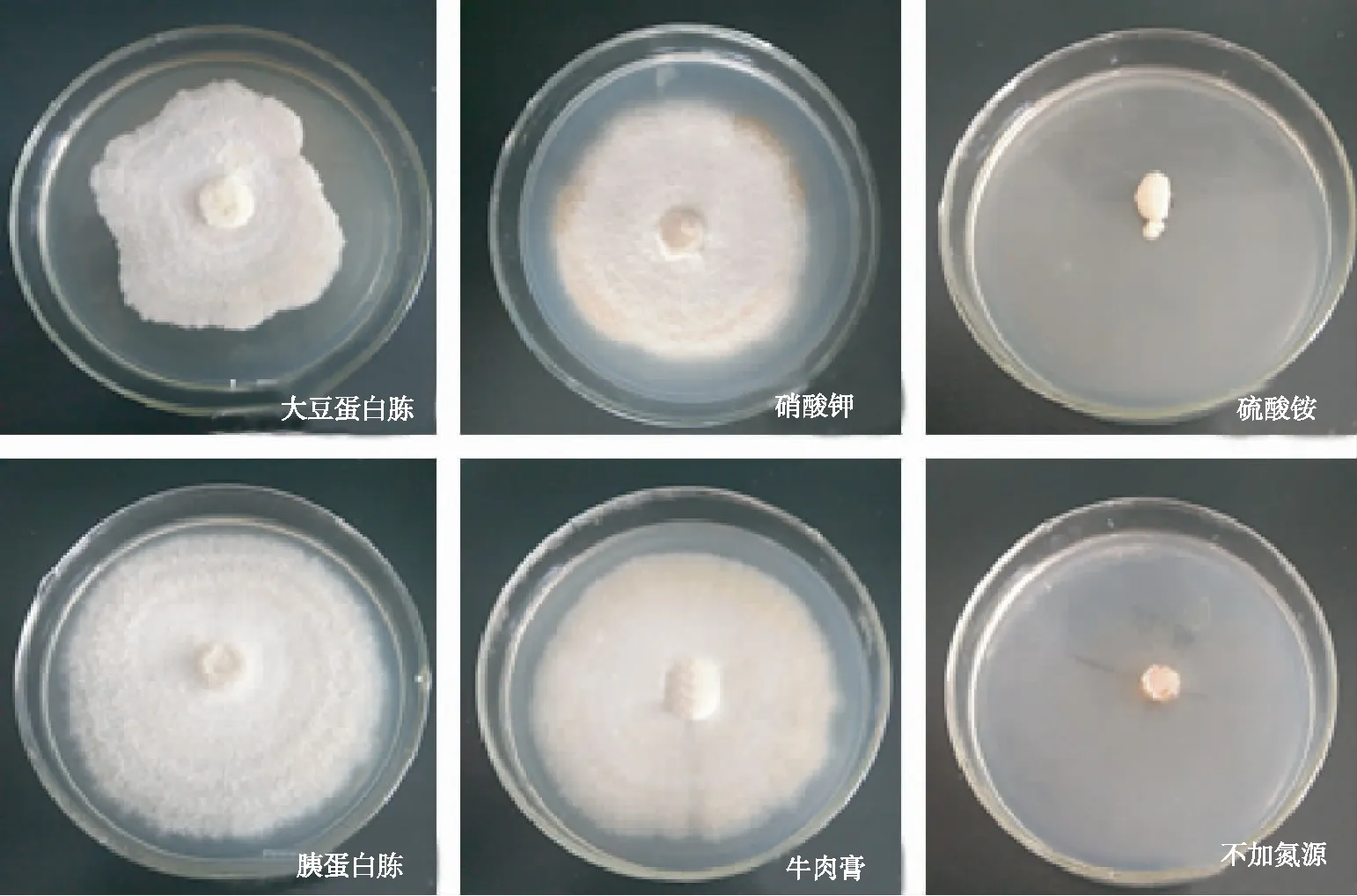
图6添加不同氮源干巴菌的菌落形态
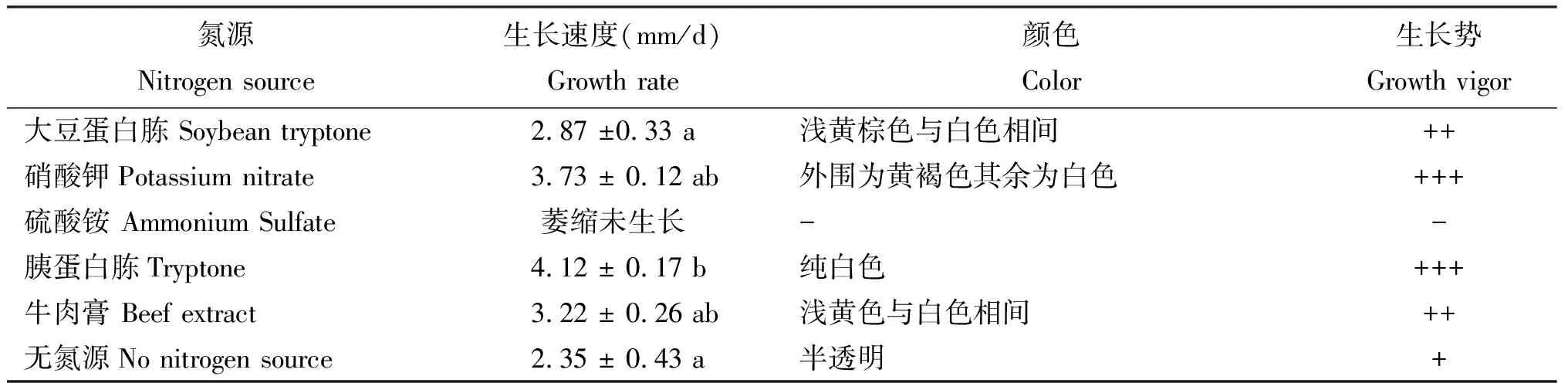
表3 添加不同氮源干巴菌的菌丝生长情况
2.3.3 微量元素 由表4可以看出,不同微量元素对干巴菌菌丝生长及干重影响不同。以硫酸镁作为微量元素时菌丝生长速度最快,菌丝干重最重,达(243.8± 42.6)mg/100mL;其次为硫酸锰和硫酸锌,两者对菌丝的生长均有促进作用,菌丝干重明显高于未添加微量元素的处理;硫酸铜作为微量元素处理的效果最差,对菌丝的生长有抑制作用,菌丝未生长。
2.3.4 维生素 表5可知,干巴菌在2种维生素和未添加维生素的培养液中均能生长。添加维生素B2的菌丝生长速度较快,菌丝干重最重,达(375.2±33.4)mg/100mL;添加维生素B1的培养液中菌丝长势较差。添加维生素B2对干巴菌生长有促进效果,维生素B1略起抑制作用。
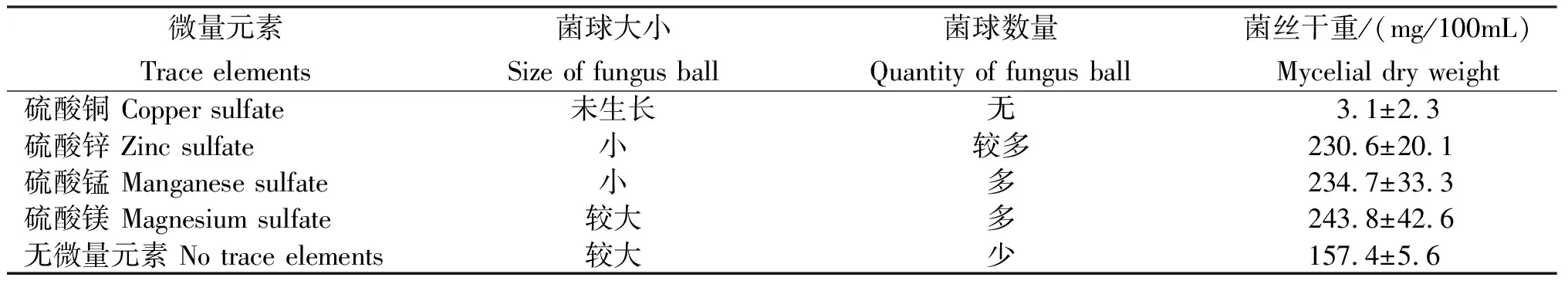
表4 添加不同微量元素干巴菌的菌丝生长情况
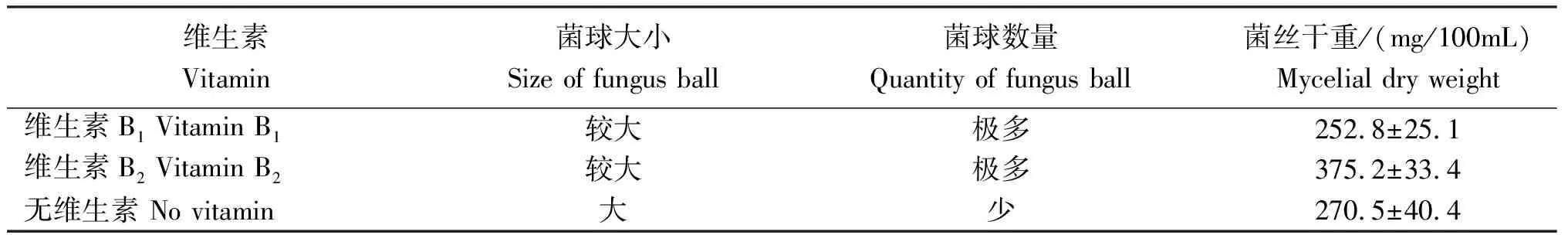
表5 添加不同维生素干巴菌的菌丝生长情况
3 结论与讨论
研究结果表明,干巴菌菌丝在平板培养时,最适合的碳源是可溶性淀粉和乳糖,最适合的氮源是胰蛋白胨,pH6.0~8.0,温度22~30℃,黑暗条件下培养,干巴菌落菌丝最浓密,生长最旺盛。在发酵培养的条件下,微量元素镁对干巴菌菌丝生长最有利,维生素B2对促进干巴菌菌丝生长有显著效果。试验结果为目前野生资源短缺,并且不能进行人工栽培的干巴菌实现人工栽培及开发利用提供了理论依据。
一般食药用真菌菌丝的最适生长温度在25 ~28℃,所以在温度试验中选择的温度范围为18~34℃,但试验未筛选出最佳温度,还有待作进一步试验。但值得一提的是,在探究微量元素和维生素对干巴菌菌丝生长影响的研究中,三角瓶大小不同,菌落菌丝生长的速度和长势也不尽相同,在不加任何微量元素和维生素,且接种量和所加培养基一致的情况下,200 mL三角瓶内的干巴菌菌丝干重明显高于250 mL三角瓶内干巴菌菌丝干重,造成这一现象的原因尚有待进一步考证与探究。

