刺梨的化学成分鉴定及其抗菌活性
梁梦琳, 李 清, 龙勇兵, 李 阳, 李 萍, 袁小红
(西南科技大学 生命科学与工程学院, 四川 绵阳 621000)
刺梨(RosaroxbunghiiTratt)又名缫丝花、文先果、送春归,是蔷薇科蔷薇属多年生落叶灌木[1],为中国云贵高原特有的野生资源。刺梨具有很高的营养价值,富含维生素C、黄酮、三萜、有机酸、多糖、多酚等物质[2-6],其中维生素C含量居水果之首[4]。传统医学常把刺梨用于消食健胃、止泻、维生素C缺乏症等[7]。现代医学研究表明,刺梨汁能减轻拘束负荷诱发自由基对肝组织的损伤,改善肝组织机能[8];刺梨提取物能够抑制胃癌细胞的生长[9-10];刺梨冻干粉能够明显减轻单侧输尿管梗阻(UUO)模型大鼠肾功能的损害,以及输尿管梗阻导致的肾纤维化[11];刺梨汁在改善动脉粥样硬化方面亦有明显作用[12]。此外,刺梨还具有抗炎、增强免疫、延缓衰老、降低机体内重金属负荷等作用[13-14]。
近年来,刺梨已成为国内饮料、营养保健品产业的一种重要原料,其广泛的药食两用价值日益受到关注。但目前对刺梨的研究,大多集中在粗提物效果的评价,很多有效成分未得到充分的研究和利用,难以应用于实际生产中。为此,笔者对刺梨活性成分进行分离鉴定,并测定其抗菌活性,进一步阐明刺梨能够发挥一些生物活性的物质作用基础,为刺梨资源的开发利用提供参考依据。
1 材料与方法
1.1 新鲜刺梨与菌株
新鲜刺梨,购自贵州六盘水。金黄色葡萄球菌(Staphylococcusaureus)、大肠杆菌(Escherichiacoli)、枯草芽孢杆菌(Bacillussubtilis)、肠炎沙门氏菌(Salmonellaenteritidis),均由西南科技大学生命科学与工程学院生物实验室提供。
1.2 仪器与试剂
XJ-2小型提取浓缩机组(天津大明制药设备厂),Finnigan LCQDECA质谱仪(美国阿美特克公司),Bruker Avance-600 核磁共振仪(德国布鲁克公司),制备高效液相色谱仪(江苏汉邦公司),制备柱(C-18柱,250 mm×10.0 mm,5 μm,Servo公司),中压制备色谱仪(瑞士BUCHI公司),柱层层析硅胶(200~300目)、聚酰胺柱层析(60~90目)、薄层层析硅胶板(青岛海洋化工有限公司),SephadexLH-20 葡聚糖凝胶(瑞士Pharmacia 公司),β-谷甾醇对照品(成都瑞芬思生物科技有限公司),试验所用试剂均为分析纯,水为超纯水。
1.3 刺梨提取液分离鉴定
取新鲜刺梨150 kg,用等体积70%乙醇(12 h,4次)提取,提取液浓缩成浸膏13 kg。总浸膏用水稀释后再用乙酸乙酯萃取3次,萃取液合并,减压浓缩,得乙酸乙酯部分700 g。乙酸乙酯部分过聚酰胺柱层析,二氯甲烷-乙醇(2∶1、1∶1、0∶1)梯度洗脱,薄层层析硅胶板点样,采用紫外、硫酸香草醛显色等方法观察检测流分,合并相似流分,得到Fr.1和Fr.2。Fr.1通过柱层层析硅胶,二氯甲烷-乙醇(100∶0、20∶1、10∶1、5∶1、1∶1、0∶100)梯度洗脱,薄层层析硅胶板点样合并后得到5个组分(Fr1.1~Fr1.5)。取部分Fr1.2组分通过反复柱层层析硅胶以及高效液相制备色谱得到化合物1(1 g,制备条件:甲醇-水为60∶40,流速为3.0 mL/min),化合物2(16 mg,制备条件:甲醇-水为80∶20,流速为 3.5 mL/min),化合物7(500 mg,重结晶)。取部分Fr1.5组分过中压反相柱层析(条件:甲醇-水为60∶40,流速为10.0 mL/min)以及制备色谱(条件:甲醇-水为65∶35,流速为2.0 mL/min)得到化合物3(18 mg)、化合物4(240 mg)、化合物5(27 mg)和化合物6(13 mg)。
1.4 抗菌活性测定
参考文献[15]的方法并加以改进,配制终浓度为108cfu/mL的菌悬液,采用刃天青96孔板微量稀释法,对3~6号化合物进行大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、肠炎沙门氏菌抑菌试验。检测前,分别将供试化合物和硫酸新霉素溶于二甲基亚砜(DMSO)中,制成浓度1.0 mg/mL。以硫酸新霉素为阳性对照,并以刃天青溶液(100 μg/mL)为指示剂。在96孔板第11列每孔中加100 μL刃天青溶液。将刃天青溶液7.5 mL和5 mL菌悬液(108cfu/mL)混匀,转移混合液100 μL到96孔板其余孔中。转移待测化合物溶液 100 μL 到其中一行的第1个孔中,混匀后从此孔转移100 μL到同一行的第2个孔中,混匀后再从第2个孔转移100 μL 到第3个孔中,以此类推直至第10个孔为止,第10个孔的液体混匀后抽取100 μL扔掉,使每孔浓度均为前一孔的一半,第11孔为阳性对照。最后将96孔板在37℃下培养5 h,有活性的标志为从蓝色到粉红色;发生颜色变化的最低稀释浓度即为待测化合物的最低抑菌浓度(MIC),3次独立试验的MIC值作为最终MIC值。
2 结果与分析
2.1 化合物结构鉴定
在贵州剌梨中共鉴定出7种化合物,其具体结构见图1。
2.1.1 化合物1白色针状结晶1H-NMR(600 MHz,CD3OD):δ5.29(1H,t,J=3.4 Hz,H-12),3.93(1H,m,H-3),3.33(1H,d,J=2.5 Hz,H-2),2.51(1H,s,H-18),1.35(3H,s,CH3-27),1.28(3H,s,CH3-29),1.19(3H,s,CH3-25),0.99(6H,s,CH3-23),0.93(3H,d,J=6.6 Hz,CH3-30),0.87(3H,s,CH3-26),0.79(3H,s,CH3-24),13C-NMR(100 MHz,CD3OD):δ42.4(C-1),67.1(C-2),80.1(C-3),41.2(C-4),49.2(C-5),24.6(C-6),34.1(C-7),39.3(C-8),49.0(C-9),39.4(C-10),27.2(C-11),129.3(C-12),140.1(C-13),42.7(C-14),29.5(C-15),26.6(C-16),48.1(C-17),55.1(C-18),73.6(C-19),43.0(C-20),19.2(C-21),39.0(C-22),29.2(C-23),22.4(C-24),17.5(C-25),16.6(C-26),27.1(C-27),182.5(C-28),24.9(C-29),16.8(C-30)。对照文献[16]的数据,确定化合物为蔷薇酸(Euscaphic acid)。
2.1.2 化合物2白色粉末1H-NMR(600 MHz,CD3OD):δ5.28(1H,s,H-12),3.65(1H,dd,J=9.6,3.0 Hz,H-2),3.46(1H,d,J=9.6 Hz,H-1),3.40(1H,d,J=3.0 Hz,H-3),2.00(1H,dd,J=11.0,6.7 Hz,H-9),1.35(3H,s,CH3-27),1.20(3H,s,CH3-23),1.01(3H,s,CH3-25),0.97(3H,s,CH3-29),0.93(3H,J=6.7 Hz,CH3-30),0.88(3H,s,CH3-24),0.81(3H,s,CH3-26),13C-NMR(100 MHz,CD3OD):δ81.3(C-1),71.8(C-2),80.7(C-3),42.5(C-4),49.7(C-5),19.4(C-6),34.2(C-7),41.8(C-8),49.8(C-9),44.4(C-10),27.1(C-11),130.5(C-12),138.9(C-13),29.7(C-14),29.1(C-15),26.7(C-16),49.0(C-17),55.0(C-18),73.7(C-19),43.0(C-20),27.3(C-21),39.0(C-22),28.2(C-23),22.3(C-24),12.9(C-25),17.8(C-26),24.9(C-27),178.5(C-28),26.7(C-29),16.6(C-30)。对照文献[17]的数据,确定化合物为1α,2β,3β,19α-tetrahydroxyurs-12-en-28-oic acid。
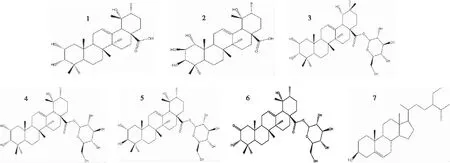
图1化合物1~7的结构
2.1.3 化合物3白色粉末ESI-MS m/z 673[M+Na]+;1H-NMR(400 MHz,CD3OD):δ5.39(1H,d,J=8.0 Hz,glcH-1),5.36(1H,m,H-12),1.33(3H,s,CH3-27),1.01(6H,s,CH3-23,CH3-26),0.97(3H,s,CH3-29),0.96(3H,s,CH3-25),0.89(3H,s,CH3-30),0.76(3H,s,CH3-24);13C-NMR(100 MHz CD3OD):δ41.3(C-1),65.7(C-2),78.7(C-3),38.1(C-4),48.2(C-5),17.9(C-6),31.9(C-7),39.7(C-8),47.4(C-9),38.1(C-10),23.5(C-11),123.5(C-12),143.0(C-13),41.0(C-14),27.8(C-15),27.0(C-16),45.7(C-17),43.7(C-18),81.1(C-19),34.5(C-20),28.0(C-21),32.4(C-22),28.1(C-23),20.9(C-24),15.4(C-25),16.4(C-26),23.7(C-27),177.2(C-28),27.2(C-29),23.7(C-30),94.4(C-1’),72.5(C-2’),76.9(C-3’),69.7(C-4’),77.3(C-5’),61.0(C-6’)。对照文献[18]的数据,确定化合物为2α,3α,19α-trihydroxy-olean-12-en-28-oic acid-28-O-β-D-glucopyranoside。
2.1.4 化合物4白色针状结晶ESI-MS m/z 673[M+Na]+;1H-NMR(400 MHz,CD3OD):δ5.35(1H,d,J=2.9 Hz,glc H-1),5.34(1H,m,H-12),2.54(1H,s,H-18),1.31(3H,s,CH3-27),1.27(3H,s,CH3-29),1.02(3H,s,CH3-25),1.01(3H,s,CH3-23),0.95(3H,s,CH3-30),0.89(3H,s,CH3-26),0.79(3H,s,CH3-24);13C-NMR(100 MHz,CD3OD):δ41.2(C-1),65.8(C-2),78.7(C-3),37.9(C-4),48.1(C-5),21.1(C-6),32.6(C-7),40.0(C-8),46.8(C-9),38.1(C-10),23.4(C-11),128.2(C-12),138.3(C-13),41.5(C-14),28.2(C-15),25.1(C-16),45.7(C-17),53.6(C-18),72.3(C-19),41.4(C-20),25.8(C-21),36.9(C-22),27.8(C-23),17.9(C-24),16.3(C-25),15.5(C-26),23.3(C-27),177.1(C-28),25.7(C-29),15.2(C-30),94.4(C-1’),72.5(C-2’),77.2(C-3’),69.7(C-4’),76.9(C-5’),61.0(C-6’)。对照文献[19]的数据,确定化合物为刺梨苷(kaiiichigeside F1)。
2.1.5 化合物5白色针状结晶ESI-MS m/z 673[M+Na]+;1H-NMR(400 MHz,CD3OD):δ5.11(1H,d,J=2.9 Hz,glc H-1),5.10(1H,m,H-12),2.30(1H,s,H-18),1.10(6H,s,CH3-27,CH3-29),0.79(6H,s,CH3-23,CH3-25),0.71(3H,s,CH3-30),0.59(3H,s,CH3-26),0.56(3H,s,CH3-24);13C-NMR(100 MHz,CD3OD):δ47.9(C-1),68.1(C-2),83.1(C-3),37.8(C-4),55.3(C-5),18.3(C-6),32.7(C-7),39.9(C-8),47.3(C-9),39.1(C-10),23.3(C-11),128.1(C-12),138.3(C-13),41.3(C-14),28.3(C-15),25.1(C-16),46.8(C-17),53.6(C-18),72.5(C-19),41.5(C-20),25.8(C-21),36.9(C-22),27.9(C-23),16.3(C-24),16.1(C-25),15.8(C-26),23.4(C-27),177.1(C-28),25.7(C-29),15.2(C-30),94.4(C-1’),72.3(C-2’),77.2(C-3’),69.7(C-4’),76.9(C-5’),61.0(C-6’)。对照文献[19]的数据,确定化合物为野蔷薇苷(Rosamultin)。
2.1.6 化合物6白色粉末ESI-MS m/z 671[M+Na]+;1H-NMR(400 MHz,CD3OD):δ5.48(1H,d,J=8.0 Hz,glc H-1),5.34(1H,m,H-12),1.41(3H,s,CH3-27),1.21(3H,s,CH3-29),1.20(3H,s,CH3-26),0.91(3H,s,CH3-30),0.80(3H,s,CH3-25),0.74(3H,s,CH3-24);13C-NMR(100 MHz,CD3OD):δ53.5(C-1),211.3(C-2),82.5(C-3),43.2(C-4),53.1(C-5),15.8(C-6),32.4(C-7),40.2(C-8),46.9(C-9),45.1(C-10),23.2(C-11),127.5(C-12),138.5(C-13),41.5(C-14),28.3(C-15),25.1(C-16),48.1(C-17),54.4(C-18),72.2(C-19),41.4(C-20),25.6(C-21),36.8(C-22),28.1(C-23),18.5(C-24),15.3(C-25),15.7(C-26),23.2(C-27),177.5(C-28),25.8(C-29),15.1(C-30),94.4(C-1’),72.5(C-2’),77.2(C-3’),69.7(C-4’),76.9(C-5’),61.0(C-6’)。对照文献[20]的数据,确定化合物为potentilanoside B。
2.1.7 化合物7无色针状结晶,易溶于氯仿,熔点(mp)温度138~140℃,与β-谷甾醇对照品比较,发现两者在薄层硅胶板上的比移值(Rf值)以及显色情况均相同,混合后熔点未下降,故鉴定为β-谷甾醇。
2.2 抗菌活性
从表1可知,化合物3~6对铜绿假单胞大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、肠炎沙门氏菌均有一定的抑菌能力,化合物4对大肠杆菌的抑制作用最为明显,最低抑菌浓度为31.3 μg/mL;4种化合物对金黄色葡萄球菌、枯草芽孢杆菌的最低抑菌浓度分别均为62.5 μg/mL和125 μg/mL;对肠炎沙门氏菌的抑制作用以化合物3最强,最低抑菌浓度为62.5 μg/mL。
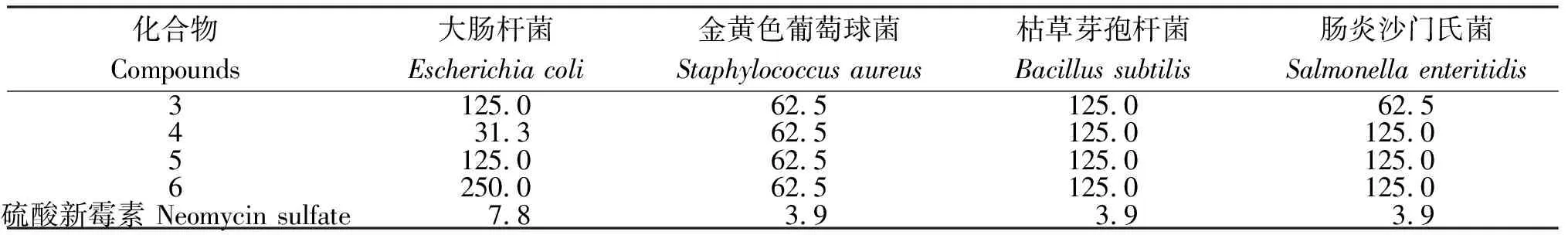
表1 化合物3~6的最低抑菌浓度
3 小结
研究结果表明,贵州新鲜刺梨中含有6种三萜类化合物:蔷薇酸(Euscaphic acid,化合物1)、1α,2β,3β,19α-tetrahydroxyurs-12-en-28-oic acid(化合物2)、2α,3α,19α-trihydroxy-olean-12-en-28-oic acid28-O-β-D-glucopyranoside(化合物3)、刺梨苷( kaiiichigeside F1,化合物4)、野蔷薇苷(Rosamultin,化合物5)、potentilanoside B(化合物6);含有1种甾醇类:β-谷甾醇(化合物7)。其中,化合物2、化合物6为首次从刺梨中分离得到。比较化合物3~6的抗菌活性发现,化合物4抑制大肠杆菌的活性较强(MIC值为31.3 μg/mL);化合物3抑制肠炎沙门氏菌的效果较其余化合物明显;4种化合物对金黄色葡萄球菌的抑制效果明显(MIC值均为62.5 μg/mL)。由此表明,这几种化合物可作为潜在的天然食品防腐剂加以开发。今后课题组将进一步研究评价几种化合物的抗真菌活性,以拓展其应用途径。
研究结果进一步明确了刺梨的化学物质基础,为深入探究刺梨发挥多种药理功效的具体有效成分、药理机制等提供了参考依据,也为开发营养、健康、绿色的刺梨系列功能产品提供了新的思路和方向。

