凋亡蛋白抑制因子Livin在子宫内膜癌中的表达及其对肿瘤细胞侵袭和迁移能力的影响
王晓华 张玉娟
子宫内膜癌是常见的妇科恶性肿瘤,发病率逐年上升。早期肿瘤患者经标准化手术治疗后预后较好,晚期或复发患者预后较差[1]。子宫内膜癌的发生、发展与肿瘤细胞的异常增殖和凋亡受阻密切相关[2]。凋亡蛋白抑制因子(inhibitor of apoptosis proteins, IAPs)是一类重要的抗细胞凋亡因子,具有调节细胞周期、抑制凋亡蛋白酶(caspase)活性的作用。Livin是目前发现的IAPs家族中活性最强的抗凋亡因子。研究发现,Livin在膀胱癌[3]、肾癌[4]、前列腺癌[5]、胃癌[6]、肺癌[7]等多种恶性肿瘤组织中特异性高表达。Livin在子宫内膜癌中的表达及其对肿瘤细胞侵袭转移能力的影响目前尚不明确。本研究通过检测Livin在不同子宫内膜组织中的表达,研究Livin在子宫内膜癌发生、发展中的作用,将Livin的小分子干扰RNA(Livin-siRNA)转染人子宫内膜癌Ishikawa和HEC-1-A细胞,观察靶向干扰Livin对子宫内膜癌细胞侵袭转移能力的影响。
1 材料与方法
1.1 材料 选取承德医学院附属医院妇科2015年3月—2016年10月手术切除的子宫内膜标本共118例,其中子宫内膜癌组织62例,非典型增生内膜组织26例,正常子宫内膜组织30例。标本采集经医院伦理委员会批准,患者均签署知情同意书。其中子宫内膜癌患者术前均未接受放射、化学治疗和激素治疗,均经病理学检查确诊,标本离体后迅速放入液氮中保存,备行荧光定量PCR检测。
1.2 细胞株和试剂 人子宫内膜癌Ishikawa和HEC-1-A细胞(承德医学院基础研究所冻存)。Livin-siRNA、Livin阴性对照(Livin-NC)序列(苏州吉玛公司),FBS、PRMI 1640培养基(美国Gibco公司),Lipofectamine 2000、荧光定量PCR试剂盒(美国Invitrogen公司),TRIzol(美国Ambion公司),反转录PCR试剂盒(联科生物公司),Transwell小室(美国Corning公司),Matrigel基质胶(美国BD公司)。
1.3 主要仪器 CO2恒温培养箱(美国Thermo公司),倒置显微镜(日本Olympus公司),紫外分光光度仪(美国CKMAN Coulter公司),荧光定量PCR仪(美国Bio-Rad公司),SORVALL Biofuge fresco冷冻离心机(德国Kendro Labrotary公司),电脑三横高压电泳仪RDY-1000A(北京荣阳经典科技有限公司)。
1.4 荧光定量PCR检测Livin mRNA表达 采用TRIzol法提取组织总RNA,应用紫外分光光度仪鉴定其纯度,以1 μL RNA为模板,反转录合成互补DNA(cDNA)第1条链,应用荧光定量PCR试剂盒进行荧光定量PCR反应。目的基因Livin和管家基因GAPDH引物由大连宝生物公司设计合成。Livin正向引物为5’-ACG GAG CAT GCC AAG TGG T-3’,Livin反向引物为5’-CTG CAC ACT GTG GAC AAA GTC TCT-3’(扩增片段78 bp);GAPDH正向引物为5’-GCA CCG TCA AGG CTG AGA AC-3’,GAPDH反向引物为5’-TGG TGA AGA CGC CAG TGG A-3’(扩增片段138 bp)。反应条件:94 ℃ 2 min,94 ℃ 30 s、60 ℃ 30 s、72 ℃ 1 min共40个循环。每样本设3个复孔,实验重复5次。采用2-△△Ct法进行相对定量分析。
1.5 细胞转染 将液氮中冻存的Ishikawa和HEC-1-A细胞复苏,常规培养在含10%FBS的PRMI 1640培养基中,取对数生长期细胞用于实验。实验分为ISK-I组和HEC-I组(均转染Livin-siRNA)、ISK-NC组和HEC-NC组(均转染Livin-NC)、ISK-B组和HEC-B组(均仅以10%FBS培养细胞)。按照Lipofectamine 2000说明书配制转染试剂,采用脂质体法将Livin-siRNA和Livin-NC序列瞬时转染Ishikawa和HEC-1-A细胞。
1.6 Western印迹检测Livin蛋白的表达 转染后48 h,收集各组蛋白质,采用BCA法蛋白质定量后,取40 μg进行凝胶电泳实验。以封闭液封闭2 h,一抗(1∶1 000)于4 ℃孵育过夜,二抗(1∶3 000)孵育1 h。ECL发光液显影后应用天能6100图像分析系统进行成像和定量分析,计算目的蛋白质Livin/内参蛋白质β-actin的相对表达量。实验重复5次。
1.7 Transwell小室检测细胞侵袭和迁移能力 侵袭实验:将Matrigel基质胶与PRMI 1640培养基按1∶8比例混匀,每个小室以100 μL混合液均匀包被小室基底膜。收集转染48 h的各组细胞,PRMI 1640培养基重悬,调整细胞密度至5×105/mL,每孔上室加入100 μL单细胞悬液,下室加入500 μL含20% FBS培养基,置于CO2培养箱中培养48 h。擦净Matrigel基质胶和上室的细胞,甲醇固定,0.1%结晶紫染色后取下微孔滤膜,树胶封片。显微镜下随机计数6个视野细胞数量取其平均值,每组3个小室,实验重复2次。迁移实验:小室不用铺Matrigel基质胶,在CO2培养箱中的培养时间为36 h,其余操作同侵袭实验。

2 结 果
2.1 子宫内膜癌组织临床病理特征 62例子宫内膜癌患者的平均年龄为(54.8±4.7)岁,其中年龄<60岁38例,≥60岁24例;肌层浸润深度<1/2 44例,≥1/2 18例;病理分级G1级46例,G2级10例,G3级6例;依据国际妇产科联盟(FIGO)2009年手术病理分期,Ⅰ或Ⅱ期54例,Ⅲ或Ⅳ期8例;有淋巴结转移11例,无淋巴结转移51例。
2.2 Livin mRNA在子宫内膜癌组织中的表达 Livin mRNA在子宫内膜癌组织中的相对表达量(8.624±0.264)显著高于非典型增生组织(3.497±0.186)和正常内膜组织(1.000±0.098,P值均<0.05)。
2.3 Livin表达与子宫内膜癌临床病理特征的关系 Livin mRNA在年龄<60岁与≥60岁的患者中的相对表达量分别为8.314±0.156和8.336±0.117,在肌层浸润深度<1/2与≥1/2的患者中的相对表达量分别为6.392±0.149、9.227±0.216,在病理分级为G1级与G2+G3级的患者中的相对表达量分别为7.068±0.103和9.392±0.125,在FIGO分期为Ⅰ或Ⅱ期与Ⅲ或Ⅳ期的患者中的相对表达量分别为8.296±0.214和8.913±0.207,在有或无淋巴结转移的患者中的相对表达量分别为8.494±0.256和9.124±0.118。组间比较结果显示,Livin mRNA仅在不同肌层浸润深度(t=7.325,P=0.016)和不同病理分级(t=5.578,P=0.027)的患者间的差异有统计学意义。
2.4 转染后Livin蛋白表达 转染后48 h,ISK-I组(0.395±0.012)和HEC-I组(0.514±0.022)的Livin蛋白相对表达量分别显著低于ISK-NC组(1.108±0.048)、HEC-NC组(1.426±0.062)、ISK-B组(1.164±0.054)和HEC-B组(1.448±0.071,P值均<0.05),见图1。
2.5 干扰Livin对细胞侵袭和迁移能力的影响 侵袭实验结果显示,ISK-I组[(20.2±3.6)个]和HEC-I组[(28.8±3.2)个]的穿膜细胞数分别显著少于ISK-NC组[(42.8±4.2)个]和HEC-NC组[(56.7±3.8)个,P值均<0.05],见图2。迁移实验结果显示,ISK-I组[(22.5±2.2)个]和HEC-I组[(30.8±2.4)个]的穿膜细胞数分别显著少于ISK-NC组[(52.8±3.6)个]和HEC-NC组[(58.9±4.5)个,P值均<0.05],见图3。
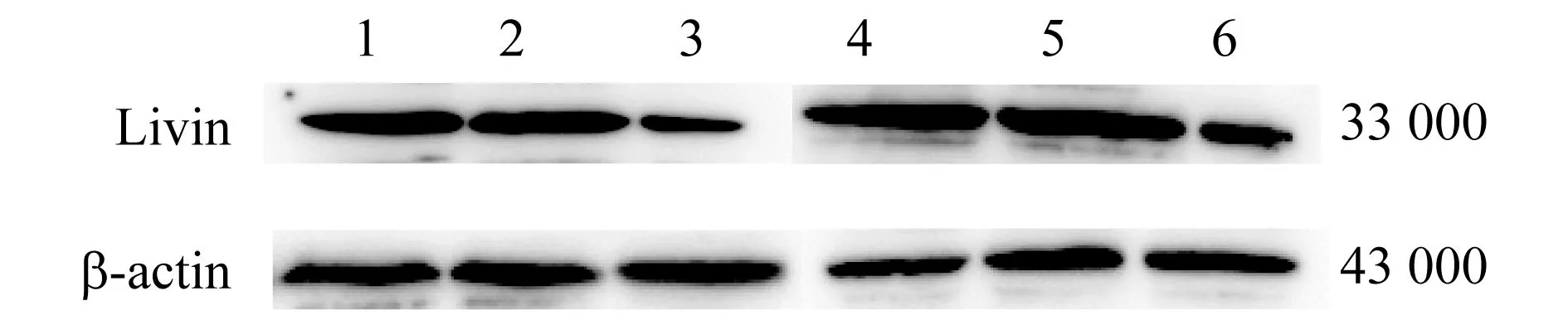
1 ISK-B组 2 ISK-NC组 3 ISK-I组 4 HEC-B组 5 HEC-NC组 6 HEC-I组图1 转染后Livin蛋白表达的电泳图
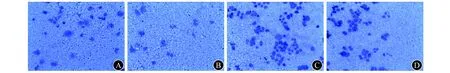
A ISK-NC组 B ISK-I组 C HEC-NC组 D HEC-I组图2 侵袭实验结果(0.1%结晶紫染色,×200)
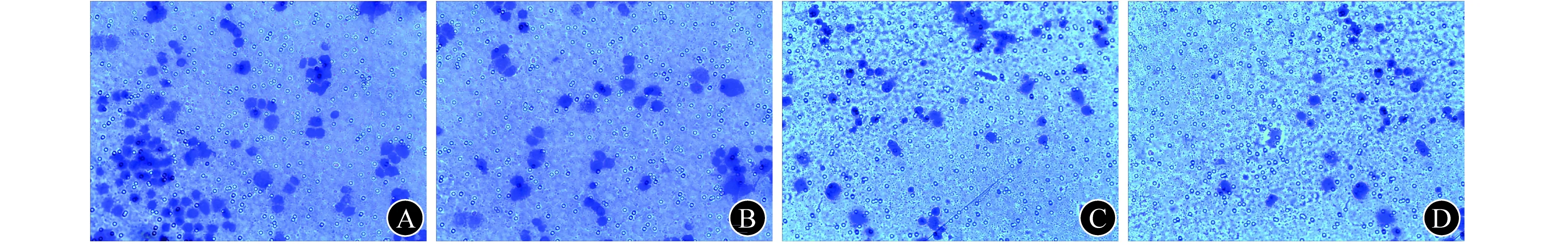
A ISK-NC组 B ISK-I组 C HEC-NC组 D HEC-I组图3 迁移实验结果(0.1%结晶紫染色,×200)
3 讨 论
Livin作为IAPs家族成员,在肿瘤发生、信号转导、自然免疫等多方面发挥作用[8]。Chen等[9]的研究发现,Livin在食管癌组织中的阳性表达与肿瘤分期有关。Liang等[10]应用免疫组织化学技术检测Livin在59例胃癌组织中的表达,结果显示Livin的阳性率为52.5%,且Livin的表达与肌层浸润深度和淋巴结转移均有关。Wang等[11]通过研究Livin在结直肠腺癌、腺瘤和正常黏膜组织中的表达,发现Livin在结直肠正常黏膜组织中不表达,而在腺瘤的隐窝、结直肠癌的癌变上皮中均有表达,提示Livin在结直肠癌的发生中起到一定作用。Ye等[12]的研究发现,Livin在前列腺癌组织中高表达,并通过调节细胞G1/S期促进细胞增殖,推测Livin可能在前列腺癌的发生和细胞增殖方面起重要作用。本研究发现,Livin在子宫内膜癌组织中表达上调,荧光定量PCR结果提示Livin表达与肌层浸润深度和病理分级有关,而与患者的年龄、FIGO分期和有无淋巴结转移无关。提示,Livin可能参与了子宫内膜癌的恶性演进过程,在子宫内膜癌的发生、发展过程中发挥了一定作用。
肿瘤的浸润转移导致多种信号通路和通路上多基因激活状态发生改变,从而使得肿瘤细胞具有转移的潜能[13]。张生军等[14]的研究发现,沉默Livin基因的表达可使胃癌SGC7901细胞体外侵袭和迁移能力明显降低。Cho等[15]应用RNA干扰技术抑制Livin基因在肝癌HepG2细胞中的表达,发现HepG2细胞的侵袭和迁移能力显著下降。Myung等[16]在研究Livin对大肠癌SW480和DK01两种细胞生物学行为的影响时发现,应用RNA干扰技术抑制Livin基因的表达,可显著抑制两种结直肠癌细胞的浸润和转移能力,而过表达Livin则可促进细胞的侵袭和转移能力。本研究采用脂质体法将Livin-siRNA转染人子宫内膜癌Ishikawa和HEC-1-A细胞,Transwell小室侵袭和迁移实验结果均显示,转染后两种内膜癌细胞的穿膜细胞数均显著减少,说明干扰Livin表达可抑制Ishikawa和HEC-1-A细胞的侵袭和迁移能力,Livin在子宫内膜癌的侵袭和转移过程中发挥了一定作用,与上述研究结果相符。
综上所述,Livin在恶性肿瘤的发生和转移中发挥一定作用,可将其作为肿瘤的预测因子进行深入研究,但其预测价值尚需前瞻性、多中心研究的进一步证实。

