经心尖途径行主动脉瓣植入术经验
朱 鹏,郑少忆,姜 妤,李 偲,刘克玄,崔 凯,修建成,宾建平,侯晓敏,腾中华,陈 曌
南方医科大学南方医院1心血管外科,2麻醉科,3心内科,4手术室,5影像科,广东 广州 510515
经导管主动脉瓣植入术(TAVI)目前已被认为是治疗高危主动脉瓣病变的首选方法[1]。在北美和欧洲广泛采用的是SAPIEN和CoreValve,并以主动脉瓣狭窄病变为主的患者[2]。此2款经股动脉植入瓣膜主要依靠横向支撑力维持其位置,因此对于主动脉瓣关闭不全患者不能完全适合,围手术期出现瓣膜移位和瓣周漏风险明显增加[3]。目前的相关指南并不推荐主动脉瓣关闭不全患者接受此类瓣膜[4]。因此,对于以主动脉瓣关闭不全的患者,我们采用国产JValveTM系统经心尖TAVI治疗以主动脉瓣关闭不全为主的患者,初步取得满意的治疗效果,此项技术自2017年获准应用临床以来,仅在几个较大心脏中心开展,值得借鉴的经验非常有限,现将经验总结如下。
1 资料与方法
1.1 病例资料
本研究为回顾性病例研究。2018年9~11月我科共连续完成经心尖TAVI手术3例,3例患者均为主动脉瓣重度关闭不全。男性2例,女性1例,年龄为82、76、78岁。3例患者术前超声心动图检查提示主动脉瓣为三叶瓣,1例存在轻度主动脉瓣狭窄。1例患者术前即为II度I型房室传导阻滞,其余2例为窦性心律。3例患者无明显二尖瓣和或三尖瓣病变。1例患者为左肺鳞癌、前列腺癌放疗术后;1例为前列腺癌切除术后。2例术前合并高血压;1例合并糖尿病;1例合并外周血管病;2例合并慢性肺部疾病。术前体质量指数19.8±3.8 kg/m2,术前血肌酐137±23 μmol/L,肺动脉压为34±12 mmHg(1 mmHg=0.133 kPa),射血分数为(47±13)%,左心室舒张期末径为61±9 mm。本研究已获得医院伦理会批准,所有患者及家属均签署相关知情同意书。
1.2 术前准备
术前所有患者在接受常规检查外,均接受多层螺旋CT检查主动脉根部、冠状动脉、胸腹主动脉。超声心动图评估心脏瓣膜病变程度及左心室功能。MSCT可以评估:主动脉瓣环大小;测量术中植入J-valve输送系统最佳投照角度;测量左右冠状动脉距离主动脉瓣瓣环高度,避免术中人工瓣遮挡冠状动脉开口可能;评估冠状动脉情况,排除严重冠状动脉病变可能;重建胸腹主动脉及髂动脉,评估从股动脉造影入路血管情况,避免可能存在血管迂曲、动脉瘤、夹层可能(图1)。
所有患者术前均经Euroscore II评分在7分以上,征得家属同意,并经我院包括心内科、心外科、麻醉科、介入科、血管外科、影像科在内的心脏团队综合评估推荐进入TAVI队列后方安排相关手术。
1.3 手术方法
3例患者均在我院介入导管室内进行,术前介入导管室均经严格消毒,患者仰卧位,静脉+吸入混合麻醉,右颈内静脉植入中心静脉导管并在中心静脉导管近心端植入心内膜临时起搏导线。麻醉诱导后,经食道超声心动图再次评估心脏瓣膜病变情况及瓣环大小。体外循环设备及人员备用。
在DSA下再次确定心尖位置及最佳入路位置,3例患者均在左锁骨中线与腋前线之间第5肋间平行肋骨切开约5 cm,逐层入胸,切开心包后暴露左心室裸区,肝素化后于心尖裸区行双层3-0 prolene带垫片荷包缝合。通常选择MSCT测量瓣环oversize 5%~10%的人工瓣膜并于另一操作台进行组装。采用Seldinger法穿刺并将导丝通过主动脉瓣进入降主动脉,扩张鞘反复扩张穿刺点后,J-valve输送系统经导丝进入左心室,DSA引导下至主动脉瓣上。先释放3枚定位键,并在食道超声监测下分别进入3个主动脉瓣瓣窦,回撤输送系统将支架瓣膜定位在瓣环水平,无需临时起搏器快速起搏,释放支架瓣膜,移除输送系统后超声心动图再次评估瓣膜位置、功能和瓣周漏情况(图2)。心电图是否出现传导阻滞。导丝撤出后打结荷包缝线,中和肝素后留置胸腔引流管,常规关胸。3例均未在介入导管室拔出气管插管。术后常规口服华法林至少6月,保持国际标准化比值1.5~2.5。
1.4 随访
所有患者于术后1周、2周和1月接受超声心动图、胸部正侧位片、心电图及凝血功能检查(图3)。

图1 患者术前接受MSCT检查
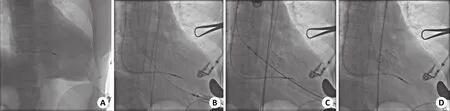
图2 TAVI手术过程

图3 术后X-ray
2 结果
3例患者手术均获得成功,术后主动脉瓣跨瓣压差降低(63.55±13.89vs7.90±5.99 mmHg)。术后返回重症监护室后均于24 h内拔出气管插管,监护室停留时间2.13±0.85 d,术后胸腔引流液量在100 mL以内。1例患者术前为II度I型房室传导阻滞患者术后出现高度房室传导阻滞,经Holter明确高度传导阻滞后安置永久心脏起搏器,其余2例无明显传导阻滞。术中出现一过性瓣周漏1例,给予鱼精蛋白后瓣周漏消失。所有患者术后无心包积液、急性冠脉综合征、脑卒中等并发症,恢复顺利,近期临床效果显著。
3 讨论
既往认为胸部正中切口在体外循环支持下主动脉瓣置换术是治疗主动脉瓣疾病的金标准,但是对于大约30%的高危主动脉瓣病变患者并不适合,围手术期风险过大且患者获益受到限制[4-5]。虽然经导管主动脉瓣球囊扩张术可以改善部分主动脉瓣狭窄患者症状,但无法从根本解决此类患者病因[6-7]。2002年第1例经导管主动脉瓣植入术出现,使高危的主动脉瓣病变患者可以不经体外循环即可获得满意主动脉瓣功能,为治疗中危和高危主动脉瓣病变患者提供新的治疗方式[1,8]。
对于患者是否采用TAVI技术解决主动脉瓣病变问题,需要术前根据患者具体情况经TAVI团队仔细评估[9-11]。目前的指南推荐:对于有主动脉瓣置换指征但评分为高危患者,评估其术后生存时间超过12月,可推荐其行TAVI术;中危的需要行主动脉瓣置换术的患者,TAVI术亦可作为一种治疗选择。其手术相对禁忌症包括:围手术期发生死亡或严重不可逆并发症的风险>50%,术前存在3个以上主要器官功能衰竭或存在外科手术无法矫正的解剖学因素;高危患者是指STS评分>8%、存在增加手术风险的解破学因素或体质极差[12]。本研究心脏团队在遵循指南推荐意见基础上,严格把控入选标准和排除标准,术前均充分考虑每个患者病情,从而给予针对性治疗方案。
目前TAVI手术常用的手术径路包括经股动脉和经心尖2种[13]。目前中国大陆地区采用的经股动脉植入Venus-A瓣膜主要依靠横向支撑力保持瓣膜的位置,因此主要适应症仍然以主动脉瓣狭窄为主,术前需仔细评估输送系统血管入路,对于术前CT造影提示血管入路存在严重迂曲、狭窄、钙化和或存在不同程度附壁血栓的患者,经股动脉为相对禁忌症[13-14]。而且Venus-A通常需要冠状动脉开口距离主动脉瓣水平距离超过10 mm,对于低于10 mm的病例,术中出现冠状动脉开口被瓣膜支架遮挡可能性明显升高,需先植入导丝进行冠状动脉保护,明显增加手术复杂性及并发症发生率[15]。经心尖植入的J-valve因瓣膜设计特殊性,可忽略冠状动脉开口高度对手术过程的影响,同时此种操作顺血流方向,距离主动脉瓣近,对外周血管无要求,术中避免主动脉弓干扰,也可明显减少造影剂用量,术中采用3个锚定装置使定位更精确,优秀的纵向和横向支撑力使瓣膜位置更加牢靠,术后移位风险更小[14,16-17]。
本研究经验体会,经心尖途径TAVI手术成功的关键是在于心脏团队的建立和密切配合,因为TAVI手术涉及相关的科室和人员,从患者入院到出院过程需要多个科室人员精心准备和配合,各个科室人员需熟悉及明确在诊疗过程中自身责任和任务,术前仔细分析围手术期可能出现风险,及时告知并经团队讨论制定解决方案,对于参加TAVI手术的所有人员、设备、耗材术前必须反复明确并预备应急预案,制定出现特殊情况的抢救方案。
TAVI手术围手术期可能出现并发症包括:瓣周漏、瓣膜脱位、传导阻滞、急性冠脉综合征、心脏破裂、脑卒中等[18-21]。1例患者术中出现一过性瓣周漏,给予鱼精蛋白后消失,轻度主动脉瓣瓣周漏在TAVI手术可以接受,可再次行球囊扩张或临床观察。因人工瓣膜支架部分位于主动脉瓣瓣环以下,可能压迫心脏传导束,术后72 h内可能出现延迟性传导阻滞,心内膜起搏导线可延长留置时间,避免突然出现传导阻滞导致晕厥发生。
本组3例患者手术过程顺利,术后恢复顺利,预后良好,但由于本研究纳入患者数量和随访时间均有限,仅能表明采用经心尖TAVI治疗高危主动脉瓣关闭不全患者具有可行性。目前国内经心尖TAVI手术进入快速发展期,有报道2年随访均可获得良好治疗效果[4],但经验仍然有效,中远期疗效仍然需要多中心随访观察。

