超高效液相色谱-串联质谱法同时测定动物肌肉组织中6种氨基糖苷类药物残留
钟名琴,黄 婷,吴雯娟,罗 燕*,丁燕玲
(1.深圳市农产品质量安全检验检测中心,广东 深圳 518000;2.广东省市场监督管理局食用农产品监管重点实验室,广东 深圳 518000)
氨基糖苷类药物(AGs)是一类含有氨基糖苷键的广谱性抗生素,对革兰氏阴性菌和革兰氏阳性菌均具有较强的抗菌活性[1]。近年来,由于其高效、低价,在畜牧兽医领域中常用于治疗细菌感染病,以亚剂量给药预防疾病。此外,在畜禽、水产养殖业也常添加到饲料中促进动物生长发育,以提高饲料利用。AGs对动物组织具有很强的亲和力,给药后多天仍可在动物体中检测出药物残留,长期高剂量使用药物会对动物产生蓄积毒性,甚至通过食物链作用传递或其他渠道摄入人体中,对人体和动物造成危害,产生肾毒性、听力减退、耳鸣或耳部饱满感等耳毒性和神经肌肉阻滞等[2-3]。为保障食品安全,欧盟明确规定禁止使用AGs作为畜禽促生长添加剂,美国食品药品监督管理局(FDA)及许多国家和机构明确规定了该类药物在食品中的最大残留限量要求。我国也加强了对动物源性食品中该类药物的残留监控,如农业部公告第235号规定链霉素/双氢链霉素在肌肉中的最大残留限量为600 μg·kg-1。
目前,国内外检测该类抗生素的方法主要有微生物法、分光光度法、免疫分析法、气相色谱法、高效液相色谱法和液相色谱-串联质谱法等[4-8]。其中,液相色谱-串联质谱法是检测该类抗生素应用较广泛的方法[9-12]。动物源性食品基质复杂,文献报道的检测方法大多检测周期长,样品前处理过程繁琐,基质效应严重,甚至需要衍生化处理等,这给目标物的快速定性、准确定量检测带来较大困扰。
本试验对样品前处理方法和质谱条件进行优化,建立具有高灵敏度、高选择性的UPLC-MS/MS法同时快速准确定性、定量检测动物肌肉组织中链霉素、双氢链霉素、丁胺卡那霉素、卡那霉素、壮观霉素和潮霉素B等6种氨基糖苷类药物。该方法操作简便,能大幅缩短检测周期,灵敏度高,还能有效避免七氟丁酸等离子对试剂造成的仪器污染及离子抑制等问题,为动物源性食品中氨基糖苷类药物监控提供快速、准确可靠的定性和定量技术。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器
Aglient 1290超高效液相色谱仪、配有电喷雾(ESI)离子源的AB Sciex Triple Quad TM 5500质谱仪(美国AB Sciex公司)、N-EVAP-24型全自动氮吹仪、IKA旋涡混合器、梅特勒PL602E型天平、Sigma 3-30KS离心机、Milli-Q Integral3型超纯水仪、奥特赛斯AS系列超声波清洗机、Waters HLB(6cc 200 mg)固相萃取柱。
1.1.2 药品与试剂
甲醇(色谱纯)、甲酸(色谱纯)、异丙醇(色谱纯)、三氯乙酸(分析纯)、氨水(优级纯)等。
链霉素、双氢链霉素、丁胺卡那霉素、卡那霉素、壮观霉素、潮霉素B:纯度高于90.0%,均为德国Dr.Ehrenstorfer公司产品。
1.2 样品制备
取适量新鲜猪肉组织,充分绞碎且均质,于-20℃避光保存。
1.3 标准储备液和混合标准工作液的配制
准确称取链霉素、双氢链霉素、丁胺卡那霉素、卡那霉素、壮观霉素、潮霉素B的标准品,分别用水溶解并稀释成浓度为1.00 mg·mL-1的标准储备液,4℃避光保存6个月。再分别移取适量上述各物质标准储备液用水逐级稀释成适当浓度的混合标准工作液,现配现用(AGs易吸附于玻璃制品上,实验过程中应尽量使用塑料制品)。
1.4 样品前处理
1.4.1 提取
准确称取经均质的猪肉样品2.0 g(精确至0.01 g),置于50.0 mL离心管中,加入5%三氯乙酸溶液5 mL,涡旋30 s,于水平振荡器上振荡提取15 min,9 000 r·min-1离心5 min,收集上清液。再加入5 mL 5%三氯乙酸溶液重复操作1次,合并上清液,用甲酸或氨水调节pH为6.5±0.5,备用,净化前9 000 r·min-1离心5 min。
1.4.2 净化
取全部上清液10.0 mL以1滴·3 s-1流速过依次用5 mL甲醇和3 mL水活化的HLB固相萃取柱(规格:6cc 200 mg),用水3 mL淋洗,减压抽干。再以流速1滴·3 s-1用甲酸/异丙醇/水溶液2 mL(10∶5∶85,v/v/v)洗脱入塑料离心管中,过0.22 μm微孔滤膜,上机测定。
1.5 UPLC-MS/MS条件
1.5.1 超高效液相色谱条件
色谱柱:ACQUITYUPLC BEH C18(1.7 μm,3.0 mm×100 mm);流动相A为甲酸铵溶液200 mmol(pH 3);流动相B为乙腈(色谱纯);柱温40.0℃;进样体积5.0 μL。具体梯度洗脱程序见表1。
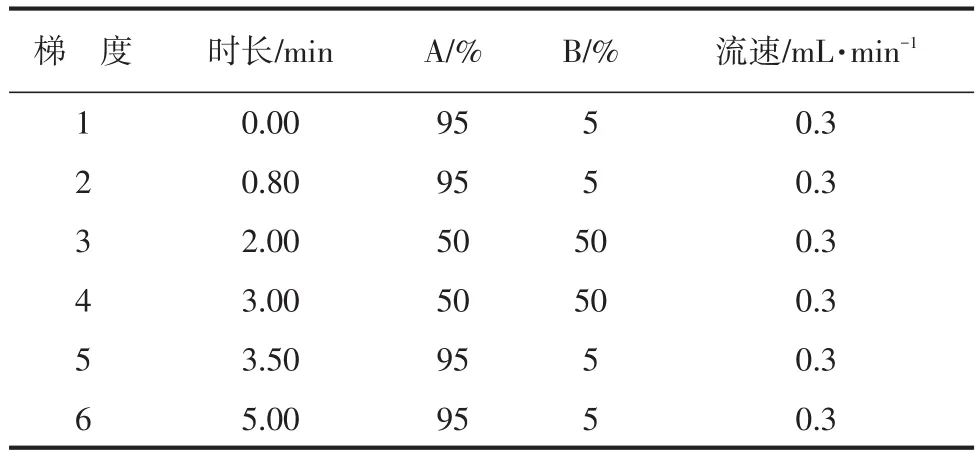
表1 梯度洗脱程序
1.5.2 质谱条件
离子源:电喷雾离子源;扫描方式:正离子扫描;检测方式:多反应监测(MRM);电喷雾电压:5.5 kV;离子源温度:550℃;气帘气压力:35.0 psi;碰撞气压力:9 psi;雾化器压力:55.0 psi;辅助加热器压力:55.0 psi。
保留时间、定性离子对、定量离子对、去簇电压及碰撞能量见表2。空白基质分别添加1 000 μg·kg-1链霉素、双氢链霉素、丁胺卡那霉素、卡那霉素、壮观霉素和潮霉素B药物的色谱图见图1。
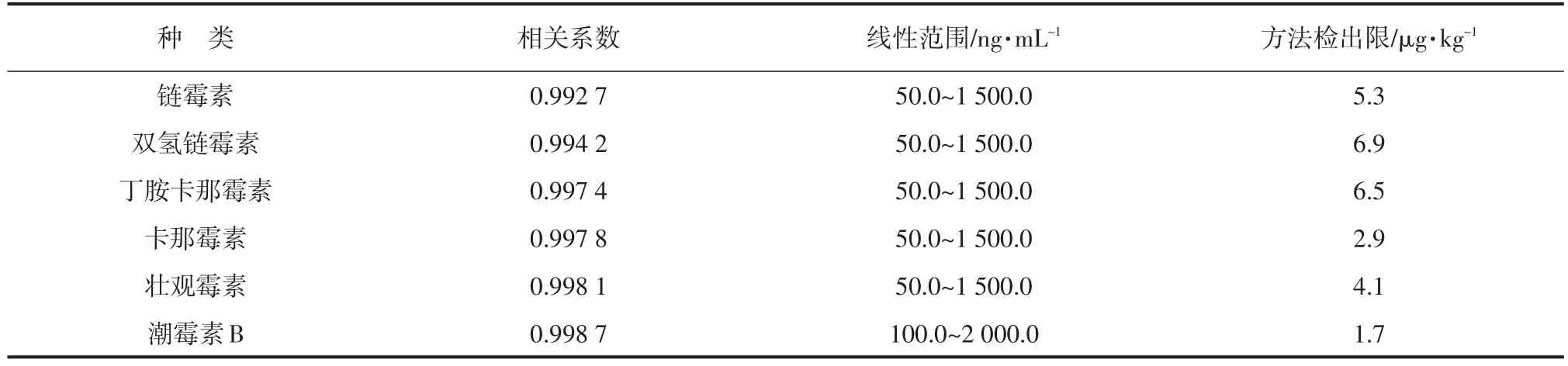
表2 质谱参数
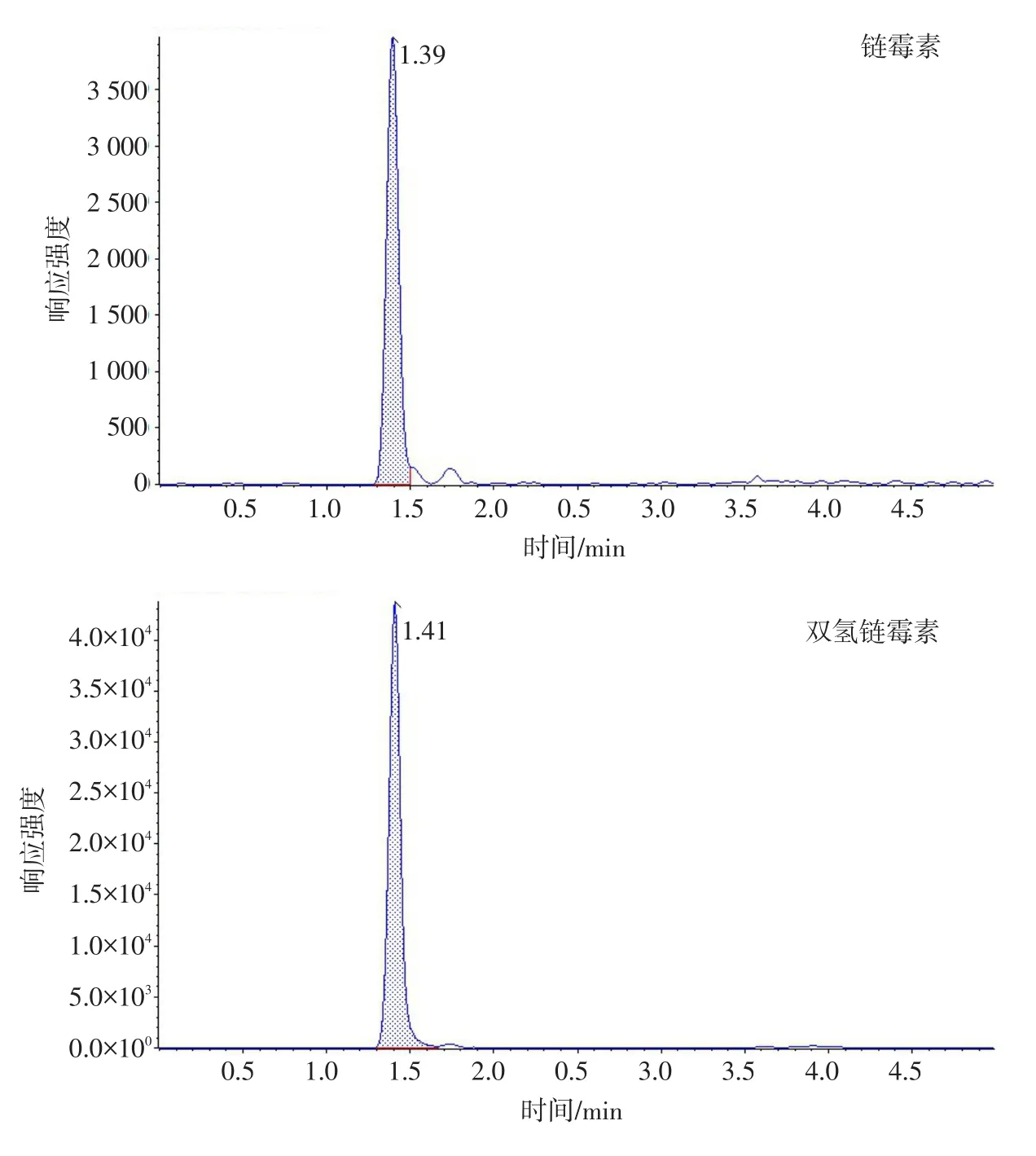

图1 空白样品中添加1 000 μg·kg-1氨基糖苷类药物的色谱图
2 结果与讨论
2.1 标准曲线
准确称取6个空白猪肉样品经上述样品前处理方法处理,获得空白样品提取液。分别用空白样品提取液配制链霉素、双氢链霉素、丁胺卡那霉素、卡那霉素、壮观霉素混合外标浓度为50.0、100.0、300.0、500.0、1 000.0和1 500.0 ng·mL-1系列标准曲线及潮霉素B外标浓度为100.0、300.0、500.0、1 000.0、1 500.0和2 000.0 ng·mL-1系列标准曲线,供液相色谱串联质谱测定。链霉素、双氢链霉素、丁胺卡那霉素、卡那霉素、壮观霉素和潮霉素B基质试验峰面积与相应回收浓度的线性关系良好,其相关系数分别为0.992 7、0.994 2、0.997 4、0.997 8、0.998 1、0.998 7,见表3。
2.2 方法检出限确定
以空白猪肉样品为基质,做7个平行添加试验,链霉素、双氢链霉素、丁胺卡那霉素、卡那霉素、壮观霉素的阳性添加浓度均为20.0 μg·kg-1,潮霉素B阳性添加浓度为100 μg·kg-1,按照上述样品前处理方法全过程进行预处理和测定,平行样本n=7。根据各样本检测值计算出平均值X及标准偏差Sb,按公式检出限(MDL)=(k×Sb×C)/X(k为置信因子,一般取3)计算,链霉素、双氢链霉素、丁胺卡那霉素、卡那霉素、壮观霉素和潮霉素B检测限分别为5.3、6.9、6.5 、2.9、4.1和1.7 μg·kg-1,结果见表3。
2.3 方法回收率和精密度验证
用空白基质样品分别对链霉素、双氢链霉素、丁胺卡那霉素、卡那霉素、壮观霉素进行20.0、100、500 μg·kg-1及潮霉素 B 进行 100、200、1 000 μg·kg-13个水平的添加回收实验,每个水平取6个平行样,按1.2.3中的方法进行处理,供液相色谱串联质谱测定。其平均回收率和相对标准偏差结果见表4。

表3 标准溶液线性参数

表4 方法加标回收率和相对标准偏差(n=6)

续表4
由表4可知,该方法的回收率较好,链霉素、双氢链霉素、丁胺卡那霉素、卡那霉素、壮观霉素和潮霉素B的回收率范围分别为80.6%~96.9%、93.8%~102.0%、72.4%~104.0%、84.8%~99.5%、80.6%~99.0%和78.8%~97.9%,方法检出限低、重复性好、定性可靠、定量准确,能稳定提取猪肉中链霉素、双氢链霉素、丁胺卡那霉素、卡那霉素、壮观霉素和潮霉素B,并且峰形受基质的干扰比较小。
3 结论
本方法建立了动物肌肉组织中链霉素、双氢链霉素、丁胺卡那霉素、卡那霉素、壮观霉素和潮霉素B的超高效液相色谱-串联质谱测定方法。试验结果表明,该方法检出限低、回收率较好、灵敏度高。通过优化实验过程及仪器参数,该方法简单、快捷、易操作,可大幅缩短检测时间和节约人力物力,能有效消除基质干扰,适用于动物肌肉组织中链霉素、双氢链霉素、丁胺卡那霉素、卡那霉素、壮观霉素和潮霉素B的准确定性、定量检测。

