不同正压通气方式在早产儿呼吸窘迫综合征撤机后的应用比较
张志华 敖桢桢
近年来随着二胎政策大力的推广,选择分娩二孩的产妇越来越多,与此同时各种早产、流产事件也随之而来,早产儿作为临床常见现象,可并发多种疾病,其中呼吸窘迫综合征是早产儿的多发疾病[1]。目前临床对于早产儿呼吸窘迫综合征多采用呼吸支持、提供肺表面活性物质等对症治疗[2],自无创呼吸支持的出现已逐渐取代了过去有创疗法,常用的有鼻持续气道正压通气(nasal continuous positive airway pressure,NCPAP) 与经鼻间歇正压通气(nasal intermittent positive pressure ventilation,NIPPV),但究竟孰优孰劣,仍有待做进一步观察研究[3],本文旨在探讨NCPAP与NIPPV对早产儿呼吸窘迫综合征撤机后病情恢复的影响,现报道如下。
1 资料与方法
1.1 一般资料
本研究病例资料均来源于2016年1月—2018年1月我院接收的60例早产儿呼吸窘迫综合征患儿,纳入标准[4]:(1)出生时胎龄不足36周的早产儿;(2)符合呼吸窘迫综合征的诊断标准;(3)患儿家属对本次研究项目知情同意;排除标准:(1)气胸、复杂性先天性心脏病、其它先天畸形等所致的呼吸衰竭;(2)存在原发性肺疾病或心肝肾功能异常等患儿;(3)宫内感染、造血系统异常及高风险出血者;(4)严重贫血及循环衰竭;(5)住院时间<72 h者。以随机数字表法为分组依据,将其分为对照组与试验组,每组各30例,对照组男23例,女7例,胎龄28~36周,平均(32±4)周;体质量1 050~3 200 g,平均(1 788±412)g;试验组男24例,女6例,胎龄28~36周,平均(32±4)周;体质量1 080~2 370 g,平均(1 645±425)g。本次研究工作已获得院内伦理委员会批准,两组患儿在性别、胎龄、体质量等基线资料上对比差异均无统计学意义(P>0.05),存在可比性。
1.2 方法
1.2.1 用药方法 两组患者均用气管导管插管,并加入猪肺磷脂注射液(意大利凯西制药公司,规格:1.5 mL∶120 mg,批号:H20080429),按照100~200 mg体质量每次给予1.25~2.50 mL/kg。连接呼吸机,选择合适模式,根据血气分析程度调整仪器参数。
1.2.2 通气方法 试验组采用NIPPV治疗,应用双鼻塞密闭环路方式,使用德国斯蒂芬Stephan呼吸机,模式为NIPPV,吸气峰压(peak inspiratory pressure,PIP)15~25 cmH2O,呼气末正压通气(positive end expiratory pressure,PEEP) 5~10 cmH2O,根据血氧饱和度调节FiO2,范围设定0.21~0.60,呼吸频率(RR)一般在20~60 min,吸气时间设定为(Ti)0.30~0.45 s。当参数降至RR≤20次/min时,平均气道压力(MAP)≤8 cmH2O,吸入气中的氧浓度分数(FiO2)≤0.3可以转换为持续气道正压(CPAP)并逐渐撤离机器。
对照组用NCPAP治疗,应用双鼻塞密闭环路方式,使用德国斯蒂芬Stephan呼吸机,模式为NCPAP,压力为5~10 cmH2O。每次根据血气结果调节参数:PEEP:1~2 cmH2O,FiO2:0.05。当参数降低到CPAP≤4 cmH2O,FiO2≤0.3时,患儿呼吸稳定,没有吸气三凹征,机器可以撤离。
1.3 观察指标
观察两组通气吸氧前,通气2 h、通气48 h以及脱机后24 h动脉血气变化,其中动脉血气采用i-STAT 血气分析仪,包括pH、PaCO2以及氧合指数(OI)=MAP×FiO2×100/PaO2(mmHg)[5];统计两组撤机失败率及失败原因。
1.4 统计学处理
全文数据均采用SPSS 19.0统计软件进行计算分析,计量资料用(均数±标准差)表示,采取t检验,计数资料用χ2检验,P<0.05表示数据差异具有统计学意义。
2 结果
2.1 两组患者不同时间段血气分析变化
两组患儿的治疗前pH、PaCO2以及OI对比差异均无统计学意义(P>0.05);在经过不同正压通气后,两组PaCO2、OI水平在通气6 h、24 h后较通气前有明显改善,但组间对比发现,试验组通气6 h、24 h的pH、OI水平明显高于对照组,PaCO2水平低于对照组,差异有统计学意义(P<0.05),详情见表1。
表1 两组患者不同时间段血气分析变化(n=30,±s)
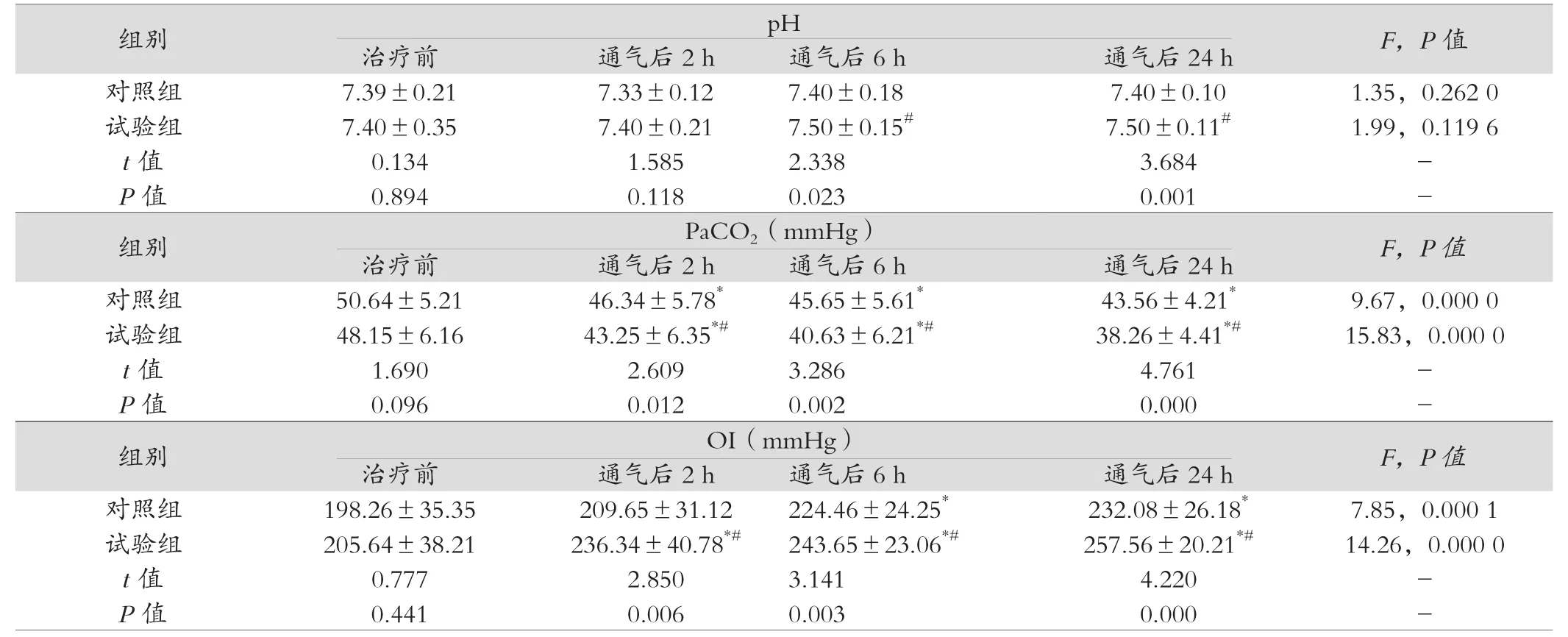
表1 两组患者不同时间段血气分析变化(n=30,±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
?
2.2 对比两组撤机失败率及失败原因
试验组撤机失败率明显低于对照组,差异有统计学意义(P<0.05),详情见表2。

表2 对比两组撤机失败率及失败原因[n=30,例(%)]
3 讨论
呼吸窘迫综合征及其后遗症支气管肺发育不良是早产儿的常见并发症,占早产儿并发症死亡的21%[6]。相关研究和分析认为该病的病因主要是由于儿童缺乏肺泡表面活性物质(PS),早产儿在没有PS的情况下,肺泡表面张力升高,影响肺功能正常运作,导致气体交换受损,同时由于肺泡萎缩塌陷,使得周围血管血液不畅,肺内短路,氧合功能无法正常进行[7-8]。目前临床对于早产儿呼吸窘迫多采用外源性PS治疗,但起效时间长,患儿无法在短期内再次产生PS,容易导致肺泡二次萎缩[8]。因此越来越多的医师选择药物与通气方式联合的方式,以期改善肺泡周围血液循环,修复肺泡功能[9]。
应用无创呼吸支持疗法新生儿呼吸窘迫综合征(NRDS)一直是新生儿领域临床研究的重点。目前NCPAP与NIPPV是两种常用的正压通气呼吸支持,NCPAP是一种主要的无创辅助通气模式,在中国广泛使用,因其能够持续提供气道正压,维持肺部功能[10]。然而,由于部分患儿自主呼吸较弱且呼吸暂停频繁,仅采用NCPAP呼吸支持力度较弱,难以达到理想效果;而NIPPV能够应对各种类型的患儿,并按照预设的呼吸参数辅助通气,同时由于设置间歇吸气的频率,呼吸支持效果更强[11]。本研究应用随机对照的研究方法,比较两者在早产儿呼吸窘迫综合征中的疗效发现:两组患儿的治疗前pH、PaCO2以及OI对比差异均无统计学意义(P>0.05);在经过不同正压通气后,两组PaCO2、OI水平在通气6 h、24 h后较通气前有明显改善,但组间对比发现,试验组通气6 h、24 h的pH、OI水平明显高于对照组,PaCO2水平低于对照组,差异有统计学意义(P<0.05)。这和NIPPV提供设定频率的吸气峰值压力,从而减少患儿呼吸做功以及对呼吸肌造成的疲劳,降低PS和能量的消耗相关。并且试验组患儿撤机失败率明显低于对照组,差异有统计学意义(P<0.05)。与当前国内外研究成果相符[12]。
综上所述,NIPPV作为一种新的非侵入性呼吸支持技术,在早产儿呼吸窘迫综合征的治疗中显示出广阔的前景,对缓解患儿病情症状、提高一次撤机成功率具有重要意义。

