癫痫清颗粒对海人藻酸致癫痫大鼠行为学变化及NF-κB 信号通路的影响
齐 越, 贾 冬, 李纪彤, 姜 鸿, 秦文艳, 韦 丹, 张冰冰, 康 凯,陈 贺∗
(1. 辽宁中医药大学附属二院, 辽宁 沈阳 110034; 2. 辽宁中医药大学中医脏象理论及应用教育部重点实验室, 辽宁 沈阳 110847; 3. 辽宁中医药大学附属第三医院, 辽宁 沈阳 110032)
近年来临床研究及动物实验均证实, 癫痫与炎症的关系密不可分, 炎症反应可降低痫性发作阈值, 增加神经元兴奋性, 破坏血脑屏障, 介导神经元凋亡及突触重塑[1-2]。另外, 核因子-κB (NF-κB) 广泛分布于脑内多种细胞中,作为调节转录因子也与炎症反应密切相关。
癫痫清颗粒为辽宁省中医药研究院的院内制剂, 前期研究显示它可延长戊四唑及海人藻酸大鼠癫痫发作潜伏期,降低发作分级和持续时间, 增加脑组织白介素-4 (IL-4)水平, 抑制小胶质细胞及星形胶质细胞活化[3-8]。 本实验以海马内注射海人藻酸诱导癫痫大鼠模型, 考察癫痫清颗粒是否通过NF-κB 信号通路发挥抗炎作用, 进而对大鼠行为学产生影响, 从多方面多角度揭示该制剂抗癫痫作用机制,为临床用药提供必要的药理学基础。
1 材料
1.1 动物 SPF 级雄性Wistar 大鼠60 只, 体质量(200±20) g, 由辽宁长生生物技术有限公司提供, 动物生产许可证号SCXK (辽) 2010-0001, 自由进食及饮水。
1.2 药物 癫痫清颗粒(辽宁中医药大学附属第二医院,批号20140110, 5.31 g 生药/kg); 苯妥英钠片(天津力生制药股份有限公司, 批号1312027, 每片素片重0.1 g)。 海人藻酸(美国Sigma 公司, 批号MKBQ0 979 V, 含有量大于98%); 水合氯醛(国药集团化学试剂有限公司, 批号20100709); NF-κB p65、 p-IκB、 IκB、 β-actin 试剂盒(北京博奥森生物技术有限公司)。
1.3 仪器 DW-5 脑立体定位仪(成都泰盟科技有限公司); Stronger90 牙 科 钻 (韩 国 世 新 精 密 株 式 会 社);Neofuge13R 高速冷冻离心机(上海力申科学仪器有限公司); Mini-PROTEAN©Tetra Cell 垂直电泳系统(美国伯乐有限公司)。
2 方法
2.1 分组与给药 60 只大鼠随机分为假手术组、 模型组、苯妥英钠组及癫痫清颗粒低、 中、 高剂量组, 每组10 只,分笼饲养, 自由摄食饮水。 根据前期实验结果并结合文献[10], 设置癫痫清颗粒低、 中、 高剂量分别为4.74、9.47、 18.94 g/kg, 苯妥英钠剂量为0.03 g/kg, 各组大鼠给药量为20 mL/kg, 灌胃给药, 每天1 次, 连续7 d, 假手术组、 模型组大鼠给予等体积蒸馏水。
2.2 模型建立 采用前期课题组报道方法[6]。 第7 天给药结束后1 h, 350 mg/kg 水合氯醛麻醉大鼠, 将其固定于脑立体定位仪上, 头部备皮, 碘伏消毒2 次, 于颅顶正中线作一3~4 cm 切口, 钝性分离骨膜, 将囟门定位为零点,轻轻移动微量进样器, 中线旁开2.20 mm、 后3.00 mm,制作标记点, 垂直使用牙科钻, 轻钻至穿破骨膜, 垂直进针约3.70 mm, 3 min 内缓慢匀速注入1.0 μL 海人藻酸(1 μg/μL), 留针5 min, 假手术组大鼠注射等体积生理盐水。 手术结束后, 缝合大鼠脑部肌肉及皮肤, 碘伏消毒2次, 整个手术过程注意保暖。
2.3 癫痫清颗粒对大鼠行为超兴奋性的影响[9]
2.3.1 接近反应实验 用笔垂直、 缓慢地从大鼠面前经过, 观察其表现, 然后进行评分, 评分标准: ①无反应;②大鼠嗅此笔; ③大鼠离开此笔; ④大鼠冻结; ⑤大鼠跳离此笔; ⑥大鼠跳向此笔或是袭击此笔。
2.3.2 响指反应实验 在离大鼠头部几厘米处发出响指声, 观察其反应, 然后进行评分, 评分标准: ①无反应;②大鼠轻轻跳跃或退缩或突然摇耳朵; ③大鼠大跳。
2.4 大鼠海马IκB/NF-κB 蛋白表达检测 采用Western blot 法。 末次给药1 h 后, 每组随机选取5 只大鼠, 迅速断头处死后冰盘上分离海马, 称定质量, 提取总蛋白, BSA法测定蛋白浓度, 10% 凝胶电泳, 转膜, 5% 脱脂牛奶封闭, 一抗孵育, 4 ℃下静置过夜, PBS 洗涤后加入二抗孵育, 再次洗涤后加入超敏ECL 化学发光试剂盒, 凝胶成像系统观察相关蛋白的表达, Quantity One 4.6.2 图像分析软件进行分析。
2.5 统计学分析 通过SPSS 13.0 软件进行处理, 数据用±s) 表示, 组间比较采用单因素方差分析。 P<0.05 表示差异有统计学意义。
3 结果
3.1 大鼠死亡情况 海人藻酸注射后, 模型组、 苯妥英钠组及癫痫清颗粒低、 中、 高剂量组大鼠分别死亡3、 2、 3、2、 2 只。
3.2 癫痫清颗粒对大鼠行为学的影响 表1 显示, 与假手术组比较, 模型组大鼠接近反应、 响指反应评分显著增加(P<0.01); 与模型组比较, 癫痫清颗粒组两者显著降低(P<0.01)。
表1 癫痫清颗粒对大鼠行为学的影响)
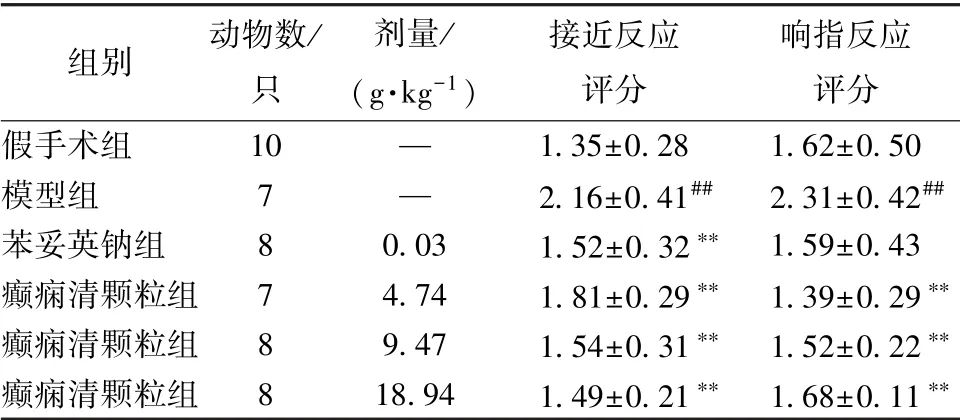
表1 癫痫清颗粒对大鼠行为学的影响)
注:与假手术组比较,##P<0.01;与模型组比较,∗∗P<0.01
组别 动物数/只剂量/(g·kg-1)接近反应评分响指反应评分假手术组 10 — 1.35±0.28 1.62±0.50模型组 7 — 2.16±0.41## 2.31±0.42##苯妥英钠组 8 0.03 1.52±0.32∗∗ 1.59±0.43癫痫清颗粒组 7 4.74 1.81±0.29∗∗ 1.39±0.29∗∗癫痫清颗粒组 8 9.47 1.54±0.31∗∗ 1.52±0.22∗∗癫痫清颗粒组 8 18.94 1.49±0.21∗∗ 1.68±0.11∗∗
3.3 癫痫清颗粒对大鼠p-IκB/IκB/NF-κB P65 表达的影响 图1、 表2 显示, 与假手术组比较, 模型组大鼠海马组织p-IκB、 NF-κB P65 表达显著增加(P<0.01), IκB 表达显著减少(P<0.05); 与模型组比较, 癫痫清颗粒中剂量组仅IκB 表达显著增加(P <0.01), 而高剂量组p-IκB、NF-κB P65 表达显著减少(P<0.05, P<0.01), IκB 表达显著增加(P<0.01)。
4 讨论
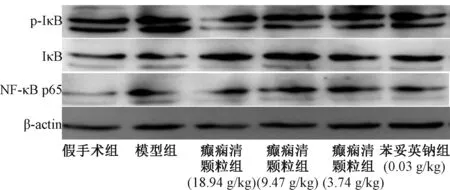
图1 癫痫清颗粒对大鼠p-IκB/IκB/NF-κB P65 表达的影响
表2 癫痫清颗粒对大鼠p-IκB/IκB/NF-κB P65 表达的影响 ±s, n=5)
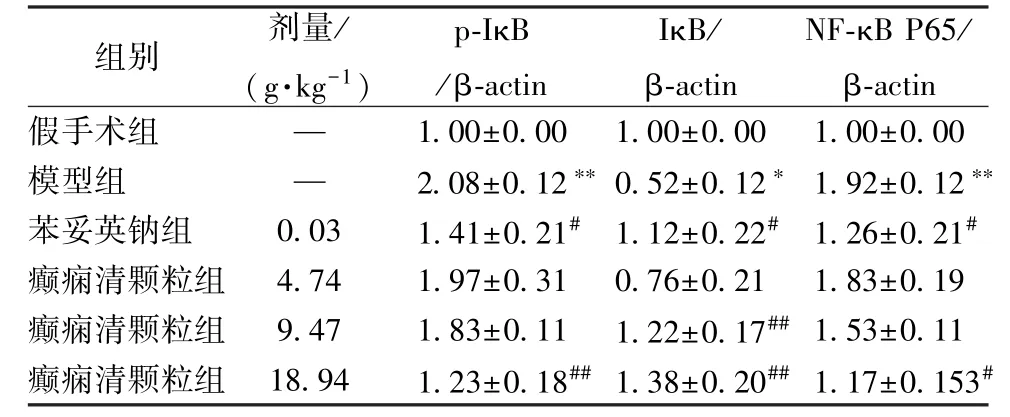
表2 癫痫清颗粒对大鼠p-IκB/IκB/NF-κB P65 表达的影响 ±s, n=5)
注:与假手术组比较,∗P<0.05,∗∗P<0.01;与模型组比较,#P<0.05,##P<0.01
组别 剂量/(g·kg-1)p-IκB/β-actin IκB/β-actin NF-κB P65/β-actin假手术组 — 1.00±0.00 1.00±0.00 1.00±0.00模型组 — 2.08±0.12∗∗0.52±0.12∗ 1.92±0.12∗苯妥英钠组 0.03 1.41±0.21# 1.12±0.22# 1.26±0.21#癫痫清颗粒组 4.74 1.97±0.31 0.76±0.21 1.83±0.19癫痫清颗粒组 9.47 1.83±0.11 1.22±0.17## 1.53±0.11癫痫清颗粒组 18.94 1.23±0.18## 1.38±0.20## 1.17±0.153#∗
大量研究表明, 癫痫是由于大脑神经元异常放电导致的脑电活动不平衡所致[10], 而且常伴有一定程度的认知问题和适应障碍(如记忆困难、 注意力不集中、 睡眠不好、抑郁等)[11-12]。 2016 年一项研究表明, 高达50%的癫痫患者可能还具有异常行为, 如敌意、 冲动、 烦躁、 激动、 愤怒和攻击行为等[13], 推测其可能与脑内兴奋和抑制的失衡有关。
目前, 在癫痫行为学研究的模型中药物主要有匹鲁卡品和海人藻酸, 动物大多为大、 小鼠, 可用评估实验包括高架十字迷宫实验、 明/暗实验、 旷场测试、 强迫游泳测试、 行为超兴奋性测试、 鼠尾悬停测试、 孔板测试、 MK-801 (地佐昔康) 诱导精神病样行为等, 其中行为超兴奋性测试中包括响指反应、 接近反应、 快速反应、 拾取反应。本实验在大鼠脑内CA1 区注射海人藻酸, 并考察癫痫清颗粒对大鼠行为超兴奋性的影响, 发现与假手术组比较, 模型组响指反应、 接近反应评分明显增加, 表明大鼠脑内CA1 区注射1.0 μg 海人藻酸可较好地模拟癫痫动物模型行为学变化; 与模型组比较, 癫痫清颗粒组可明显降低2 种评分, 表明它可较好地改善癫痫大鼠脑内兴奋性、 抑制性的失衡关系。
炎症与多种神经疾病密切相关, 如癫痫、 帕金森病、阿尔茨海默病、 中风等, 过去十年中炎症在癫痫病因中的重要作用引起了众多学者广泛关注, 支持炎性过程在癫痫中发挥潜在作用的关键证据来源于(1) 人类耐药性癫痫的治疗中, 抗炎药物可发挥一定抗癫痫作用; (2) 在手术切除难治性癫痫患者的脑组织中, 可见炎性几种介质;(3) 癫痫发作可促使脑内免疫细胞或小胶质细胞的激活,导致炎症细胞因子产生; (4) 自发性癫痫可导致永久性慢性炎症, 故抑制炎症因子表达可能对癫痫有治疗作用。
核因子-κB (NF-κB) 作为调节的转录因子, 主要在脑内的神经元、 星形胶质细胞及小胶质细胞中存在, 并参与炎症基因的表达、 细胞存活、 凋亡[14], 当细胞处于静息状态时, 它与抑制性蛋白IκB 结合, 存在于细胞质内; 激活后, 其蛋白磷化后发生降解, 促使其进入细胞核内, 进一步激活靶基因, 调节炎症因子表达, 如iNOS、 COX-2、TNF-α、 IL-4 等[15-16]。 研究表明, 在慢性癫痫患者致痫灶的脑组织病理切片中可见胶质细胞活化、 增生、 NF-κB 过表达[17]; 癫痫动物模型中也可见小胶质细胞NF-κB 信号通路激活, 并伴随着炎症因子含量的增加, 可知NF-κB 参与了癫痫发病过程中的炎症信号通路的激活, 抑制其活化,可能成为干预癫痫发生发展的潜在治疗靶点。 前期课题组研究表明, 癫痫清颗粒可抑制小胶质细胞及星形胶质细胞的活化[8], 增加抗炎因子IL-4 表达[6], 但具体作用机制尚不清楚; 本实验考察了癫痫清颗粒对NF-κB 信号通路的影响, 发现它可面向减少p-IκB、 NF-κB P65 表达, 抑制IκB降解, 可能通过抑制NF-κB 信号通路、 调控炎症因子表达来改善癫痫超兴奋行为, 从而发挥抗癫痫作用。

