三叶青地上部分多糖对乳腺癌小鼠的抗肿瘤作用
郭菁菁, 赵英杰, 李 伟, 钱朝东, 丁志山
(1. 绍兴市中心医院药剂科, 浙江 绍兴 312030; 2. 浙江中医药大学, 浙江 杭州 310051)
三叶青Tetrastigma hemsleyanum Diels et Gilg 是我国特有的葡萄科崖爬藤属珍稀药用植物, 主要分布于长江以南的江苏、 浙江等地[1], 作为民间常用中草药, 拥有“药王” “抗癌神草” 等美誉, 具有清热解毒、 活血祛风等功效, 有着抗肿瘤、 解热、 抗炎、 保肝、 抗病毒、 免疫调节等多种药理作用[2], 其中抗肿瘤活性的临床应用最广泛。目前, 已有报道三叶青提取物具有较好的抗肿瘤活性[3],但鲜有相关成分的文献, 主要集中在块根中的黄酮类化合物, 地上部分较少关注, 对其药效组分的研究更是寥寥无几。 前期课题组发现, 三叶青地上部分多糖可能为其药效活性组分; 本实验建立小鼠乳腺癌荷瘤模型, 对该成分抗肿瘤药效及其作用机制进行初步探讨, 为进一步开发利用相关资源提供理论依据。
1 材料
1.1 药材 三叶青地上部分采自浙江省杭州市富阳区受降镇三叶青种植基地, 经浙江省药品检验所专家鉴定为葡萄科三叶崖爬藤属正宗紫藤三叶青品种 (浙食药检业《2015》 128 号)。
1.2 动物 BALB/c 雄性小鼠(SPF 级), 体质量(22±2)g, 由中国科学院上海实验动物中心供应, 动物生产许可证号SCXK (沪) 2013-0006。
1.3 细胞株 4T1 乳腺癌细胞株, 由浙江中医药大学生命科学院赠予。
1.4 试剂 胎牛血清(浙江天杭生物科技有限公司, 批号20160720); RPMI 1640 培养基(杭州诺森德生物技术有限公 司, 批 号 ZI110516); FITC anti-mouse CD4 ( 批 号100406)、 APC anti-mouse CD3 (批号100236)、 FITC Rat anti-Mouse CD4 (批号553046)、 PerCP anti-mouse CD8 (批号100734)、 PE Rat anti-Mouse FoxP3 (批号560408) (美国BD Biosciencens 公司)。
1.5 仪器 RE-52AA 旋转蒸发仪(上海亚荣生化仪器厂); SHZ-DⅢ循环水真空泵(巩义市英峪予华仪器厂);LDZ5-2 低速自动平衡离心机 (美国安玛西亚公司);Alpha1-2LD plus 真空冷冻干燥器(北京博劢行仪器有限公司); Series II Water Jacket CO2培养箱(美国Thermo Fisher公司); Eclipse Ti-DH 倒置荧光显微镜(日本Nikon 公司);BD Accuri 流式细胞分析仪(美国BD 公司)。
2 方法
2.1 多糖制备 取一定量过60 目筛的药材粉末, 称定质量, 用双蒸水按物料比1 ∶15 在80 ℃下回流提取3 次, 每次30 min, 合并3 次滤液, 减压浓缩到一定体积, 然后加入3 倍量95%乙醇, 充分混匀, 静置12 h, 3 500 r/min 离心10 min, 得到沉淀, 同法反复水提醇沉2 次, 收集沉淀,再用无水乙醇反复洗脱2 次, 抽滤, 挥去乙醇, 真空冷冻干燥, 即得。
2.2 模型建立 4T1 细胞复苏后, 在5% CO2、 37 ℃下常规培养于含10%胎牛血清的RPMI 1640 培养液中, 每2 ~3 d更换培养液并传代, 收集培养至对数生长期的4T1 细胞,无菌生理盐水清洗后稀释至2.5×106/mL, 于每只BALB/c小鼠右侧倒数第二个乳房处注射0.2 mL, 48 h 后观察该处有约2 mm×2 mm 的粉红色小突起, 表明造模成功。
2.3 分组及给药 将“2.2” 项下成模小鼠随机分为模型组、 环磷酰胺组及多糖低、 中、 高剂量组, 每组10 只, 另设空白组小鼠10 只。 空白组、 模型组小鼠每天灌胃给予10 mL/kg蒸馏水; 环磷酰胺组小鼠隔天腹腔注射40 mg/kg环磷酰胺无菌生理盐水; 多糖低、 中、 高剂量组分别给予50、 150、 250 mg/kg 药液, 各组连续给药28 d。 小鼠末次给药后取血, 脱颈椎处死, 分离胸腺、 脾脏、 肺脏、 肝脏、瘤块组织, 计算平均瘤质量、 抑瘤率、 脏器指数, 观察肺组织转移灶。
2.4 外周血淋巴细胞分离 将小鼠血液收集于抗凝管中,加入3 mL 红细胞裂解液, 充分混悬后静置10 min, 待红细胞完全破碎后4 ℃、 1 500 r/min 离心3 min, 弃上清, 去除红细胞。 此时沉淀应为白色, 如有红色, 则继续加入裂解液, 重复上述离心操作, 然后用PBS 洗涤细胞1 次, 备用。
2.5 脾脏、 胸腺淋巴细胞分离 剖离小鼠脾脏、 胸腺组织, 剪刀剪成小块, 加入事先准备好的培养基配置酶试剂中, 摇床孵育1 h, 加入完全培养基终止消化。 然后, 注射器平端研磨组织, 200 目筛网过滤, 收集单细胞, 培养液稀释至密度1×106/mL 的细胞悬液。 然后, 加入红细胞裂解液, 破红15 min, 离心, 取上清, 组织细胞用PBS 缓冲液清洗, 4 ℃、 1 400 r/min 离心5 min, 去上清, 备用。
2.6 外周血CD4+CD25+Foxp3+调节性T 淋巴细胞(Treg)检测 将“2.4” 项下处理后外周血淋巴细胞用FACS 缓冲液清洗, 4 ℃、 1 400 r/min 离心5 min, 去上清。 然后, 加入FTIC-CD4、 APC-CD25 抗体各20 μL, 4 ℃下避光孵育15 min, FACS 清洗1 次, 加入破膜剂(Cytofix/Cytoperm),4 ℃下避光60 min, Perm buffer 清洗2 次。 再加入PE-Foxp3抗体, 4 ℃下避光孵育50 min, Perm buffer 清洗2 次,FACS 重悬细胞, 上流式细胞仪进行检测。
2.7 脾脏、 胸腺CD4+、 CD8+T 淋巴细胞亚群检测 将“2.5” 项下处理后的组织淋巴细胞加入APC-CD3、 FITCCD4、 PerCP/Cy5.5-CD8 抗 体, 4 ℃下 避 光 孵 育15 min,4 ℃、 1 000 r/min 离心5 min, 去上清。 然后, 加入500 μL PBS 重悬细胞, 上流式细胞仪进行检测。
2.8 统计学分析 通过SPSS 22.0 软件进行处理, 计量资料以s) 表示, 组间比较采用单因素方差分析; 计数资料以百分率表示, 组间比较采用卡方检验。 以P<0.05 为差异有统计学意义。
3 结果
3.1 多糖对小鼠肿瘤生长的影响 表1 显示, 与模型组比较, 给药组小鼠瘤质量、 瘤体积显著降低(P<0.05, P<0.01)。
表1 多糖对小鼠肿瘤生长的影响, n=10)
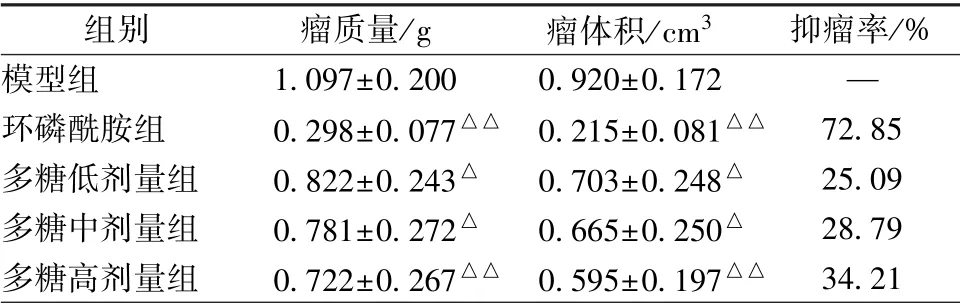
表1 多糖对小鼠肿瘤生长的影响, n=10)
注:与模型组比较,△P<0.05,△△P<0.01
模型组 1.097±0.200 0.920±0.172 —环磷酰胺组 0.298±0.077△△ 0.215±0.081△△ 72.85多糖低剂量组 0.822±0.243△ 0.703±0.248△ 25.09多糖中剂量组 0.781±0.272△ 0.665±0.250△ 28.79多糖高剂量组 0.722±0.267△△ 0.595±0.197△△ 34.21
3.2 多糖对小鼠脏器指数的影响 表2 显示, 与空白组比较, 模型组小鼠脾脏、 肝脏指数显著升高, 胸腺指数显著降低(P<0.05, P<0.01); 与模型组比较, 多糖组小鼠脾脏、 胸腺指数无明显变化(P>0.05), 而肝脏指数显著降低(P<0.05); 与环磷酰胺组比较, 多糖组小鼠胸腺指数显著升高(P<0.01), 并且中、 高剂量组脾脏指数也显著升高(P<0.05), 但各组肝脏指数无明显变化(P>0.05)。
表2 多糖对小鼠脏器指数的影响, n=10)
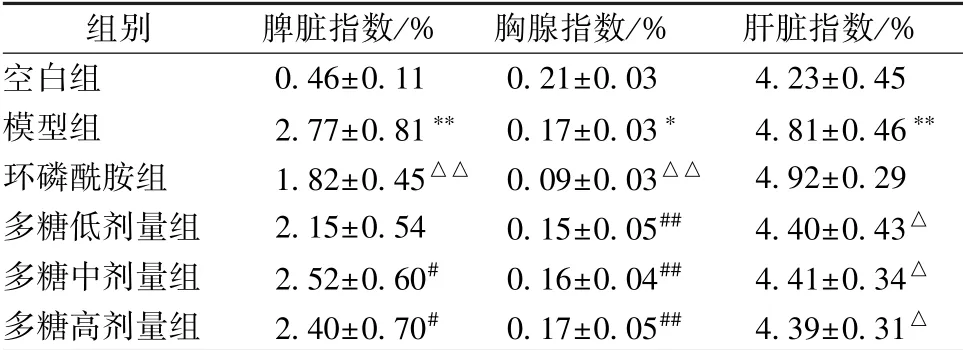
表2 多糖对小鼠脏器指数的影响, n=10)
注:与空白组比较,∗P<0.05,∗∗P<0.01;与模型组比较,△P<0.05,△△P<0.01;与环磷酰胺组比较,#P<0.05,##P<0.01
组别 脾脏指数/% 胸腺指数/% 肝脏指数/%空白组 0.46±0.11 0.21±0.03 4.23±0.45模型组 2.77±0.81∗∗ 0.17±0.03∗ 4.81±0.46∗∗环磷酰胺组 1.82±0.45△△ 0.09±0.03△△ 4.92±0.29多糖低剂量组 2.15±0.54 0.15±0.05## 4.40±0.43△多糖中剂量组 2.52±0.60# 0.16±0.04## 4.41±0.34△多糖高剂量组 2.40±0.70# 0.17±0.05## 4.39±0.31△
3.3 多糖对小鼠远端肺转移的影响 表3 显示, 经过28 d生长后, 模型组小鼠肿瘤远端肺转移明显, 而给药组均能明显抑制其发生; 与模型组比较, 多糖组小鼠肺转移灶数显著降低(P<0.01)。
表3 多糖对小鼠远端肺转移的影响(±s, n=10)

表3 多糖对小鼠远端肺转移的影响(±s, n=10)
注:与模型组比较,△△P<0.01
组别 (发生转移荷瘤小鼠数/荷瘤小鼠总数)/只 肺转移灶数模型组 10/10 2.30±0.21环磷酰胺组 2/10 0.20±0.13△△多糖低剂量组 4/10 0.67±0.33△△多糖中剂量组 5/10 0.70±0.26△△多糖高剂量组 3/10 0.40±0.22△△
3.4 多糖对小鼠外周血CD4+CD25+Foxp3+Treg 细胞比例的影响 表4、 图1 显示, 与空白组比较, 模型组小鼠外周血CD4+CD25+Foxp3+Treg 细胞比例显著升高(P<0.01);与模型组比较, 多糖中、 高剂量组小鼠其比例显著降低(P<0.01)。
表4 多糖对小鼠外周血CD4+CD25+Foxp3+Treg 细胞比例的影响, n=6)
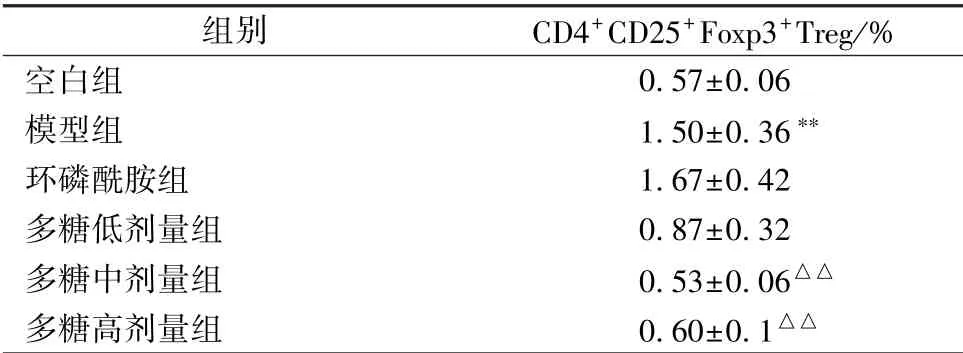
表4 多糖对小鼠外周血CD4+CD25+Foxp3+Treg 细胞比例的影响, n=6)
注:与空白组比较,∗∗P<0.01;与模型组比较,△△P<0.01。 出于成本考虑,仅选择6 只小鼠进行实验
空白组 0.57±0.06模型组 1.50±0.36∗∗环磷酰胺组 1.67±0.42多糖低剂量组 0.87±0.32多糖中剂量组 0.53±0.06△△多糖高剂量组 0.60±0.1△△
3.5 多糖对小鼠胸腺CD4+、 CD8+T 细胞比例的影响 表5显示, 与空白组比较, 模型组小鼠胸腺CD4+、 CD8+T 细胞比例有降低趋势, 但差异无统计学意义(P>0.05); 与模型组比较, 多糖中、 高剂量组小鼠两者比例显著升高(P<0.05, P<0.01)。
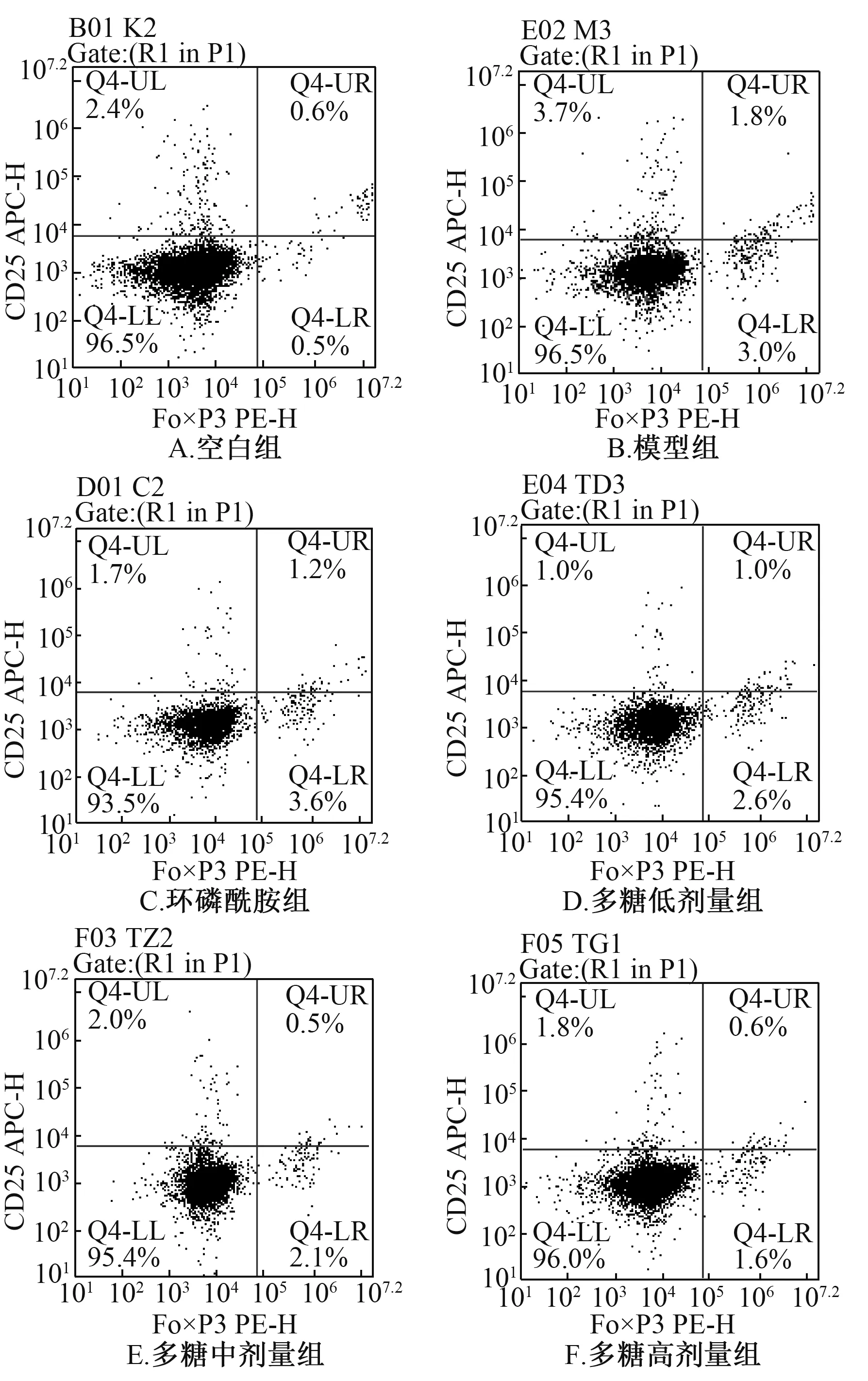
图1 多糖对小鼠外周血CD4+CD25+Foxp3+Treg 细胞比例的影响
表5 多糖对小鼠胸腺CD4+、 CD8+T 细胞比例的影响n=6)
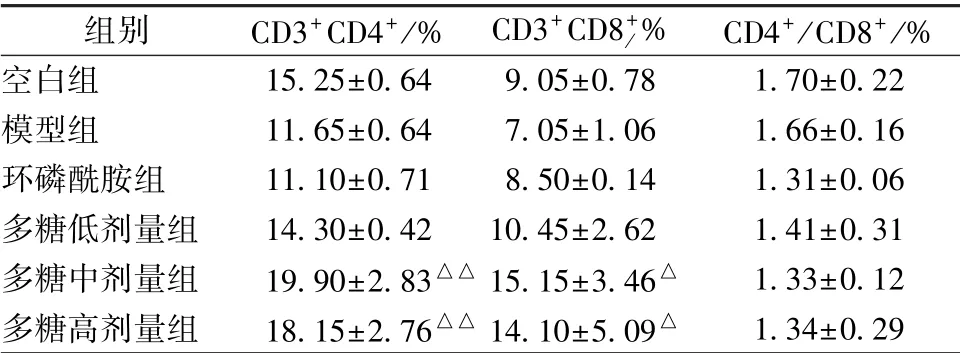
表5 多糖对小鼠胸腺CD4+、 CD8+T 细胞比例的影响n=6)
注:与模型组比较,△P<0.05;△△P<0.01。 出于成本考虑,仅选择6 只小鼠进行实验
空白组 15.25±0.64 9.05±0.78 1.70±0.22模型组 11.65±0.64 7.05±1.06 1.66±0.16环磷酰胺组 11.10±0.71 8.50±0.14 1.31±0.06多糖低剂量组 14.30±0.42 10.45±2.62 1.41±0.31多糖中剂量组 19.90±2.83△△15.15±3.46△ 1.33±0.12多糖高剂量组 18.15±2.76△△14.10±5.09△ 1.34±0.29
3.6 多糖对小鼠脾脏CD4+、 CD8+T 细胞比例的影响 表6、 图2 显示, 与空白组比较, 模型组小鼠脾脏CD4+、CD8+T 细胞比例显著下降(P<0.01); 与模型组比较, 多糖中、 高剂量组小鼠前者比例显著升高(P<0.05), 但后者比例无明显变化(P>0.05), 同时CD4+/CD8+比例也显著升高(P<0.05)。
4 讨论
本实验发现, 三叶青地上部分多糖可显著抑制4T1 乳腺癌小鼠肿瘤生长, 在250 mg/kg 时抑瘤率达到了34.21%。 环磷酰胺作为临床常用的抗肿瘤药物, 其最主要不良反应是对机体的免疫抑制作用[4], 而且对肝脏及骨髓也有一定损伤; 实验结果显示, 多糖与环磷酰胺相比在抑制肿瘤生长的同时还能显著增加脾脏、 胸腺指数, 提示它对机体免疫器官具有保护作用。
表6 多糖对小鼠脾脏CD4+、 CD8+T 细胞比例的影响s, n=6)
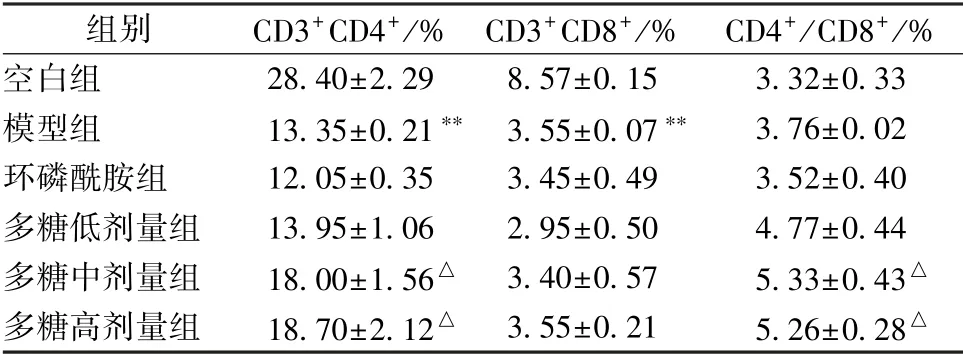
表6 多糖对小鼠脾脏CD4+、 CD8+T 细胞比例的影响s, n=6)
注:与空白组比较,∗∗P<0.01;与模型组比较,△P<0.05
空白组 28.40±2.29 8.57±0.15 3.32±0.33模型组 13.35±0.21∗∗ 3.55±0.07∗∗ 3.76±0.02环磷酰胺组 12.05±0.35 3.45±0.49 3.52±0.40多糖低剂量组 13.95±1.06 2.95±0.50 4.77±0.44多糖中剂量组 18.00±1.56△ 3.40±0.57 5.33±0.43△多糖高剂量组 18.70±2.12△ 3.55±0.21 5.26±0.28△
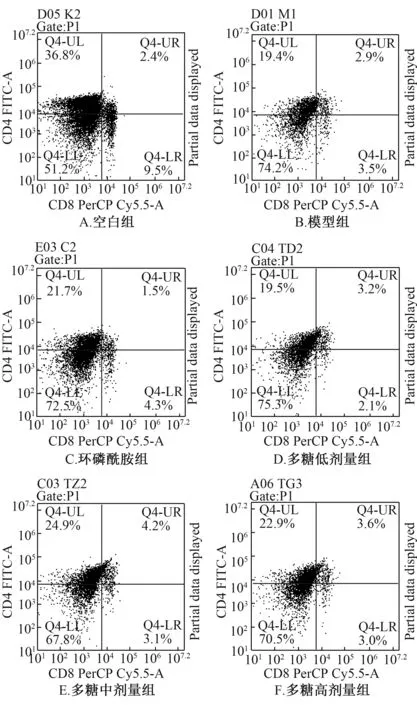
图2 多糖对小鼠脾脏CD4+、 CD8+T 细胞比例的影响
T 淋巴细胞亚群是机体重要的抗肿瘤细胞免疫系统[5-6], 它源于骨髓干细胞, 在胸腺分化成熟, 活化后可分为辅助T 细胞(Th)、 细胞毒性T 细胞(CTL)、 调节性T细胞(Treg), 其中Th 均表达于CD4, 故也称CD4+T 细胞,根据其产生细胞因子及生物学功能的不同, 又分为Th1 和Th2 细胞, 前者主要分泌IFN-γ、 IL-2、 TNF 等, 介导细胞免疫, 辅助CTL 分化和增殖, 增强NK 细胞毒性, 从而起抗肿瘤作用, 而后者主要分泌IL-4、 IL-10、 IL-5、 IL-13等, 介导体液免疫, 辅助B 细胞, 从而抑制前者增殖[7];CD8+T 细胞属于CTL, 具有细胞毒活性, 可直接杀伤肿瘤细胞, 在机体防御肿瘤免疫中起着重要作用, 但其本身不能特异性识别肿瘤抗原; 由于在CD8+T 细胞攻击肿瘤细胞和形成记忆细胞过程中, CD4+T 细胞行使辅助功能, 故两者在正常情况下保持动态平衡, 以维持机体细胞正常免疫功能[8], 而癌症患者大多表现为免疫功能紊乱, T 淋巴细胞亚群比例发生改变, 如CD4+T 淋巴细胞水平、 CD4+/CD8+比值下降等[9]。
CD4+CD25+Treg 细胞为调节性T 细胞(Treg) 亚群,具有免疫抑制作用, 帮助肿瘤细胞参与免疫逃逸。 一方面,活化的CD4+CD25+Treg 细胞可通过抑制CD4+、 CD8+T 细胞的IL-2 基因转录和表达, 从而抑制T 细胞活化增殖[10]; 另一方面, 肿瘤组织通过CCL17、 CCL22 等趋化因子向肿瘤微环境招募该细胞。 另外, CD4+CD25+Treg 细胞可通过识别肿瘤抗原, 抑制机体抗肿瘤免疫应答, 使机体处于对肿瘤低应答或无应答状态[11], 同时它还能通过直接分泌或刺激DCs 分泌免疫抑制因子(IL-10、 TGF-β 等) 来达到免疫抑制作用。
结果显示, 4T1 乳腺癌荷瘤小鼠外周血CD4+CD25+Foxp3+Treg 细胞比例明显升高, 脾脏组织CD4+、 CD8+T 细胞比例明显降低; 三叶青地上部分多糖能明显升高CD4+T细胞比例及胸腺组织CD4+、 CD8+T 细胞比例, 降低外周血CD4+CD25+Foxp3+Treg 比例, 提高脾脏组织CD4+/CD8+比例。 由此可知, 该成分可通过增加CD4+、 CD8+T 细胞比例, 抑制Treg 细胞数量与功能, 从而破坏由Treg 细胞引起的免疫耐受, 提高机体抗肿瘤免疫应答, 发挥抗肿瘤活性。
综上所述, 三叶青地上部分多糖可增强机体免疫功能,提高抗肿瘤免疫应答, 与该植物块根有类似作用, 可为相关资源开发利用奠定基础, 也能为开发新型中药制剂提供理论基础。 但目前仅对该成分与机体抗肿瘤免疫相关的T 淋巴细胞亚群进行研究, 今后可结合参与肿瘤免疫的关键细胞因子以更深入地探讨其抗肿瘤免疫调控机制, 同时三叶青地上、地下部分多糖是否属于同一物质也有待进一步考察。

