注射用血栓通(冻干) 联合GM1 对糖尿病神经病变患者的临床疗效
宋学云, 魏玲玲, 杨 杰, 杨加青, 魏丽红, 范 云, 贺小霞, 郑献召
(焦作市人民医院, 河南 焦作 454002)
糖尿病神经病变是糖尿病最常见的慢性并发症之一[1], 其病因及发病机制尚不明确, 可能与遗传因素、 缺血及缺氧性因素、 氧化应激、 多元醇通路过度活跃、 晚期糖基化终末产物(AGE) -AGE 受体-核因子、 蛋白激酶C 激活、 必需脂肪酸代谢异常、 神经生成营养因子、 综合发病机制假说等有关[2-5]。 目前, 临床上主要采用神经营养剂治疗糖尿病神经病变, 通过神经恢复来减缓周围神经损伤。
单唾液酸四己糖神经节苷脂(GM1) 是从猪脑中提取出的对神经细胞功能损伤具有保护作用的物质; 注射用血栓通(冻干) 是一种由三七总皂苷制成的制剂, 可用于治疗视网膜中央静脉阻塞、眼前房出血、 青光眼、 脑血管病后遗症、 病毒性肝炎等疾病, 具有活血祛瘀、 扩张血管、 改善血循环的作用[6], 可促进神经修复, 提高神经传导速度[7]。 因此, 本研究采用注射用血栓通(冻干)联合GM1 治疗糖尿病神经病变, 并探讨其对患者神经功能、 氧化应激、 炎性因子的影响, 旨在探讨相关作用机制, 现报道如下。
1 资料与方法
1.1 一般资料 2016 年2 月至2018 年4 月在焦作市人民医院治疗的64 例糖尿病神经病变患者, 按随机数字表进行分组, 其中对照组32 例, 男18例, 女14 例; 年龄45~77 岁, 平均(57.6±10.3)岁; 糖尿病病程1 ~10 年, 平均(6.2±2.7) 年;糖尿病神经病变病程2 ~14 个月, 平均 (8.2±3.6) 个月; 合并高血压14 例, 高血脂11 例; 空腹 血 糖 (7.5 ± 1.6) mmol/L; 糖 化 血 红 蛋 白(7.8±1.5)%, 而观察组32 例, 男16 例, 女16例; 年龄48 ~79 岁, 平均(58.1±9.8) 岁; 糖尿病病程0.5 ~11 年, 平均(6.0±2.4) 年; 糖尿病神经病变病程1~16 个月, 平均(8.4±3.3) 个月;合并高血压15 例, 高血脂9 例; 空腹血糖(7.6±1.4) mmol/L; 糖化血红蛋白(7.7±1.7)%。 表1显示, 2 组性别、 年龄、 糖尿病病程、 糖尿病神经病变病程、 合并症、 空腹血糖、 糖化血红蛋白等一般资料比较, 差异无统计学意义(P>0.05), 具有可比性。
表1 2 组一般资料比较±s, n=32)Tab.1 Comparison of general data between the two groupss, n=32)
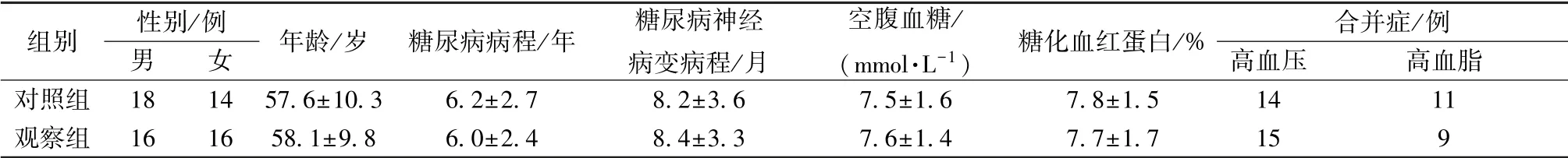
表1 2 组一般资料比较±s, n=32)Tab.1 Comparison of general data between the two groupss, n=32)
组别 性别/例男 女 年龄/岁 糖尿病病程/年 糖尿病神经病变病程/月空腹血糖/(mmol·L-1) 糖化血红蛋白/% 合并症/例高血压 高血脂对照组 18 14 57.6±10.3 6.2±2.7 8.2±3.6 7.5±1.6 7.8±1.5 14 11观察组 16 16 58.1±9.8 6.0±2.4 8.4±3.3 7.6±1.4 7.7±1.7 15 9
1.2 纳入标准 ①符合糖尿病神经病变诊断标准[8], 均属于2 型糖尿病, 经神经电生理检查确诊为周围神经病变; ②与患者签订知情同意书, 并获得医学伦理委员会批准。
1.3 排除标准 ①患心、 肝、 肾等器官功能严重障碍者; ②患脑梗死等其他因素造成的周围神经病变者; ③近1 个月内接受神经类药物治疗者; ④妊娠期及哺乳期妇女; ⑤患足部水肿、 感染及溃疡等糖尿病并发症者; ⑥患动静脉血管性病变者; ⑦患药物引起的神经损伤者; ⑧伴有自身免疫性疾病、造血系统疾病、 各种急慢性感染、 结缔组织病、 糖尿病周围血管病变者; ⑨精神异常或不配合治疗者。
1.4 治疗方法 所有患者均给予常规基础性治疗,包括控制饮食、 控制血糖、 降压、 降血脂等, 对照组给予GM1, 40 mg/次(溶于250 mL 生理盐水中), 1 次/d, 共4 周, 前2 周采用静脉滴注, 后2周采用肌肉注射; 观察组在对照组基础上加用注射用血栓通(冻干) [广西梧州制药(集团) 股份有限公司, 国药准字Z20025652, 批号18101305,150 mg/支], 0.45 g/次(溶于250 mL 生理盐水中), 1 次/d, 共4 周, 采用静脉滴注。
1.5 观察指标 ①多伦多临床神经病变评分(TCSS)[9], 包括上肢及下肢的症状(有1 分, 无0 分, 共6 分)、 深腱反射(消失2 分, 减弱1 分,存在0 分, 共8 分)、 脚趾感觉(消失1 分, 存在0 分, 共5 分), 总分19 分, 分值越高, 病变越严重; ②NTS-2000 型肌电图与诱发电位仪(上海诺诚医疗器械有限公司) 测定运动神经传导速度(MNCV)、 感觉神经传导速度(SNCV); ③取患者空腹肘静脉血, 离心取上清, 硝酸还原酶法测定血清一氧化氮(NO) 水平, 比色法测定谷胱甘肽过氧化物酶(GSH-Px) 水平, ELISA 法测定血清核因子κB (NF-κB)、 睫状神经生长因子(CNTF)、脑源性神经营养因子(BDNF)、 基质细胞衍生因子-1α ( SDF-1α)、 神 经 元 特 异 性 烯 醇 化 酶(NSE)、 S100β、 白介素6 (IL-6)、 超敏C 反应蛋白(hs-CRP)、 肿瘤坏死因子(TNF-α) 水平, 放射免疫沉淀法测定血清丙二醛(MDA)、 晚期氧化蛋白产物(AOPP)、 8-羟基脱氧鸟苷(8-OHDG)、超氧化物歧化酶(SOD)、 同型半胱氨酸(HCY)、晚期糖基化终末产物(AGEs) 水平; ④不良反应。
1.6 统计学分析 通过SPSS 15.0 软件进行处理,计量资料以s) 表示, 组间比较采用t 检验;计数资料以百分率表示, 组间比较采用卡方检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 TCSS 评分及神经传导速度 表2 显示, 治疗后2 组胫前神经、 腓总神经MNCV、 SNCV 水平显著上升 (P <0.05), TCSS 评分显著下降 (P <0.05), 以观察组更明显(P<0.05)。
表2 2 组TCSS 评分及神经传导速度比较, n=32)Tab.2 Comparison of TCSS scores and nerve conduction velocities between the two groups , n=32)
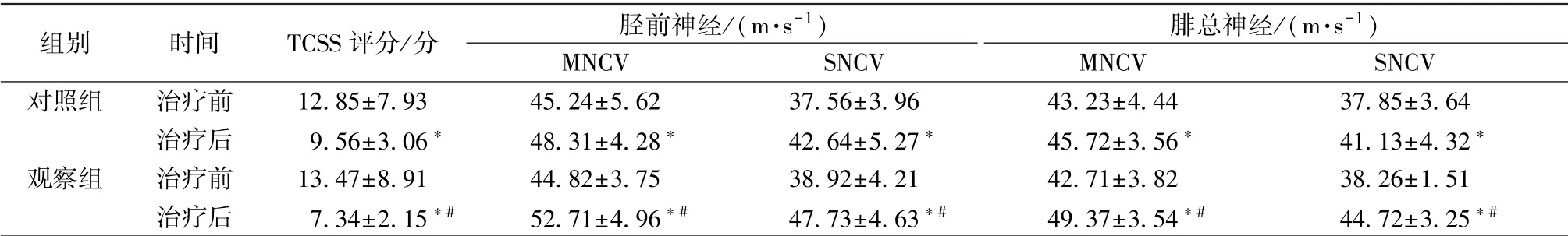
表2 2 组TCSS 评分及神经传导速度比较, n=32)Tab.2 Comparison of TCSS scores and nerve conduction velocities between the two groups , n=32)
注:与同组治疗前比较,∗P<0.05;与对照组治疗后比较,#P<0.05
对照组 治疗前 12.85±7.93 45.24±5.62 37.56±3.96 43.23±4.44 37.85±3.64治疗后 9.56±3.06∗ 48.31±4.28∗ 42.64±5.27∗ 45.72±3.56∗ 41.13±4.32∗观察组 治疗前 13.47±8.91 44.82±3.75 38.92±4.21 42.71±3.82 38.26±1.51治疗后 7.34±2.15∗# 52.71±4.96∗# 47.73±4.63∗# 49.37±3.54∗# 44.72±3.25∗#
2.2 神经功能指标 表3 显示, 治疗后2 组CNTF、 BDNF、 SDF-1α 水平显著升高(P<0.05),NSE、 S100β 水平显著降低(P<0.05), 以观察组更明显(P<0.05)。
表3 2 组神经功能指标比较 n=32)Tab.3 Comparison of nerve function indices between the two groups s, n=32)
注:与同组治疗前比较,∗P<0.05;与对照组治疗后比较,#P<0.05
对照组 治疗前 1.88±0.42 6.25±0.99 40.86±8.01 22.54±2.65 1.68±0.43治疗后 2.77±0.55∗ 7.84±0.87∗ 60.69±9.06∗ 18.36±2.17∗ 1.12±0.22∗观察组 治疗前 1.93±0.37 6.38±0.91 43.75±7.84 22.08±2.49 1.60±0.39治疗后 3.64±0.51∗# 9.26±1.14∗# 77.15±10.63∗# 15.74±2.36∗# 0.73±0.16∗#
2.3 炎症因子 表4 显示, 治疗后2 组IL-6、 hs-CRP、 TNF-α 水平显著降低(P<0.05), NO 水平显著升高 (P <0.05), 以观察组更明显 (P <0.05)。
表4 2 组炎症因子比较, n=32)Tab.4 Comparison of inflammatory factors between the two groups (, n=32)
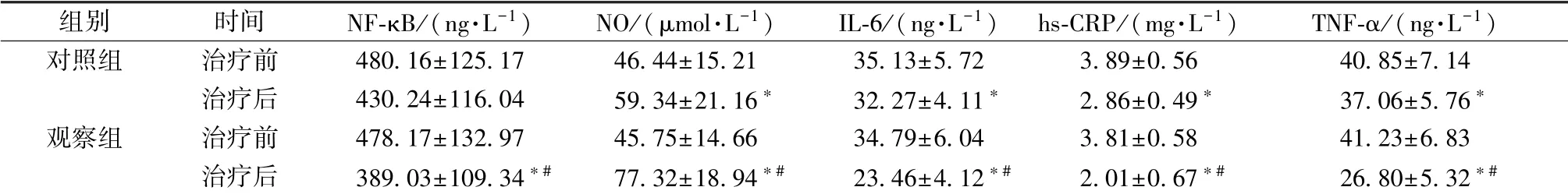
表4 2 组炎症因子比较, n=32)Tab.4 Comparison of inflammatory factors between the two groups (, n=32)
注:与同组治疗前比较,∗P<0.05;与对照组治疗后比较,#P<0.05
组别 时间 NF-κB/(ng·L-1) NO/(μmol·L-1) IL-6/(ng·L-1) hs-CRP/(mg·L-1) TNF-α/(ng·L-1)对照组 治疗前 480.16±125.17 46.44±15.21 35.13±5.72 3.89±0.56 40.85±7.14治疗后 430.24±116.04 59.34±21.16∗ 32.27±4.11∗ 2.86±0.49∗ 37.06±5.76∗观察组 治疗前 478.17±132.97 45.75±14.66 34.79±6.04 3.81±0.58 41.23±6.83治疗后 389.03±109.34∗# 77.32±18.94∗# 23.46±4.12∗# 2.01±0.67∗# 26.80±5.32∗#
2.4 氧化应激指标 表5 显示, 治疗后2 组MDA、 AOPP、 8-OHDG、 HCY、 AGEs 水平显著下降(P<0.05), SOD、 GSH-Px 水平显著升高(P<0.05), 以观察组更明显(P<0.05)。
表5 2 组氧化应激指标比较 n=32)Tab.5 Comparison of oxidative stress indices between the two groups s, n=32)
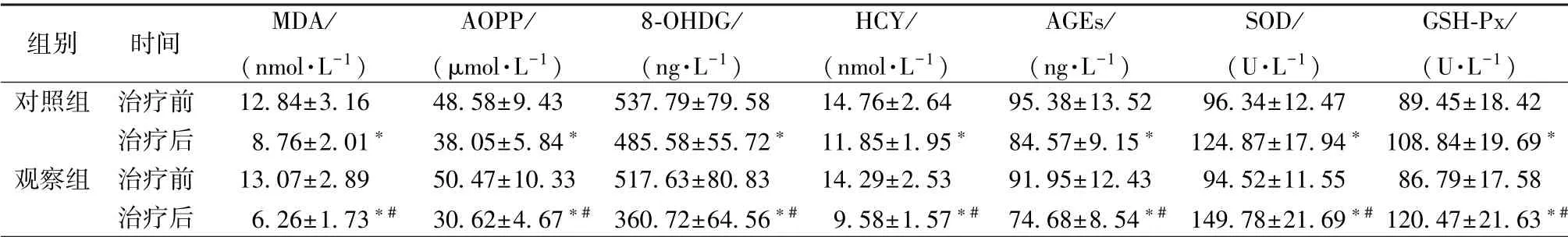
表5 2 组氧化应激指标比较 n=32)Tab.5 Comparison of oxidative stress indices between the two groups s, n=32)
注:与同组治疗前比较,∗P<0.05;与对照组治疗后比较,#P<0.05
组别 时间 MDA/(nmol·L-1)AOPP/(μmol·L-1)8-OHDG/(ng·L-1)HCY/(nmol·L-1)AGEs/(ng·L-1)SOD/(U·L-1)GSH-Px/(U·L-1)对照组 治疗前 12.84±3.16 48.58±9.43 537.79±79.58 14.76±2.64 95.38±13.52 96.34±12.47 89.45±18.42治疗后 8.76±2.01∗ 38.05±5.84∗ 485.58±55.72∗ 11.85±1.95∗ 84.57±9.15∗ 124.87±17.94∗ 108.84±19.69∗观察组 治疗前 13.07±2.89 50.47±10.33 517.63±80.83 14.29±2.53 91.95±12.43 94.52±11.55 86.79±17.58治疗后 6.26±1.73∗# 30.62±4.67∗# 360.72±64.56∗# 9.58±1.57∗# 74.68±8.54∗# 149.78±21.69∗# 120.47±21.63∗#
2.5 不良反应 在治疗的过程中, 2 组均未出现不良反应。
3 讨论
目前普遍认为, 糖尿病神经病变是机体高血糖状态引起多元醇通路激活、 氧化应激、 炎症反应、微血管病变、 神经营养因子的缺乏等众多因素共同作用的结果[10], 临床治疗是在控制血糖的基础上针对病因和临床症状加以辅助性处理, 如抗凝、 抗氧化、 扩张血管、 增加神经营养、 促进神经修复、改善微循环等[11]。 西医治疗主要是通过营养神经来增加神经传导速度, 但起效慢, 效果不佳, 故本研究采用注射用血栓通(冻干) 联合GM1 治疗糖尿病神经病变, 以期改善微循环淤血, 促进神经组织修复。
中医认为, 糖尿病神经病变属于“痹证” “痿证” 范畴, 体阴液亏虚, 瘀血阻络, 不通而痛,四肢神经传导速度减慢是其主要病理改变[12], 本研究发现注射用血栓通(冻干) 联合GM1 能改善患者临床症状, 作用优于单用GM1 治疗。 糖尿病神经病变在持续氧化应激损伤时, 会导致神经细胞发生损伤, 并伴有神经营养物质减少[13], 目前NSE、 BDNF、 S100β 是公认的与神经功能密切相关的因子[14-16]; CNTF 可促进周围神经组织中轴突再生, 有利于神经功能的恢复[17]; SDF-1α 能促进神经祖细胞向损伤神经局部迁移, 促进神经功能的修复。 本研究发现, 治疗后观察组CNTF、 BDNF、SDF-1α 高于对照组, NSE、 S100β 低于对照组,提示联合用药能减轻神经细胞损伤, 增加神经保护因子分泌, 改善神经功能。
糖尿病神经病变发生发展与炎症、 代谢、 自由基有关, 高血糖水平下刺激代谢后可产生大量超氧阴离子, 进而引起细胞坏死和炎症发生[18]。 慢性炎症可使血管和神经元对缺血再灌注损伤更敏感,是导致糖尿病神经病变持续发展的重要因素之一[19-20], 其中NO 可促进小动脉平滑肌舒张, 加快局部血液循环, 改善局部代谢; IL-6 能促进血管增强黏附力, 加速内皮细胞炎症损伤; NF-κB 参与外伤性神经损伤后的炎症、 免疫等多种生理病理过程[21-22]; hs-CRP 是多种疾病独立的、 预测性危险因子, 能反映炎症反应程度。 本研究发现, 治疗后观察组NF-κB、 IL-6、 hs-CRP、 TNF-α 低于对照组, NO 高于对照组, 提示联合用药可通过抑制NF-κB、 IL-6、 hs-CRP、 TNF-α 分泌, 抑制炎症反应, 改善NO 失衡来减轻内皮细胞损伤, 从而有效改善微血管障碍, 修复受损神经。
氧化应激是糖尿病神经病变引起周围神经病变的重要病理环节, 可诱导大量的自由基产生, 生成大量氧化产物[23], 其中HCY 是甲硫氨酸循环中的产物, 与糖尿病微血管病发生发展密切相关;AGEs、 MDA 是组织和细胞发生氧化反应的产物,能反映氧化应激反应的程度; AOPP、 8-OHDG 分别是在蛋白质、 核酸氧化应激反应过程中产生的氧化应激产物; 大量氧自由基产生会消耗SOD、GSH-Px 等多种抗氧化酶, 抑制其将活性氧直接还原为过氧化氢[24]。 本研究发现, 治疗后上述氧化应激指标均得到改善, 提示联合用药能改善患者氧化应激反应, 增强抗氧化能力, 效果优于单用GM1。
综上所述, 注射用血栓通(冻干) 联合GM1能有效地改善糖尿病神经病变患者临床症状, 加快感觉神经和运动神经的传导速度, 促进神经功能恢复, 减轻神经炎症, 缓解氧化应激反应的程度, 安全性较高。

