谷红注射液中2 种成分对脑缺血大鼠氨基酸类神经递质释放的协同作用
潘璐佳, 万海同, 陈俊奎, 诸佳珍, 何 昱
(浙江中医药大学, 浙江 杭州 310053)
脑血管疾病是当今危害中老年健康最严重的疾病之一, 其中87% 为缺血性。 近年来随着我国人口老龄化加剧, 每年大约有300 万人死于该疾病,极大危害了人类生命安全, 也给家庭和社会带来了沉重负担[1-2]。
神经递质是在化学突触传递中担当信使的特定化学物质[3], 由神经末梢分泌, 能作用于所支配神经元或效应细胞膜上的受体, 从而完成信息传递功能。 中枢神经系统中存在2 类作为神经递质的游离氨基酸, 即抑制性氨基酸, 如γ-氨基丁酸(GABA)、 甘氨酸(Gly) 等, 以及兴奋性氨基酸, 如天门冬氨酸(Asp)、 谷氨酸(Glu) 等[4], 对维持神经系统的平衡起着关键的作用[5], 当发生脑缺血时, 两者平衡会遭到破坏, 进一步加重神经细胞损伤, 故调节氨基酸类神经递质平衡已成为防治脑缺血的重要途径之一[6]。
谷红注射液是一种中西药复方制剂, 临床上常用于治疗脑供血不足、 脑血栓、 脑栓塞等疾病, 疗效确切[7]。 前期课题组已证实谷红注射液中含有量最高的主要成分为乙酰谷酰胺和羟基红花黄色素A, 两者也是该制剂发挥药效作用的代表性成分,其中前者是谷氨酰胺乙酰化衍生物, 其代谢途径与谷氨酰胺类似, 能通过血脑屏障并最终分解为GABA 和Glu[8-9], 具有促进氨基酸转运、 改善神经细胞代谢、 提高细胞活力、 改善脑功能的作用[10];后者是红花中水溶性成分的代表物质, 具有显著的抗凝血、 抗氧自由基、 抗兴奋毒性神经元死亡等心脑血管药理作用[11]。 虽然目前研究已证明这2 种成分均具有神经保护作用[12-13], 但尚无关于谷红注射液中两者对脑缺血大鼠海马区氨基酸类神经递质释放协同作用的报道。 因此, 本实验将通过微透析采样技术结合高效液相-电化学检测 (HPLCECD) 法, 探讨谷红注射液中乙酰谷酰胺和羟基红花黄色素A 对脑缺血大鼠海马区氨基酸类神经递质释放的协同作用, 为后续该制剂抗脑缺血损伤作用机制的深入探讨提供借鉴。
1 材料
1.1 仪器 Waters 2695 高效液相色谱仪, 配置Waters 2465 电化学检测器(美国Waters 公司);脑立体定位仪(深圳瑞沃德生命科技有限公司);MD1001 微透析装置(美国BAS 公司); 脑微透析套 管 ( MAB2/6/9.14 )、 脑 微 透 析 探 针(MAB6.14.4, 截留分子量15 kDa, 膜长4 mm)(瑞典Microbiotech/SE AB 公司); XS205DU 电子分析天平(瑞士Mettler-Toledo 公司); Cascada Bio MK2 超纯水仪(美国Pall 公司)。
1.2 试药 谷红注射液(批号20140706, 国药准字H22026582, 通化谷红制药有限公司, HPLC法[14]测定其中乙酰谷酰胺、 羟基红花黄色素A 含有量分别为30、 0.4 mg/mL)。 乙酰谷酰胺(批号D05A6H3, 中国食品药品检定研究院); 羟基红花黄色素A (批号Z01010BA13, 上海源叶生物科技有限公司); Asp (批号KN1123CA13)、 Glu (批号 SLBC5771V)、 Gly ( 批 号 SM0315GA14 )、GABA (批号BCBH1414V) 对照品、 邻苯二甲醛(批号JM0326YA14) (美国Sigma 公司)。 甲醇、乙腈为色谱纯; 其他试剂均为国产分析纯。
1.3 动物 雄性SD 大鼠, 体质量280 ~320 g, 由上海斯莱克实验动物有限公司提供, 动物生产许可证号SCXK (沪) 2012-0002。
1.4 溶液
1.4.1 人工脑脊液及邻苯二甲醛衍生溶液 参照文献[15] 方法制备, 现配现用。
1.4.2 对照品溶液 精密称取Asp、 Glu、 Gly、GABA 对照品适量, 人工脑脊液超声溶解, 即得(质量浓度为1 mg/mL), 4 ℃下避光保存备用。
2 方法
2.1 色谱条件 Agilent Eclipse XDB-C18色谱柱(4.6 mm×250 mm, 5 μm); 流动相A 为12 g 磷酸二氢钠、 0.177 4 g 氯化钠、 0.014 g 乙二胺四乙酸, 溶于1 000 mL 超纯水中, 调节pH 至5.17,流动相B 为甲醇, 梯度洗脱(0 ~12 min, 96%A;12~14 min, 96% ~84% A; 14 ~29 min, 84% A;29~30 min, 84% ~96%A); 体积流量0.6 mL/min;柱温35 ℃; 电化学检测电压0.8 V, 检测温度35 ℃。 10 μL 样品中加入10 μL 衍生剂, 涡旋混匀后进样测定。
2.2 方法学考察
2.2.1 专属性试验 在“2.1” 项色谱条件下对微透析样品进行检测, 考察方法专属性。
2.2.2 线性关系考察 精密吸取4 种氨基酸对照品溶液, 人工脑脊液倍比稀释, 得到10、 25、 50、100、 250、 500、 1 000 ng/mL 系列标准溶液, 取10 μL, 与10 μL 衍生剂混匀, 静置1 min 后在“2.1” 项色谱条件下进样测定, 以进样质量浓度为横坐标(X), 峰面积为纵坐标(Y) 进行回归。
2.2.3 精密度试验 精密吸取1 000 ng/mL 对照品溶液, 在“2.1” 项色谱条件下当天测定5 次,计算日内差异; 再隔天(第1、 3、 5、 7 天) 连续测定, 每天5 次, 计算日间差异。
2.2.4 加样回收率试验 精密吸取含有量已知的脑透析液5 份, 每份20 μL, 加入适量对照品溶液, 涡旋混匀, 取10 μL, 加入10 μL 衍生剂轻轻混匀, 静置1 min 后在“2.1” 项色谱条件下进样测定, 计算回收率。
2.3 分组 大鼠随机分为模型组、 乙酰谷酰胺组(300 mg/kg)、 羟基红花黄色素A 组(4 mg/kg)、谷红注射液组(10 mL/kg), 每组6 只, 给药剂量均根据临床用量, 并结合人和大鼠体表面积换算所得。
2.4 微透析手术 大鼠称定质量后, 腹腔注射10%水合氯醛(350 mg/kg) 麻醉, 固定于脑立体定位仪上, 暴露顶部, 去除骨膜, 用沾有生理盐水的棉球擦拭头骨面至骨面干净暴露。 根据坐标定位于海 马 区 (AP +4.8 mm, ML +5 mm, DV-3 mm), 植入套管, 牙科水泥固定, 室温条件下恢复3~5 d, 精神状态良好者可用于实验。
2.5 模型建立及微透析样品采集 麻醉已植入套管的大鼠, 植入脑部探针, 以1.5 μL/min 体积流量灌流人工脑脊液平衡2 h, 平衡后接3 份空白透析液作为自身对照。 Longa 法[16]建立改良型大脑中动脉局灶性栓塞模型, 钝性分离大鼠颈总动脉、 颈内动脉、 颈外动脉, 结扎颈总动脉、 颈外动脉近心端, 暂时夹闭颈内动脉, 眼科剪在颈外动脉与颈内动脉的分叉处作“V” 字型斜行切口, 插入线栓,松开动脉夹, 将线栓缓缓推入颈内动脉, 有微小阻力时即止, 之后棉线固定线栓, 缺血1 h 后拔出线栓, 再灌注同时尾静脉给药, 给药结束后收集样品, 每20 min 1 次, 至300 min 时结束, 所得样品转入-80 ℃冰箱中保存待测。 实验结束后取出探针, 处死大鼠, 断头取脑, 验证取样部位。
2.6 探针回收率测定 将探针置入100 ng/mL 对照品溶液中, 以1.5 μL/min 体积流量灌流人工脑脊液, 收集体外透析液, 在“2.1” 项色谱条件下进样测定, 计算探针回收率。
2.7 统计学分析 通过SPSS 19.0 软件进行处理,数据以表示, 组间比较采用单因素方差分析。 以P<0.05 为差异有统计学意义。
3 结果
3.1 专属性试验 图1 显示, 4 种氨基酸的色谱峰与其他色谱峰能完全分离, 峰型良好, 无杂峰干扰, 表明分析条件可行。
3.2 线性关系考察 回归方程分别为Asp Y=786.07X+74.234 (r=0.998 9)、 Glu Y=732.88X-74.273 (r=0.999 5)、 Gly Y=3 309.3X +33.653(r=0.999 5)、 GABA Y=2 499.3X +81.009 (r=0.999 8), 均在10 ~1 000 ng/mL 范围内线性关系良好。
3.3 精密度试验 Asp、 Glu、 Gly、 GABA 日内精密度RSD 分别为2.11%、 3.04%、 4.97%、 5.52%,日间精密度RSD 分别为2.96%、 3.27%、 5.78%、6.61%, 均小于10%, 表明该方法精密度良好。
3.4 加样回收率试验 Asp、 Glu、 Gly、 GABA 加样回收率分别为 (99.85±2.01)%、 (101.25 ±2.26)%、 (102.15±3.15)%、 (98.63±3.46)%,均在95% ~105%范围内, 表明该方法回收率良好,符合实验要求。
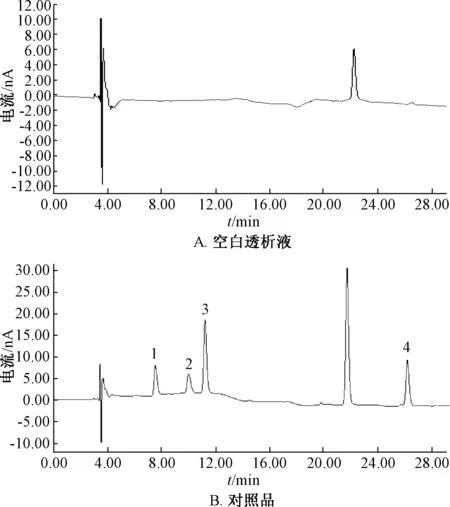
图1 各成分HPLC-ECD 色谱图Fig.1 HPLC-ECD chromatograms of various constituents
3.5 探针回收率 Asp、 Glu、 Gly、 GABA 探针回收率分别为31.5%、 36.4%、 33.2%、 35.8%。
3.6 脑缺血后氨基酸含有量变化 图2 显示, 脑缺血后4 种氨基酸含有量变化明显, 各组大鼠脑海马区其含有量均呈现升高趋势。
3.7 对脑缺血大鼠海马区4 种氨基酸神经递质的影响 图2 显示, 给药组在同一时间点Asp 含有量显著低于模型组(P<0.01), 以谷红注射液组更明显(P<0.01); 各组海马区Glu 含有量呈先升后降趋势, 给药组显著低于模型组(P<0.01), 以乙酰谷酰胺组最高; Gly 含有量呈先升后降趋势, 与模型组比较, 给药组在不同时间点均可显著抑制其过度释放(P<0.01), 乙酰谷酰胺组在同一时间点其含有量显著高于谷红注射液组(P<0.01), 而羟基红花黄色素A 组显著降低(P<0.01); 与模型组比较, 给药组在同一时间点均可显著抑制GABA过度表达(P<0.01), 与羟基红花黄色素A 组比较, 谷红注射液组在同一时间点其含有量显著升高(P<0.01), 而乙酰谷酰胺组与谷红注射液组之间无显著性差异(P>0.05)。
3.8 对脑缺血大鼠海马区Glu/GABA 比值的影响 图3 显示, 与模型组比较, 给药组在不同时间点Glu/GABA 比值有所降低, 以谷红注射液组在120 min时更明显(P<0.01)。
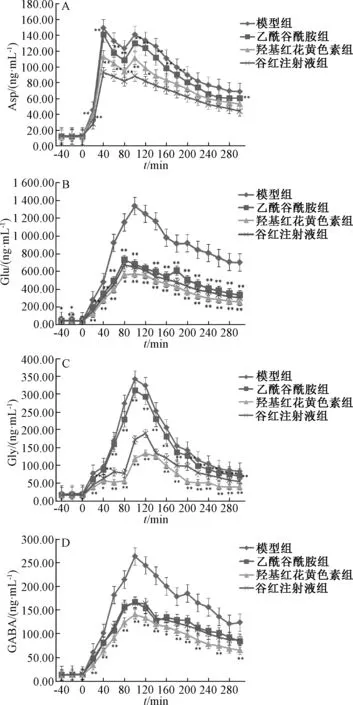
图2 各组Asp (A)、 Glu (B)、 Gly (C)、 GABA(D) 含有量Fig.2 Asp (A), Glu (B), Gly (C) and GABA (D)contents in various groups
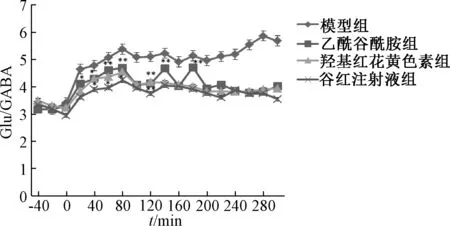
图3 各组Glu/GABA 比值Fig.3 Glu/GABA ratios in various groups
4 讨论
传统脑内神经递质分析大多采用断头取脑方式, 检测神经递质在脑组织匀浆中的含有量, 但其准确性和可靠性往往会被提取纯化中的众多因素所干扰[17]。 近年来, 微透析技术作为一种动态连续的取样方法, 在动物神经递质研究中的应用已越来越受研究者青睐[18], 该技术以透析原理为基础,能在组织或细胞外液进行活体取样, 而且不会对动物的正常生命活动造成影响, 同时还可连续监测动物脑组织中神经递质的动态变化[19]。 由于微透析探针半透膜只允许小分子物质透过[20], 蛋白质等大分子物质会被截留, 而且所得透析液可直接进液相检测, 可避免了预处理过程中所带来的误差, 故本实验采用该方法作为大鼠海马区氨基酸类神经递质的采样方式。
脑缺血再灌注会造成神经元变性坏死, 其重要原因之一是神经递质代谢紊乱, 作为中枢神经系统中重要的神经递质, 氨基酸在神经元之间的信息传递中发挥重要作用[21]。 兴奋性、 抑制性氨基酸含有量变化与脑损伤程度密切相关, 目前大多数学者认为, 脑缺血后以Glu、 Asp 为代表的兴奋性氨基酸含有量显著升高是缺血后兴奋毒性的表现, 会对缺血后神经造成一定程度损伤; 抑制性氨基酸(如Gly、 GABA 等) 含有量变化则是机体维持自我平衡的一种体现, 以此来对抗兴奋性氨基酸过度释放[22]。 Glu/GABA 比值可反映脑内兴奋-抑制性氨基酸的平衡状态, 正常情况下较稳定, 而发生缺血后会迅速升高[23], 在生理情况下, GABA 受体激活可抑制兴奋性毒性, 但其过度激活会对神经细胞产生毒性作用, 这是脑缺血、 癫痫等疾病造成损伤的重要机制之一[24]。 因此, 拮抗兴奋性氨基酸毒性, 包括抑制其过度释放和受体活性、 促进其再摄取, 都成为脑缺血再灌注损伤治疗药物的重要靶点[25]。
谷红注射液中乙酰谷酰胺和羟基红花黄色素A具有一定神经保护作用, 而药物之间联合使用具有整合的药效学优势, 能在多个方面发挥协同增效的作用[26], 故本实验分别以单用及两者合用对脑缺血大鼠海马区氨基酸类神经递质释放的协同作用进行考察, 发现脑缺血时大鼠脑海马区4 种氨基酸神经递质含有量均显著升高, 而给药组能降低Asp、Glu 含有量及Glu/GABA 比值, 其中谷红注射液组Glu 含有量低于乙酰谷酰胺组但高于羟基红花黄色素A 组, GABA 含有量高于羟基红花黄色素A 组,并且能明显降低Glu/GABA 比值, 表明乙酰谷酰胺和羟基红花黄色素A 对降低Glu 含有量、 提高GABA 含有量、 维持脑缺血大鼠海马区兴奋-抑制性氨基酸神经递质之间的平衡具有一定协同作用。
综上所述, 谷红注射液中乙酰谷酰胺和羟基红花黄色素A 对降低兴奋性氨基酸(Glu、 Asp) 含有量、 升高抑制性氨基酸(Gly、 GABA) 含有量、调节两者之间动态平衡具有一定的协同作用, 从而起到抗脑缺血再灌注损伤的作用。

