新疆主栽骨干棉花品种指纹图谱构建及纯度鉴定
布卡·欧尔娜,张 文,曾庆涛,马丽娟,逯 涛,蔡晓莉,赵富强
(新疆生产建设兵团第七师农业科学研究所,新疆奎屯,833200)
0 引 言
【研究意义】新疆已审定的棉花品种数量较多,其中新陆早6号、新陆早33号及新陆早36号为3个主推骨干品种。新陆早6号是由新疆生产建设兵团第七师农业科学研究所于1996年选育出的早熟丰产优质棉花新品种,累计推广面积60×104hm2(900万余亩)为早熟棉区主栽品种之一;新陆早33号是由新疆农垦科学院棉花研究所于2007年选育出的早熟优质抗病棉花新品种,累计推广面积66.67×104hm2(1 000万余亩),新陆早36号是由新疆生产建设兵团第八师农业科学研究所于2007年选育出的早熟丰产耐病新品种,累计推广面积53.33×104hm2(800万余亩),系62号是由新疆生产建设兵团第七师农科所于2017年选育出的示范品系,是国审棉Z1112姊妹品系。近年来,由于棉花长期遗传定向改良,亲本数量有限且反复集中使用,致使我国棉花品种的遗传基础较为单一,只靠传统的生物学性状很难将其准确区分鉴别[1]。构建新疆主栽骨干棉花品种的指纹图谱,对棉花分子育种具有实际意义。【前人研究进展】近年来,DNA分子标记的发展使棉花品种鉴定进入基因水平,其中SSR标记具有多态性高、共显性遗传的特点,成为棉花品种鉴定研究的热点[3]。前人已有很多的报道采用SSR标记技术开展棉花品种指纹图谱的构建及遗传多样性的研究。例如,Diqiu Liu等[4]对我国棉花遗传多样性进行了微卫星分析。Iqbal等[5]对1个亚洲棉品种和22个陆地棉品种进行RAPD分析,认为陆地棉品种的遗传基础很小。冯艳芳等[6]基于SSR标记构建了20个棉花品种的指纹图谱。贺道华等[7]利用分布于全基因组的SSR标记评价了92份包括陆地棉、海岛棉、亚洲棉在内的棉花资源的遗传多样性。田琴等[8]利用SSR分子标记法分析了12个早熟陆地棉亲本遗传距离及杂种优势。李育强等[9]利用SSR分子标记方法构建湘杂棉系列棉花的指纹图谱。吴大鹏等[10]对四个国家海岛棉品种资源的亲缘关系及遗传多样性进行了研究。薛艳等[11]利用SSR标记构建了新疆早熟棉品种的指纹图谱。刘国栋等[12]采用SSR引物对51个常规棉品种进行了基因纯度鉴定、遗传聚类分析和品种特异性鉴定。聂新辉等[13,14]构建了新疆2013年前审定的51个新陆早常规棉品种和23个彩色棉品种的DNA指纹图谱,并进行了遗传多样性分析。近年来,利用SSR标记也构建了小麦[15]、水稻[16]、大豆[17]、玉米[18]、烟草[19]等农作物的DNA指纹图谱数据库。【本研究切入点】当前棉花品种纯度和真实度多是通过田间小区种植的方法鉴定的,此法费时费力,操作复杂,且受环境影响较大[2]。选用新疆4个骨干棉花品种,构建棉花品种的指纹图谱,棉花品种纯度进行分析研究。【拟解决的关键问题】采用SSR分子标记技术通过构建棉花品种的指纹图谱及纯度检测,为棉花品种提供分子理论依据,为主推骨干亲本指纹图谱构建提供依据。
1 材料与方法
1.1 材 料
棉花品种新陆早6号、新陆早33号、新陆早36号、系62号均由第七师农科所提供。SSR引物由上海生工合成,植物DNA提取试剂盒、2×EsTaqMasterMix(Dye)购自康为世纪生物有限公司,其他试剂均为国产分析纯。
1.2 方 法
1.2 .1 DNA提取及SSR检测
4个棉花品种各取20 粒去壳种子,用研钵棒压碎后分别转入2 mL的离心管中,用植物DNA提取试剂盒提取棉花基因组DNA。用1%的琼脂糖凝胶电泳检测提取DNA,验证DNA的完整性。
SSR-PCR扩增。采用10 μL PCR扩增体系:模板DNA 1 μL;ddH2O 5.2 μL,2×EsTaqMasterMix(Dye) 3 μL,正向引物0.4 μL,反向引物0.4 μL。PCR反应程序:94℃预变性2 min;94℃变性45 s,退火温度(50~60 ℃)退火45 s,72℃延伸1 min,共30个循环;72℃延伸7 min;4℃保存。
聚丙烯酰胺凝胶电泳。扩增产物生物非变性8%(质量分数)的聚丙烯酰胺凝胶电泳。每个孔点样品2.5 μL,150 V电压1 h。固定5 min、渗透8 min、显色5 min,终止反应。
综合全面评价已有的1 000多对引物,选择扩增清晰稳定、多态性高、带型统计容易的标记引物65对,对参试品种再次筛选,最后确定核心引物25对。
1.2 .2 指纹建立
按照PCR扩增产物在聚丙烯酰胺电泳凝胶上的谱带位置,对每对引物形成的不同基因型进行编号记录,建立4份棉花品种的DNA分子指纹图谱。电泳结果采用数字0、1读取,同一位置有带的记为1,无带的记为0,然后将每对引物在品种间扩增得到的二进制(0、1)数据转化为十进制数据,则该十进制数据表示每个引物扩增的结果,每4个引物组合形成的十进制数字串就是每一个品种的数字指纹图谱。
1.2 .3 纯度检测
从4个供试样品中分别随机选择20个单株作为样本。根据引物筛选结果,分别选取10对核心引物进行纯度检测。
1.3 数据处理
各引物对应不同基因型扩增,计算位点多态性信息含量(Polymorphism information content,PIC),按公式PIC=1-∑Pi2计算,其中Pi指第i个等位变异出现的频率。品种纯度P=(NT-ND)/NT×100%,式中NT为供试品种总株数,ND为杂株数,以平均值表示该品种的纯度值。
2 结果与分析
2.1 SSR核心引物确定及引物信息
研究表明,25对核心引物在4份供试材料中检测到基因型位点数70个,每对引物检测到的基因型位点数在2~7个,平均2.8个。其中基因型个数大于平均数的引物有11个,编号分别为2、3、5、7、8、11、12、13、18、20、25。NAU1103在4份材料中扩增出基因型个数为3个,NAU1322在在4份材料中扩增出基因型个数为2个。图1
标记间的PIC值在0.169 0~0.872 9,平均为0.688 3,其中PIC值大于平均数的标记有17个,引物编号分别为1、2、3、4、5、7、15、16、17、18、19、20、21、22、23、24、25,表明这些标记具有较高的多态性,有利于指纹图谱的构建。
基因型个数和PIC值均大于平均数的引物有7个,如NAU1103,等位基因数与基因型个数分别为5和3,PIC值为0.830 0,证明了挑选的核心引物有效性高,鉴别品种能力强。表1,图1
表1 25对SSR标记引物多态性信息
Table 1 Polymorphism information of 25 SSR loci

引物编号Primer number引物Primer等位基因数No.of alleles基因型个数No.of genotypesPIC1NAU1190420.773 42BNL1317570.872 93CIR307240.705 54NAU1102420.781 35Gh277340.780 66Gh132120.304 77NAU1103530.830 08NAU2631230.576 09NAU3096320.521 610NAU5426320.169 011NAU5064340.543 612BNL3590440.556 513BNL2646640.591 414DPL0528320.433 415MGHES-40520.815 016Gh111420.835 017Gh60420.812 518JESPR96530.835 019NAU1014520.842 520JESPR50530.835 021NAU2277320.708 322BNL1317420.773 423NAU5120320.750 024NAU1322420.796 925JESPR290630.764 1平均Average3.82.80.688 3
2.2 供试品种的指纹图谱
采用25对引物对4个棉花品种进行指纹图谱分析,得出4个棉花品种均具有其特征引物。在一定材料范围内,某品种有着明显区别于其他品种的特有指纹信息的引物被称为特征引物。通过特征引物就可以直接区分该品种和其他品种。研究表明,新陆早6号有2个特征引物,新陆早33号有4个特征引物,新陆早36号有1个特征引物,系62有2个特征引物。可用4对核心引物的指纹信息构建4个棉花品种的指纹图谱。表2

P1:引物 NAU1103P2:引物 NAU1322a,b,c,d:分别为新陆早6号、新陆早33号、新陆早36号、系62号四个棉花品种
P1: Primer NAU1103 P2: Primer NAU1322a,b,c,d:Four cotton varieties including Xinluzao 6, Xinluzao 33, Xinluzao 36 and Xi 62.
图1 标记NAU1103、NAU1322在4份棉花中的电泳扩增等位基因特征
Fig.1 Alleles feature of marker NAU1103、NAU1322 in 4 cotton varieties
表2 4个棉花品种特征引物
Table 2 Specific primers for 4 cotton varieties

品种Variety特征引物Special primer新陆早6号 Xinluzao 6Gh60、NAU1014新陆早33号Xinluzao 33Gh111、NAU2277、BNL1317、CM45新陆早36号Xinluzao 36NAU5120系62 Xi 62NAU1103、NAU1190
表3 利用25对引物构建4份棉花品种的指纹信息
Table 3 DNA fingerprinting of 4 cotton varieties using 25 primers

品种VarietyDNA指纹DNA fingerprinting新陆早6号 Xinluzao 62-3-2-7-0-5-1-5新陆早33号Xinluzao 331-5-3-1-0-5-1-5新陆早36号Xinluzao 361-5-2-7-0-3-1-5系62 Xi 621-5-2-7-0-5-1-1
4 primers:NAU1014-Gh111-NAU5120-NAU1190
2.3 参试品种纯度检测
采用单位点平均法,分别从25对核心引物中筛选出10对引物,分析4个棉花品种纯度。其中,基于指纹图谱特征引物NAU1014、Gh111、NAU5120、NAU1190应用于每一个品种的纯度检测中。
单个品种用10 个不同引物鉴定纯度时,品种纯度低于95%的引物有NAU1014、Gh111、NAU5120、NAU1190、CIR307、NAU1102等6种,品种纯度最低的引物为NAU1190,纯度为88.75%;品种纯度最高的引物为JESPR50、BNL2646、BNL1034、NAU1201,纯度为100%,这几个引物的品种鉴别能力较强。表3
表4 4个棉花品种纯度检测引物信息及纯度分子鉴定
Table 4 Primer information of purity test and Purity of identified by molecular marker in 4 cotton varieties

品种Variety引物Primer纯度Purity(%)新陆早6号 Xinluzao 6NAU1014、Gh111、NAU5120、NAU1190、NAU1322、NAU1102、JESPR50、CIR307、NAU3096、MGHGS-4092.0新陆早33号Xinluzao 33NAU1014、Gh111、NAU5120、NAU1190、NAU1322、NAU1102、NAU3096、NAU1201、CIR307、MGHGS-4097.0新陆早36号Xinluzao 36NAU1014、Gh111、NAU5120、NAU1190、NAU1322、Gh60、CIR307、JESPR96、NAU2277、JESPR5098.0系62 Xi 62NAU1014、Gh111、NAU5120、NAU1190、NAU1322、BNL1034、NAU1102、NAU1103、BNL2646、BNL131799.5
研究表明,同一品种用不同引物检测纯度,其一致性带型有一定差异。新陆早6号用10对引物检测,其一致性变化范围85%~100%,平均92%;新陆早33号用10对引物检测的一致性变化范围90%~100%,平均97%;新陆早36号用10对引物检测的一致性变化范围85%~100%,平均98%;系62号用10对引物检测的一致性变化范围95%~100%,平均99.5%。表4,图2
新陆早6号的纯度最低,为92.0%,系62号的纯度最高,为99.5%。表4,图2~5
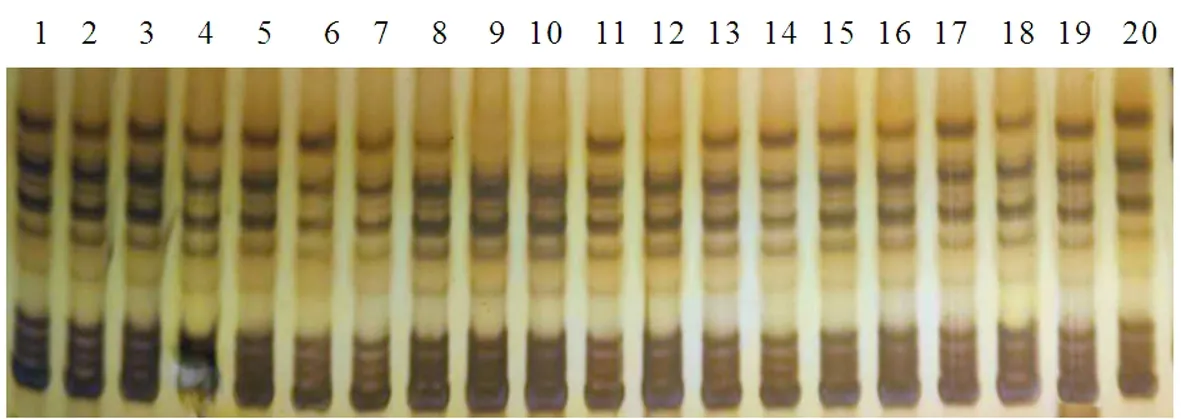
图2 引物NAU1014在20个单株(新陆早6号)的纯度扩增
Fig.2 Amplified result of 20 plants of Xinluzao 6 with primer NAU1014

图3 引物NAU1102在20个单株(新陆早33号)的纯度扩增
Fig.3 Amplified result of 20 plants of Xinluzao 33 with primer NAU1102

图4 引物Gh111在20个单株(新陆早36号)的纯度扩增结果
Fig.4 Amplified result of 20 plants of Xinluzao 36 with primer Gh111

注:1~20:取同一品种的20个单株
Note:1-20:Take 20 individual plants of the same variety
图5 引物NAU1190在20个单株(系62号)的纯度扩增结果
Fig.5 Amplified result of 20 plants of Xi 62 with primer NAU1190
3 讨 论
试验选择的4个主栽骨干品种具有典型代表性,代表区域多样化。新疆北疆不同育种单位在早熟棉选育过程中逐渐形成了各自的特点及优势,表现在各育种单位在基础种质资源上确立了其特定的选育方向。试验选择的新陆早三个品种分别来自于不同的育种单位,且分布广、推广面积大,均为新疆主栽骨干品种,可代表不同的区域,具有特殊性。
研究以25对核心引物SSR标记扩增检测到多态性基因型位点70个,其中报道显示,张晓娟等[20]2011年用52对引物对95份棉花骨干种质资源遗传多样性进行分析,研究筛选的引物有7个与其相同,分别为NAU1190、NAU1102、Gh132、MGHES-40、Gh111、NAU2277、NAU1322,说明这些引物可重复性好,具有较强鉴别品种的能力;聂新辉等[13]2014年用51个新陆早棉花品种、75对引物构建了指纹图谱,进行了遗传多样性分析,研究筛选的引物有8个与其相同,分别为NAU1190、BNL1317、CIR307、NAU1102、Gh277、Gh132、NAU1103、NAU2631;其中,研究与以上2篇文献都相同的引物有3个,分别为NAU1190、NAU1102、Gh132,说明这3个引物多态性好,重复性高,且具有代表性和广适性,可用于后续棉花品种纯度鉴定及指纹图谱的构建。另外,研究中NAU1190和BNL1317分别是新陆早6号和新陆早33号的特征引物,在聂新辉等的文章中,NAU1190和BNL1317分别是新陆早23号和新陆早34号的特征引物,与前人的研究相比较,研究鉴别的这两个引物多态性好,鉴别品种能力强。
朱美霞等[21]认为纯度较高的棉花品种只需要2~4对引物即可获得准确的检测结果;对于纯度较低的品种,则需要5~10对引物才能获得比较准确的检测结果。而研究利用10个核心引物及单位点平均法统计样品纯度。
试验结果显示,新陆早6号在4个品种中纯度最低,为92.0%,系62号纯度最高,为99.5%。这可能是因为随着选育时间的延长,品种纯度降低。新陆早6号于1996年选育出,经过20多年培育,其品种纯度逐年有所降低,而系62号为新品种,还未经过长时间的培育,其品种纯度自然较高。
4 结 论
4.1 以具有典型代表性的新疆北疆早熟棉花主推骨干品种为材料,利用SSR分子标记技术,从1 000多对SSR引物中筛选出稳定性好、多态性高的25对核心引物,筛选出的25对核心引物具有代表性和广适性,可以用于其他品种指纹图谱的构建及纯度鉴定。
4.2 采用25对引物对4个棉花品种进行指纹图谱分析,得出4个棉花品种均有其特征引物,分别利用4个特征引物将4份品种一次性完全区分开,并构建了供试品种的指纹图谱。品种指纹图谱的构建,可以快速、准确地鉴别各个品种的真伪。
4.3 从核心引物中筛选出10对引物作为标记,分析得出了4个棉花品种的纯度。SSR标记检测品种纯度的方法不受环境影响、所需时间短、精度高、重复性稳定。该结果在DNA水平上反映了鉴定品种的位点一致性情况,可以作为田间纯度鉴定的有益补充。

