阿霉素负载的直链烷基修饰氧化石墨烯经导管动脉化疗栓塞治疗肝癌
唐可禺,林 润,姜 云,李 楠,陈 斌,张 弢,杨建勇,黄勇慧
(1.中山大学附属第一医院放射介入科,广东广州510080;2.南京大学现代工程与应用科学学院生物医学工程系,江苏南京210093)
原发性肝癌(hepatocellular carcinoma,HCC)是我国的多发病和常见病[1]。HCC起病隐匿,多数患者确诊时已处于无治愈性治疗指征的进展期。经导管动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)是进展期肝癌的首选治疗方法[2]。传统的TACE(conventional TACE,cTACE)采用碘化油作为药物载体和栓塞材料,在阻断肿瘤血供的同时在肿瘤区域释放化疗药物使肿瘤坏死[3]。然而碘化油与含化疗药物水溶液形成的乳化液不稳定,混合后快速分离,化疗药物在TACE后迅速释出,导致其在肿瘤内的浓度降低,进入体循环增多,进而造成肿瘤细胞坏死不彻底、全身副作用大[4],研究新型的药物载体已经成为迫切的临床需求。近年来,氧化石墨烯(graphene oxide,GO)是生物医学工程等领域的研究热点。GO的巨大载药潜力一方面来自其较高的比表面积,另一方面得益于它表面上大量的羟基、羧基等功能基团[5]。然而GO表面含有大量亲水基团,因此无法与碘油混合形成稳定的分散系[6]。为了使GO能稳定分散于碘油中,本课题组用化学方法在GO片层上引入了直链烷基,获得了直链烷基修饰的氧化石墨烯(linear alkyl grafted graphene oxide,GO-C18),显著提高了GO的疏水性能,通过与GO片层之间的π-π堆积作用负载化疗药物,如阿霉素(doxorubicin,DOX),从而使亲水的药物可以均匀分散在疏水介质[7]。GO的生物安全性以及作为药物载体的可行性已经有较多研究探讨,但是利用碘油混合GO作为药物载体应用于TACE治疗的相关安全性和可行性尚无报道[8]。本研究探究阿霉素负载的直链烷基修饰氧化石墨烯(doxorubicin loaded linear alkyl grafted graphene oxide,DOX@GO-C18)在碘油中的稳定性及在TACE中应用的可行性。
1 材料与方法
1.1 主要实验材料
DSA对比剂碘帕醇注射液[典比乐®,c(I)370 mg/mL]、CT对比剂碘普罗胺注射液[优维显®,c(I)370 mg/mL]分别购自 Bracco公司(Milan,Italy)和Bayer公司(Leverkusen,Germany)。石墨烯(KNG-G5,直径范围5~20 μm,厚度为1~5层)、十八烷基异氰酸酯[CH3(CH2)17NCO,C18NCO,>80%]、盐酸阿霉素(doxorubicin,DOX,>98%)、4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)分别购自厦门Knano石墨烯技术有限公司、东京化成工业株式会社、购于上海阿拉丁试剂公司、Life Technologies(Gaithersburg,MD,USA)。碘化油注射液购于烟台鲁银药业有限公司。戊巴比妥钠(>99%)、恩诺沙星(enrofloxacin)购于Merck公司(Darmstadt,Germany)。4 F导管鞘和 2.2 F Carnelian ER微导管分别购上海泰尔茂医疗产品有限公司和 Tokai Medical Products Inc.(Tokyo,Japan)。
1.2 制备与表征阿霉素负载的直链烷基修饰氧化石墨烯
1.2.1 DOX@GO-C18的制备和表征 方法见课题组前期文章[7]。利用π-π堆积作用将阿霉素(doxorubicin,DOX)负载于GO-C18获得阿霉素负载的直链烷基修饰氧化石墨烯(doxorubicin loaded linear alkyl grafted graphene oxide,DOX@GOC18),方法如下。取10 mg GO-C18置于10 mL无水乙醇,用超声使GO-C18均匀分散。取10 mg DOX溶解于30 mL超纯水,然后将GO-C18溶液与DOX溶液混合,震荡10 min后置于37℃的水浴摇床中,频率为100 r/min。24 h后,将混合溶液离心5 min,4 000 r/min(r=7.6 cm),并收集底部沉淀物于37℃下真空干燥12 h,获得DOX@GO-C18,于4℃下保存备用。采用课题组前期文章类似的方法以傅里叶红外光谱(Fourier translation infrared spectrum,FT-IR)、X射线衍射谱(X-ray diffraction spectrum,XRD)等方法表征石墨、GO、GO-C18以及DOX@GO-C18[7]。
1.2.2 DOX@GO-C18碘油分散液稳定性检测将100 mg DOX@GO-C18加入20 mL碘油中,经超声破碎仪(Digital Sonifier®450,Danbury,USA)分散,参数为振幅40%,时长1 min,每次持续1 s,间隔1 s。取4mL含DOX@GO-C18的碘油(5 mg/mL)置于容器中,加入生理盐水2 mL,静置3 d后,观察DOX@GO-C18的稳定性。
1.3 建立兔VX2肝癌模型
动物实验方案通过中山大学动物伦理委员会批准。雄性新西兰大白兔购自南方医科大学动物实验中心,饲养在中山大学实验动物中心(北校区)。VX2细胞株购于中山大学实验动物中心。兔VX2肝癌实验动物模型的制备方法见课题组前期文章[9],简述如下。实验动物于术前禁食12 h,术前予30 mg/kg戊巴比妥钠静脉注射麻醉实验动物,备皮、消毒铺巾后,取腹部正中切口开腹,暴露肝左叶,用20 mL注射器针头于肝左叶最厚处穿刺构成隧道,将VX2瘤块(体积约1 mm3)埋入隧道深部,再用明胶海绵片封堵,缝合关腹,包扎,并予恩诺沙星每千克体质量2 mg肌注预防感染。约2周后肝内肿瘤生长至适合介入操作的大小,直径约15~20 mm,行经增强CT扫描(Aquilion One,Toshiba Co,Tokyo,Japan)确定肿瘤情况。增强CT扫描的参数为:球管电压80 kV,电流80 mA,螺旋时间0.275 s,像素间隔1 mm及重建层厚0.5 mm。对比剂使用高压注射器(MEDRAD,USA)经耳缘静脉以流速0.5 mL/s,总量1.5 mL/kg注入。
1.4 TACE治疗
术前CT检查后3 d内在兔VX2肝癌模型上行TACE治疗,操作方法见课题组前期文章[9],简述如下。实验动物术前禁食12 h,以前述方法麻醉瘤兔后,取仰卧位固定,双侧腹股沟备皮、消毒铺巾,切开皮肤并分离股动脉,在直视下进行穿刺,引入4 F导管鞘、2.2 F微导管,在飞利浦平板血管造影系统(Allura Xper FD20,Philips,the Netherlands)及数字减影血管造影(digital subtraction angiography,DSA)引导下运用导丝和导管配合选择性插管至腹腔干并造影,明确肿瘤供血动脉后,超选择性插管至肝段的肿瘤供血动脉,予DOX@GO-C18碘油分散液(5 mg/mL)约0.4 mL栓塞,至栓塞后造影见肿瘤染色基本消失为止。术毕拔出导管及导管鞘,结扎股动脉,逐层缝合切口,包扎,并予恩诺沙星每千克体质量2 mg肌注预防感染。
1.5 安全性以及疗效评估
于TACE术前、术后1、3、7以及14 d取瘤兔外周静脉血液样本,静置于4℃冰箱内8 h后,置于离心机中(Sigma 4K15,Sigma Laborzentrifugen GmbH,Germany),4 200 r/min(r=7.6 cm),温度4 ℃,离心10 min,取上层血清置于-20℃冰箱内保存。将所取的血清置于全自动生化分析仪(AU5800,Beckman Coulter Inc.,USA)测定谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)以及总胆红素(total bilirubin,TBIL)含量。试剂为仪器配套。然后对瘤兔行行增强CT扫描以明确疗效,扫描参数如前所述。在治疗前后的CT图像上,测量肿瘤的横断面最大直径,用RECIST1.1标准(Response Evaluation Criteria in Solid Tumors 1.1)评价疗效[10]。增强CT扫描后以过量麻醉法处死实验动物,并分离肿瘤组织,切取肿瘤最大截面,固定在10%多聚甲醛缓冲溶液并包埋在蜡块中,制成厚度为4 μm切片分别行HE染色、油红染色及DAPI染色,然后置于显微镜(Axio Imager Z1,ZEISS,Germany)下观察肿瘤坏死程度,GO-C18、碘油以及DOX的分布。
1.6 统计分析
图像绘制及统计学分析均在IBM SPSS statistics 22或GraphPad prism 6软件上进行分析,所有数值均行Kolmogorov-Smirnov正态分布检验,若为正太分布则表示为平均值±标准差(),否则则表示为 P50(P25~P75)。肿瘤最大直径采用 paired student-t检验进行统计学分析,以P<0.05为差异有统计学意义。ALT、AST及TBIL采用重复测量单因素ANOVA或Friedman秩和检验进行统计学分析,组间两两比较采用配对t检验或秩和检验,配对4次,重复检验名义水准α′=0.05/4=0.012 5,P<0.012 5为差异有统计学意义。
2 结果
2.1 DOX@GO-C18的制备和表征
DOX@GO-C18的成功制备由傅里叶红外光谱(FT-IR)、X射线衍射谱(XRD)等方法证实(图1A,B)。图1A为石墨(graphite)、GO、GO-C18和DOX@GO-C18的傅里叶红外光谱。其中石墨的红外光谱曲线几乎是一条直线;以改良Hummers法氧化后的氧化石墨烯(GO),由于片层上引入了羟基、羧基以及环氧基,其红外谱图在3 400 cm-1处有一个典型的O-H伸缩振动吸收峰,在1 716 cm-1和1 055 cm-1处出现了羰基的伸缩振动吸收峰,在1 621 cm-1和1 224 cm-1处分别出现了C-O的伸缩振动吸收峰和摇摆振动吸收峰。经疏水性修饰的GO-C18,甲基和亚甲基群的摇摆振动吸收峰分别出现在2 921 cm-1和2 848 cm-1处,这表明长链烷基被成功接枝到了GO上。最后,DOX@GO-C18红外谱图与GO-C18的不同,也可以说明阿霉素已经被成功负载到GO-C18上。在X射线衍射谱上(图1B),石墨的衍射峰出现在2θ≈26.4°处,属于(002)晶面衍射;被氧化成GO后,由于含氧基团的引入以及片层的剥离,片层间距变大,衍射峰向左偏移,出现在2θ≈10.4°处,属于(001)晶面衍射。而对于GO-C18,衍射峰继续向左移,出现在2θ≈7.5°处,这表明石墨烯的片层间距进一步增加;负载阿霉素后,衍射峰进一步左移至2θ≈5.2°处。分析表明,随着制备深入,样品衍射峰不断向左移动,即石墨烯层间距不断增大,根据布拉格方程依次可算得层间距为0.34 nm(石墨)、0.85 nm(GO)、1.18 nm(GO-C18)、1.70 nm(DOX@GOC18)。
DOX@GO-C18分散于碘油(5 mg/mL)中静置3 d后经观察无明显聚集沉积等现象(图1C)。在加入生理盐水后,静置3 d,DOX@GO-C18仍能稳定分散在碘油相中(图1C)。

图1DOX@GO-C18的表征与稳定性Fig.1 Characterization and stability of DOX@GO-C18
2.2 兔VX2肝癌模型建立及TACE治疗
兔VX2肝癌模型的建立以动态增强CT扫描确认,并选取成功成瘤的5只兔进行下一步治疗。在CT平扫图像上,VX2肝癌呈类圆形低密度区(图2A);增强扫描肿瘤呈环形强化,肿瘤中心为无强化的坏死区(图2B)。DSA选择性腹腔干以及肝动脉造影中,VX2肝癌表现为增粗絮乱的肿瘤血管,周围血管呈弧形“抱球征”(图2C)。经TACE治疗后,DSA造影可见病灶区域大部血管影消失,肿瘤血供明显减少(图2F)。在栓塞周后的CT平扫图像上,碘油仍沉积在前述环形强化的血管中,中央区域几乎无碘油沉积(图2D),增强扫描肿瘤区域无明显强化血管影(图2E)。
2.3 TACE治疗疗效
根据RECIST1.1标准,在治疗前后的CT影像中选取病灶横断面最大直径进行测量和比较。经测量,治疗前的病灶最大直径为(2.40±0.33)cm,治疗后的病灶最大直径为(2.43±0.35)cm,差异没有统计学意义(t=0.974,P=0.3746,P > 0.05)。
2.4 TACE术后的病理学检查
在HE染色中,肿瘤组织内可见核大畸形、深染的肿瘤细胞,部分细胞可见分叶核、多核,核浆比例明显增大。部分区域可见片状无核、均质的坏死区。肿瘤血管内(红色箭头)及周围(黄色箭头)可见DOX@GO-C18沉积(图3A)。在油红染色中,肿瘤血管内部、血管周围以及肿瘤组织内均可见DOX@GO-C18(红色箭头)沉积(图3B、C)。在DAPI染色的荧光图片中可以清楚的观察到TACE术后DOX(红色荧光)经肿瘤血管进入肿瘤组织,在同一位置的油红染色中可确认DOX分布在DOX@GO-C18与碘油所在的肿瘤血管及组织周围(图3D-G)。

图2 治疗前后CT图像及栓塞前后DSA造影图Fig.2 CT and DSA images before and two weeks after TACE
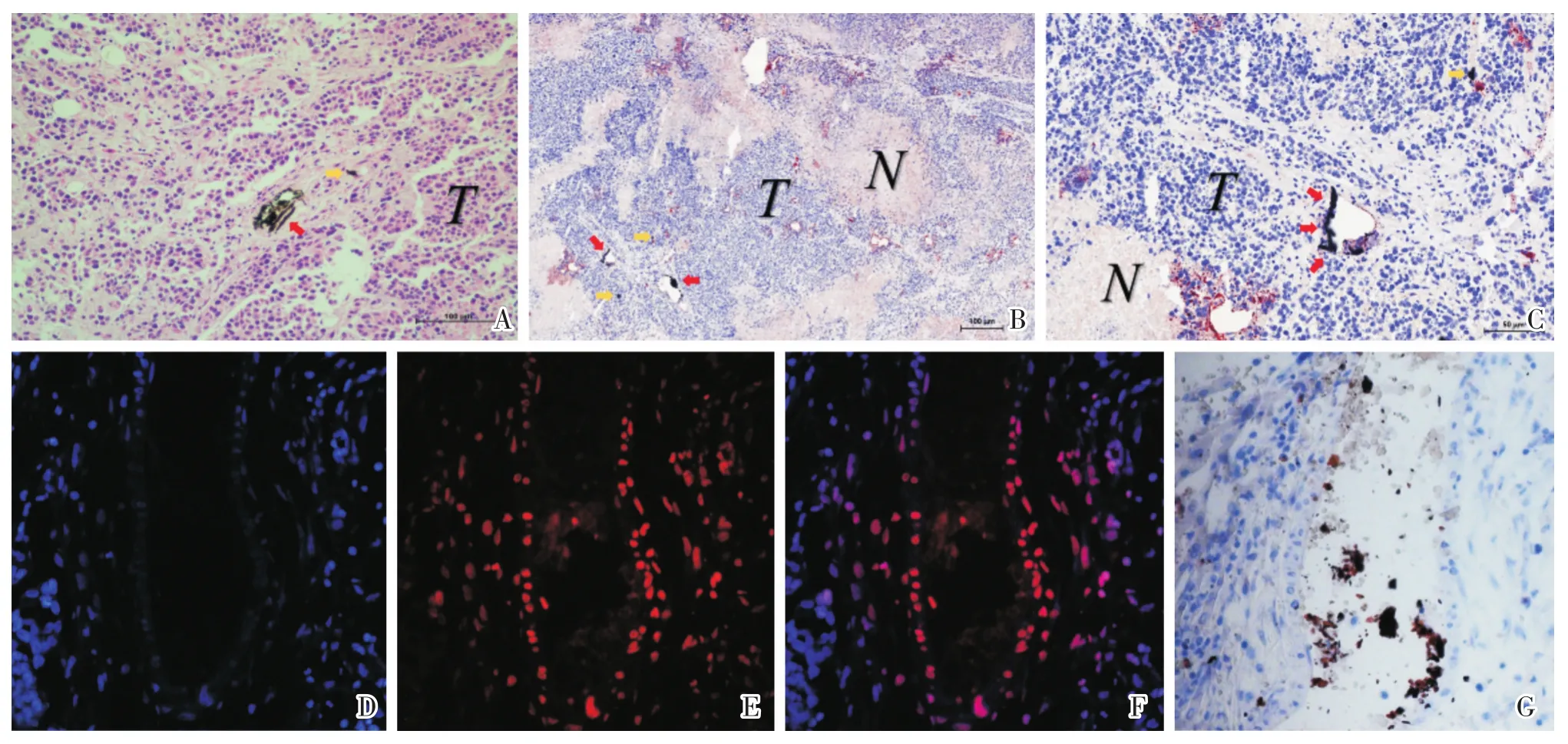
图3 TACE术后肿瘤的HE染色、油红染色及荧光图像Fig.3 HE staining,Oil Red O staining and fluorescence images of VX2 tumor after TACE
2.5 TACE前后的血清学检测
TACE术前的ALT、AST及TBIL分别为(41.34±3.33)U/L、21.60(19.55~23.58)U/L以及(2.60±0.19)μmol/L。术后第1、3、7以及14天ALT分别为(880.70±86.21)、(532.70±82.03)、(171.40±92.21)和(52.88±7.48)U/L。术前与术后差异具有统计学意义(F=134.05,P <0.0001);仅术后第1天(P <0.0001;图4A)及第3天(P <0.0001,图4A)与术前比较差异有统计学意义。术后第1、3、7以及14天AST分别为 1449(1267~2144)、629.8(538.2~783.6)、231.8(211.0~300.6)和28.00(23.55~37.05)U/L。术前与术后差异具有统计学意义(Q=19.36,P=0.0010);仅术后第1天(P=0.0010;图4B)与术前比较差异有统计学意义。而相应的TBIL在术后分别为(2.84±0.43)、(3.61±0.44)、(2.59±0.17)和(2.59±0.08)μmol/L。术前与术后差异具有统计学意义(F=11.87,P=0.0046);仅术后第3日的TBIL与术前比较差异有统计学意义(P=0.078;图4C)。对于所有的肝功能指标,术前与术后14 d均无统计学差异。
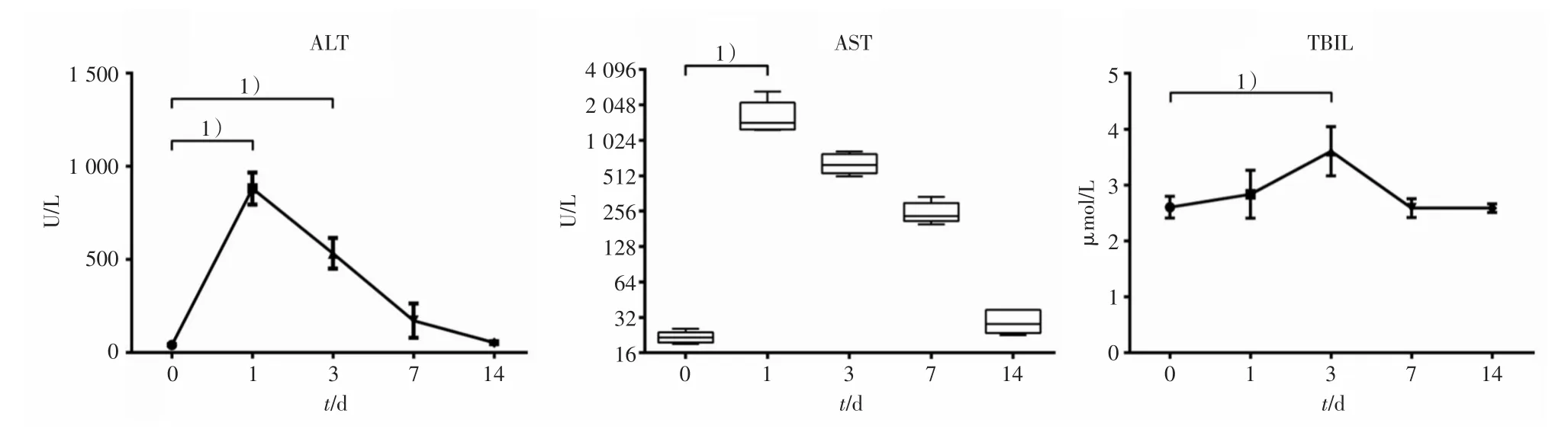
图4 术后的ALT、AST和TBIL血清浓度Fig.4 Post TACE serum concentrations of ALT,AST,and TBIL
3 讨论
TACE是进展期肝癌的主要治疗方法之一,可有效地延长患者的生存期[11]。TACE一方面阻断肿瘤血供使其缺血缺氧从而导致坏死和凋亡,另一方面利用载体将化疗药物输送至肿瘤组织起到局部释放并杀伤肿瘤细胞的作用[12]。临床上传统TACE术(conventional TACE,cTACE)通常采用碘化油(lipiodol)作为药物载体和微循环临时性栓塞剂。然而大多数化疗药物为水溶性,在碘化油中溶解度极低[13]。行TACE术时需要在使用前将化疗药物溶于水溶液并与碘化油混合形成乳化液[4]。然而一方面此类乳化液稳定性不佳,混合后的乳化液会快速分离,化疗药物被迅速释出,导致化疗药物在肿瘤内的浓度降低,进入体循环增多,进而造成疗效降低、全身副作用增大[14]。另一方面,乳化液内部的化疗药物分布不均匀,使化疗药物在肿瘤内部的分布亦不均衡,从而造成肿瘤坏死的不均匀[4]。目前临床新型栓塞载体材料的研发聚焦于药物洗脱微球(drug eluting beads,DEB),放射性微球(Y90 radiating microspheres)等。这些新型栓塞载体虽然具有全身副作用较轻、或局部肿瘤坏死率高等优势,但仍然存在治疗繁琐,操作复杂,无法避免严重并发症,生存获益未能显著提高等缺陷[15]。因此,进一步研发更加高效安全的TACE载药栓塞剂十分必要。
近年来,GO及其衍生物因其特殊的物理化学性质在疾病诊断、肿瘤治疗、微生物控制等生物医学等领域有广泛研究和应用[16]。GO独特的平面二维结构赋予了其较高的比表面积,而GOV的离域电子使之能通过π-π堆积等作用高效地结合含芳香环结构的药物分子,此外还可根据应用目的,可通过表面修饰使GO具备靶向特异性(targeting)、响应释放(on-demand release)等特殊性质,具备多功能载体平台的能力[17]。堆积然而GO表面含有羧基和羟基等亲水性基团,在碘油中不能稳定分散[7]。因此,课题组考虑通过引入含12或18个碳原子的直链烷基来增加GO的疏水性,使GO-C12或GO-C18能够负载化疗药物的同时在碘油中保持稳定分散。在本课题组的前期研究中[7],GO,GO-C12在水溶液中迅速沉淀,而经直链烷基修饰的GO-C12可以长时间稳定、均匀地分散在碘油中。在本实验中,课题组利用GO表面的羟基/羧基与长链单异氰酸酯的反应,并以π-π堆积将DOX负载至CO上,成功制备并表征了阿霉素负载的直链烷基修饰氧化石墨烯(doxorubicin loaded linear alkyl grafted graphene oxide,DOX@GO-C18),并研究了DOX@CO-C18在碘油中的稳定性。实验表明:DOX@GO-C18经过3 d后仍能在碘油中稳定分散。随后在DOX@GO-C18碘油分散液中加入生理盐水,静置3 d后,DOX@GO-C18仍稳定分散在碘油中,这一结果为稳定地将化疗药物随碘油输送至肿瘤组织中并缓释奠定了基础。
兔VX2肝癌实验动物模型的成功构建通过CT扫描、DSA造影以及后续的病理检查等证实。本研究应用DOX@GO-C18的碘油分散液的有效性及安全性,并以RECIST1.1评价标准评价疗效。结果显示,TACE治疗后肿瘤血供显著减少,术后的CT显示肿瘤周围的肝实质可见少量高密度的碘油分布,病灶中的碘油沉积较为理想,增强扫描未见明显强化,可一定程度上表明活性肿瘤组织减少。对比治疗前后的CT影像,肿瘤最大直径无明显变化,病灶治疗反应为疾病稳定(stable disease,SD)。术后的病理检测证实了DOX@GOC18与碘油分布在肿瘤的末梢血管以及肿瘤组织中。同时利用DOX自发荧光的性质,在荧光图像中观察到在肿瘤的末梢血管以及肿瘤组织中DOX的荧光,碘油、GO-C18、DOX分布的一致性说明DOX@GO-C18能随同碘油进入肿瘤血管及组织间隙及DOX可从从载体上脱落并进入肿瘤中。并且肿瘤实质中可见均质、片状的坏死区域,分布在碘油和DOX@GO-C18周围,证明运用DOX@GO-C18碘油分散液的TACE治疗是有效的,可降低肿瘤负荷,减缓肿瘤生长速率,一定程度上抑制了肿瘤发展。
GO的生物相容性与剂量有着密切关系。多项体内实验表明[18],随着静脉注射剂量增加,GO可在体内引起一定的毒性反应。其主要为肺部的炎症及水肿,局部形成的胶质瘤。在两项涉及新西兰兔的研究中[9,19],静脉中GO类材料的用量分别2.8及3.125 mg/kg,均未能发现明显的生物毒性。在另一项研究中,研究员经动脉注射含GO(3 mg/kg)的药物后,仅在靶器官中发现GO沉积,血清学和病理学检查均未发现明显异常[20]。故我们在实验中采用了较低的1 mg/kg浓度。
即使在cTACE和DEB-TACE治疗中,肝功能损伤也是不可避免的,也是各种TACE技术改进中相关安全性重点关注的问题[21]。因此本研究检测了实验动物TACE术前术后的肝酶学和总胆红素的变化,结果显示术后实验动物出现了肝酶学和胆红素的升高,并在2周后基本恢复正常。另外,术后观察实验动物除一过性食欲下降外,未见出现其他明显不良反应,可见其肝实质损伤是有限并可逆的。本实验结果与既往在DEB-TACE的动物实验中的肝功能变化趋势是类似的[22],说明在适当剂量控制下,GO-C18作为cTACE的药物载体,其安全性是可以接受的。
综上所述,本研究制备并表征了阿霉素负载的直链烷基修饰氧化石墨烯(DOX@GO-C18)。并证明了DOX@GO-C18混合碘油作为TACE栓塞材料具有很高的稳定性。应用DOX@GO-C18对肝癌行TACE治疗后,能够在肿瘤中观察到DOX@GO-C18与碘油沉积,以及DOX的释放,治疗能显著减少肿瘤血供并减缓肝脏肿瘤生长。而术前和术后的血清学检查表明TACE治疗后的肝功能损伤是有限并可逆的,同时未发现严重并发症。本研究结果初步证明了以直链烷基修饰氧化石墨烯作为化疗药物的载体行TACE术治疗肝癌是安全并有效的,为临床改进TACE治疗肝癌疗效提供新的方向与思路。

