吴茱萸次碱通过Sirt1改善血管平滑肌细胞钙化
邵 静,陈 安,张秀丽,杨平珍
(南方医科大学珠江医院心血管内科//珠江医院心脏中心实验室,广东广州510280)
血管钙化(vascular calcification)是钙磷矿物质异常沉积于血管壁的过程,常见于慢性肾病,动脉粥样硬化和糖尿病患者,常导致血管硬度增加,弹性下降和顺应性变差,是心血管疾病的独立危险因素[1-3]。近些年的研究发现血管钙化并非传统认为的钙磷矿物质被动沉积过程,而是受基因主动调控的过程,与骨生成过程相似[4-6]。目前临床尚未有效治疗血管钙化的方法。吴茱萸次碱(rutecarpine,Rut)是从中药吴茱萸中提取的重要生物活性碱,具有抗炎,抗血小板聚集等心血管保护效应。研究表明Rut可抑制血管平滑肌细胞(vascular smooth muscle cells,VSMC)增殖[7],然而Rut是否影响血管平滑肌细胞钙化尚不清楚。Sirtuin-1(Sirt1)是依赖于NAD+的组蛋白去乙酰化酶,属于Sirtuin蛋白家族成员,可抑制血管平滑肌细胞钙化[8]。本研究通过采用血管平滑肌细胞钙化模型,研究Rut抗血管平滑肌细胞钙化的作用及Sirt1分子机制,从而为血管钙化的防治提供实验依据。
1 材料与方法
1.1 主要试剂
细胞培养试剂、TRIzol试剂购自于Life Technology公司;EX-527、Rut、茜素红、β-甘油磷酸(beta-glycerophosphate,BGP)来自Sigma公司;逆转录试剂盒、SYBR green试剂盒购自Takara公司;BCA蛋白定量试剂盒和Western blot发光试剂盒购自于Pierce公司;Sirt1抗体购自于Cell Signaling Technology公司。
1.2 细胞培养
SPF级雄性大鼠(150~180 g)购于南方医科大学实验动物中心,许可证号:SCXK(粤)2016-0041。参照explant方法分离SD大鼠主动脉血管平滑肌细胞[9]。取大鼠主动脉,剔除血管的外层结缔组织,将血管组织切成小块,放入普通培养基(growth medium,GM):含10%FBS的DMEM培养液中,放置37°C含体积分数5%CO2的培育箱培养,每周更换培养液3次。待细胞长满后传代,用钙化培养基(calcifying medium,CM):含10 mmol/L的BGP和3 mmol/L的CaCl2的DMEM培养液诱导细胞钙化[4]。加入不同浓度的Rut(0.5、1和5 μmol/L)和Sirt1抑制剂EX-527(50 μmol/L)处理细胞,观察Rut和抑制Sirt1对细胞钙化的影响。
1.3 细胞钙化检测
采用茜素红(Alizarin Red)染色测定血管平滑肌细胞钙化沉积。去除细胞培养基后,用PBS溶液洗细胞3次,常温下加入40 g/L的甲醛固定液孵育10 min,去除甲醛后加入2%茜素红(pH 4.2)溶液反应5 min,用去离子水清洗残留颜色,相差显微镜镜下拍摄染色的细胞图片。在茜素红染色的细胞中加入10%的甲酸,室温孵育5 min,用分光光度计在波长405 nm处测定样品吸光度OD值。采用邻甲酚酞络合剂(Ocresolphthalein complexone)的方法检测细胞钙离子浓度[10]。
1.4 碱性磷酸酶(Alkaline phosphatase,ALP)活性
用0.1%Triton X-100裂解细胞后提取蛋白,加入BCA试剂测定样品的蛋白含量。将180 μL的 p-nitrophenylphosphate(p-NPP)和 20 μL 的细胞裂解样品混合,于37°C孵育反应15min,然后加入3 mol/L氢氧化钠使反应终止,用分光光度计测定波长405 nm溶液吸光度OD值。
1.5 荧光定量qRT-PCR
参照TRIzol试剂说明书,加入1mL的TRIzol试剂提取VSMC的总RNA。用PrimeScript RT逆转录试剂将1 μg mRNA反转录为cDNA,然后用SYBR green试剂配制成20 μL PCR反应体系,PCR所用的引物如下:β-actin(forward):TGTCACCAACTGGGACGATA,β-actin(reverse):GGGGTGTTGAAGGTCTCAAA;Runx2(forward):GCCGGGAATGATGAGAACTA,Runx2(reverse):GGACCGTCCACTGTCACTTT;BMP2(forward):GTTTGGCCT-GAAGCAGAGAC,BMP2(reverse):CTCGATGGCTTCTTCGTGAT;Osterix(forward):TCTCCATCTGCCTGACTCCT,Osterix(reverse):GGGGCTGAAAGGTCAGTGTA。在StepOne Plus real-time PCR仪上进行荧光定量PCR。以β-actin作为内参基因,采用△△Ct的方法计算目的基因mRNA表达的相对量。
1.6 Western blot检测蛋白的表达水平
加入细胞裂解液(50 mmol/L Tris-HCl,150 mmol/L NaCl,1%NP-40,0.1%SDS)抽提血管平滑肌细胞总蛋白。95°C加热使蛋白充分变性,上样后进行SDS-PAGE胶电泳,将蛋白样品转至PVDF膜,室温下5%脱脂奶粉封闭1 h。加入一抗Sirt1抗体(1∶1 000)4°C过夜孵育,加入二抗室温孵育1 h,PBST洗膜后ECL发光显影。
1.7 统计学处理
计量数据以均数±标准差表示,采用SPSS 17.0软件分析数据,两组间比较采用t检验,两组以上间比较采用单因素方差分析,组间比较采用LSD法。P<0.05为有差异统计学意义。
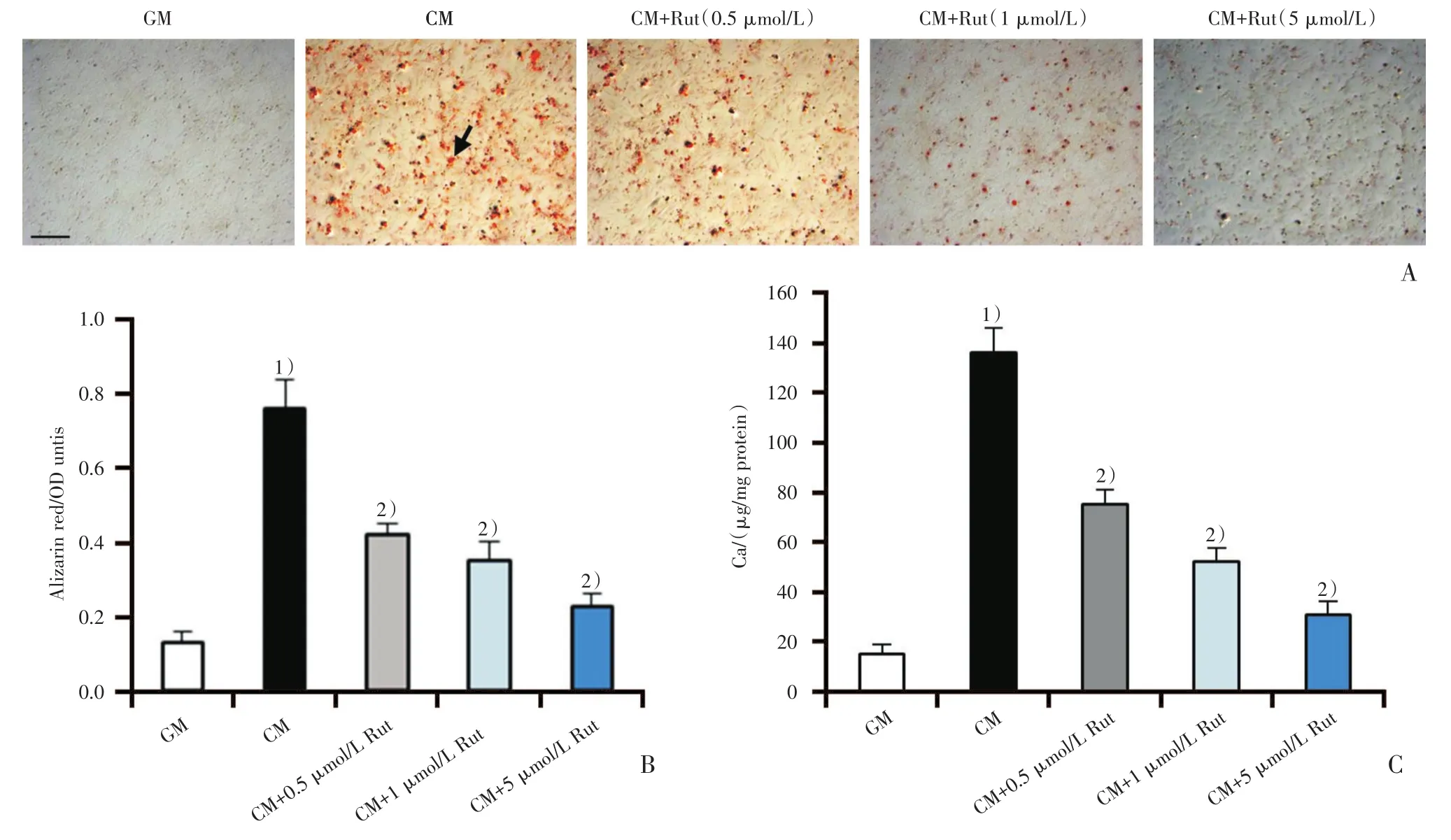
图1 吴茱萸次碱对血管平滑肌细胞钙化的作用Fig.1 Effect of Rut on VSMC calcification
2 结果
2.1 吴茱萸次碱抑制大鼠血管平滑肌细胞钙化
分离SD大鼠主动脉血管平滑肌细胞,采用不同浓度的Rut(0.5、1、5 μmol/L)处理大鼠血管平滑肌细胞8 d,来研究Rut对高磷高钙诱导的VSMC钙化的作用。茜红素染色和定量结果显示:与普通培养基(growth medium,GM)组比较,钙化培养基(calcifying medium,CM)组的血管平滑肌细胞出现明显的钙化沉积(图 1A、B,P <0.05);而不同浓度的 Rut(0.5、1、5 μmol/L)处理细胞后,均能明显地减轻大鼠血管平滑肌细胞钙化沉积(图1A、B;P<0.05)。此外,钙离子浓度定量结果也显示:Rut能剂量依赖性地降低细胞钙离子浓度(图1C;136±10、75±6、52±6、31±5,F=122.28,P < 0.001)。
2.2 吴茱萸次碱抑制血管平滑肌细胞成骨样分化
现已知VSMC成骨样分化在血管钙化过程中发挥了关键作用,因此我们检测了Rut对VSMC成骨样分化的分子标志物ALP,Runx2,BMP2和Osterix表达水平的影响。与GM组比较,CM组的细胞ALP活性明显增高,而使用Rut后能明显降低细胞的ALP活性(图2A;P<0.05)。qRT-PCR结果显示:高磷高钙能上调血管平滑肌细胞Runx2,BMP2和Osterix mRNA的表达水平,而使用Rut处理后可见Runx2,BMP2和Osterix mRNA的表达水平明显下降[图2B;Runx2(2.85±0.25、1.75±0.18、1.62±0.13、1.36±0.16,F=36.865,P < 0.001),BMP2(3.2±0.32、1.85±0.17、1.65±0.15、1.43±0.12,F=4.837,P < 0.001)和Osterix(2.60±0.27、1.82±0.16、1.55±0.15、1.36±0.17,F=23.842,P < 0.001)],说明Rut可抑制VSMC成骨样分化过程。
2.3 吴茱萸次碱上调血管平滑肌细胞Sirt1表达水平
由于Sirt1可抑制血管钙化,我们观察了Rut(5 μmol/L)对高磷高钙诱导的血管平滑肌细胞Sirt1表达水平的影响。qRT-PCR结果显示:高磷高钙可下调血管平滑肌细胞Sirt1 mRNA的表达水平,而Rut可明显地上调Sirt1 mRNA的表达水平(图3A;0.35±0.06、0.75±0.11,F=19.826,P=0.002;0.22±0.08、0.87±0.13,F=29.599,P=0.001)。Western blot结果进一步证实了Rut可显著地上调血管平滑肌细胞Sirt1的蛋白表达水平(图3B;0.38±0.09、0.71±0.13,F=18.006,P=0.003),提示Sirt1的表达上调可能与Rut抑制细胞钙化有关。
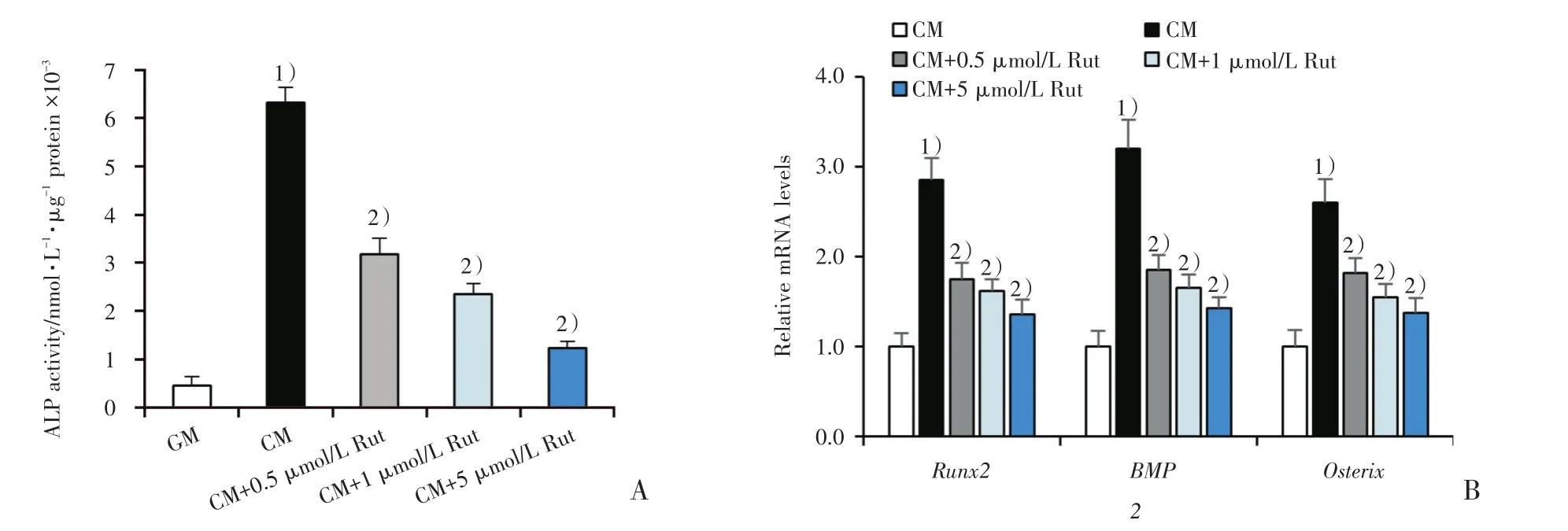
图2 吴茱萸次碱对血管平滑肌细胞成骨样分化的影响Fig.2 Effect of Rut on osteogenic differentiation of VSMC
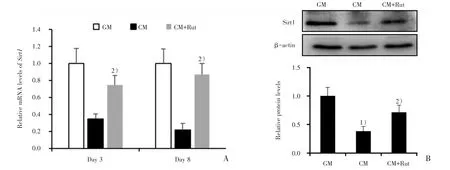
图3 吴茱萸次碱对血管平滑肌细胞Sirt1表达水平的影响Fig.3 Effect of Rut on Sirt1 expression in VSMC
2.4 抑制Sirt1阻断吴茱萸次碱减轻血管平滑肌细胞钙化的作用
为研究Sirt1是否介导了Rut抑制VSMC钙化的作用,我们采用Sirt1抑制剂EX-527(50 μmol/L)处理细胞,观察其对Rut抑制VSMC钙化的影响。结果发现:Sirt1抑制剂EX-527能明显阻断Rut抑制VSMC钙化的作用(图 4A、B;138±13、36±7、87±8,P < 0.05),升高ALP的活性(图4C,P < 0.05),和上调Runx2和BMP2 mRNA的表达水平(图4D;P<0.05)。这些结果均提示Sirt1参与了Rut抑制VSMC钙化的过程。
3 讨论
血管钙化是一种与骨生成类似,受基因调控的生物学过程,其形成机制十分复杂,目前临床上尚缺乏有效的干预方法。本研究发现Rut能剂量依赖性地抑制大鼠VSMC成骨样分化和钙化。另外,我们发现Rut能上调钙化抑制因子Sirt1的表达,抑制Sirt1后可阻断Rut对VSMC成骨样分化和钙化的抑制作用,说明Sirt1参与了Rut抑制VSMC成骨样分化和钙化的过程。
大量研究表明钙磷代谢紊乱是导致血管钙化的危险因素,高磷高钙能促进血管平滑肌细胞钙化,血管平滑肌细胞出现成骨样分化,骨相关蛋白包括Runx2、BMP2、Osterix和ALP 等表达上调[11-13]。本研究也发现:高磷高钙能明显诱导VSMC钙化,上调血管平滑肌细胞Runx2,BMP2和Osterix mRNA的表达水平和提高ALP的活性。Rut是从中药吴茱萸中提取的重要生物活性碱,具有抑制血管平滑肌增殖和动脉粥样硬化的功能[7,14]。在此基础上,本研究观察了Rut对血管平滑肌细胞成骨样表型转化和钙化的作用。我们的研究发现:Rut能明显地抑制血管平滑肌细胞成骨样分化和钙化。
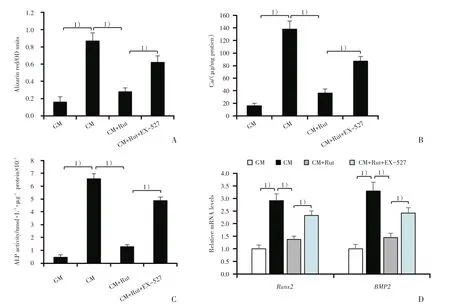
图4 抑制Sirt1对吴茱萸次碱抗平滑肌细胞钙化的影响Fig.4 Effect of Sirt1 inhibition by EX-527 on the role of Rut in VSMC calcification
既往的研究证明:Sirt1可抑制血管平滑肌细胞成骨样分化和血管钙化,高磷刺激血管平滑肌细胞可抑制Sirt1的表达,下调Sirt1可促进血管平滑肌细胞钙化[8]。本研究也发现高磷高钙可明显下调Sirt1的表达水平。另外,我们的研究发现Rut可上调Sirt1的表达水平。使用Sirt1抑制后可阻断Rut抑制血管平滑肌细胞成骨样分化和钙化的作用,说明Rut可通过上调Sirt1的表达水平发挥其抑制血管平滑肌细胞成骨样分化和钙化的作用。
综上所述,本研究发现:高磷高钙可刺激血管平滑肌细胞下调Sirt1的表达水平,促进血管平滑肌细胞成骨样分化和钙化。Rut可通过上调Sirt1的表达,从而抑制血管平滑肌细胞钙化。本研究为血管钙化的防治提供了新的线索,将来的动物实验可望进一步阐明Rut对血管钙化的抑制作用。
——以吴茱萸为例

