肠系膜CTA的影像学表现联合血浆D-二聚体水平变化对缺血性肠病严重程度的诊断价值
王丽娜,柯岩美,宋吉慧,艾琦,徐绍武,王亮亮,王强
缺血性肠病(ischemic bowel disease,IBD)是一组异质性疾病,主要病因是结肠、小肠血液供给不足导致的不同程度的肠壁局部组织缺血、坏死,并最终由此引起一系列临床表现[1]。IBD的常见临床症状多为腹痛,伴有恶心、呕吐及便血等,其特点是起病急,病情发展迅速,缺乏特异性临床表现,早期诊断困难,预后常较差,且病死率较高[2]。因此,对于此病的发病原因及严重程度的诊断十分重要。目前,国内外对IBD报道较多的检查主要集中于内镜、CTA、介入造影[3-5]和实验室检查的D-二聚体、白细胞[6]等单方面,但对于利用IBD的CTA影像表现联合血浆D-二聚体的变化研究,并对其严重程度的诊断研究缺乏相关报道。现将我院收集2015年1月至2016年12月间的临床疑似为IBD的48例患者的资料进行回顾性分析,评估肠系膜CTA影像表现联合血浆D-二聚体水平变化在IBD严重程度的诊断价值,旨在为临床早期诊断及治疗IBD提供科学依据。
1 资料与方法
1.1 一般资料
回顾性分析2015年1月至2016年12月本院就诊的IBD的患者共48例,其中男26例,女22例,年龄23~82岁,平均(68.4±13.2)岁,均行肠系膜CTA扫描及血浆D-二聚体检查,并均经肠镜检查或手术确诊。患者临床主诉均以腹痛就诊,其中合并腹泻20例,黏液血便14例,恶心呕吐36例,不全肠梗阻2例。患者中38例有基础疾病,其中高血压26例,冠心病12例,糖尿病9例,直肠癌术后3例,腹主动脉支架术后2例,心脏瓣膜置换术后1例。
1.2 检查方法
1.2.1 CT扫描 采用德国西门子128层螺旋CT机,进行全腹部平扫及CT血管成像(CT angiography,CTA)扫描,扫描参数:管电压120 kV,管电流200 mAs,层厚5 mm,重建层厚1.25 mm、层间距1.25 mm,螺距0.16~0.2,矩阵512×512。患者取仰卧位,扫描范围为自膈顶至耻骨联合,先行CT平扫,然后采用高压注射器经肘静脉注射非离子型对比剂优维显注射液(300 mgl/mL),流速3.5 mL/s,剂量75~100 mL进行增强扫描。将获得的平扫及增强后图像传至Syngovia工作站进行动脉期肠系膜动脉成像后处理。
1.2.2 血浆D-二聚体测量方法 所有患者入院时抽取静脉血3 mL,送至本医院检验科检测,部分患者经治疗后进行复查。
1.2.3 图像评价 由两位有经验的放射科医师共同对所获得的CT原始和重建图像进行回顾性读片,运用多平面重组(multiple planar reconstruction,MPR)、曲面重建(curved planar reformation,CPR)、容积成像(volume rendering,VR)及最大密度投影(maximum intensity projection,MIP)等多种后处理软件结合横断面CT图像进行分析和评价。主要观察肠系膜血管的形态、走形及分布,观察血栓的位置和范围,观察受累肠管的厚度、密度及增强后的强化程度,肠壁及门脉积气,肠系膜水肿积液,腹水等影像学表现。
1.2.4 IBD的肠系膜CTA表现分类 包括直接征象和间接征象。直接征象包括肠系膜血栓和肠系膜动脉硬化;间接征象包括肠壁厚度的改变、肠管密度的改变、肠壁强化程度的改变、肠壁内积气及门静脉积气及肠系膜水肿积液,腹水等其它征象。
1.2.5 判断标准 肠壁厚度的改变,正常情况下小肠肠壁的壁厚>3 mm,缺血时肠壁厚度可增厚或变薄。可逆性肠缺血时肠壁增厚,不可逆性肠缺血时肠壁变薄。结肠肠壁的厚度>5 mm时可以诊断为肠壁增厚[7]。肠管密度的改变,以正常肠壁为参考[8]。肠壁强化程度的改变,增强后肠壁≥静脉的CT值显著强化[8]。肠壁内积气及门静脉积气,表现为肠壁或门脉内孤立的气泡影或带状气体影,是不可逆性肠缺血的一个标志诊断,对坏死肠管的诊断有重要价值[9]。
1.3 统计分析
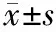
2 结果
2.1 IBD的肠系膜CTA的直接征象及血浆D-二聚体相关水平的比较
肠系膜动脉血栓在CTA显示为肠系膜血管内的充盈缺损征象(14例),D-二聚体均值为(3 795±932) μg/L,肠系膜动脉血管硬化性狭窄在CTA上显示为相应血管的管壁软硬斑块形成(30例),本组CTA显示阳性率为83%,血浆D-二聚体均值为(1 487±870) μg/L。两组间差异有统计学意义(P<0.05)。见表1,图1。
图1IBD的肠系膜CTA的直接征象 1A:VR成像显示SMA中远段栓塞;1B:MIP成像显示SMA中远段栓塞
2.2 IBD的肠系膜CTA的间接征象及血浆D-二聚体相关水平比较
肠壁增厚22例,变薄13例,血浆D-二聚体均值分别为(1 632±948) μg/L和(5 088±848) μg/L,两组间差异有统计学意义(P<0.05),见图2A、2B。肠壁充血或出血时密度增高14例,肠水肿时肠管密度减低21例,血浆D-二聚体均值分别为(1 896±798) μg/L和(1 741±881) μg/L。两组间差异无统计学意义(P>0.05),见图2A、2E。肠系膜充血时肠壁明显强化14例,当肠壁血流灌注减低或中断时肠壁强化减弱或不强化13例,血浆D-二聚体均值分别为(1 690±986) μg/L和(5 254±1 033) μg/L,两组间差异有统计学意义(P<0.05),见图2C、2D。肠壁内积气及门静脉积气12例,其血浆D-二聚体均值为(6 090±551) μg/L,见图2F。肠系膜水肿积液或腹水等20例,表现肠系膜密度均匀增高,腹腔积液征象,血浆D-二聚体均值为(2 237±642) μg/L,见图2E。
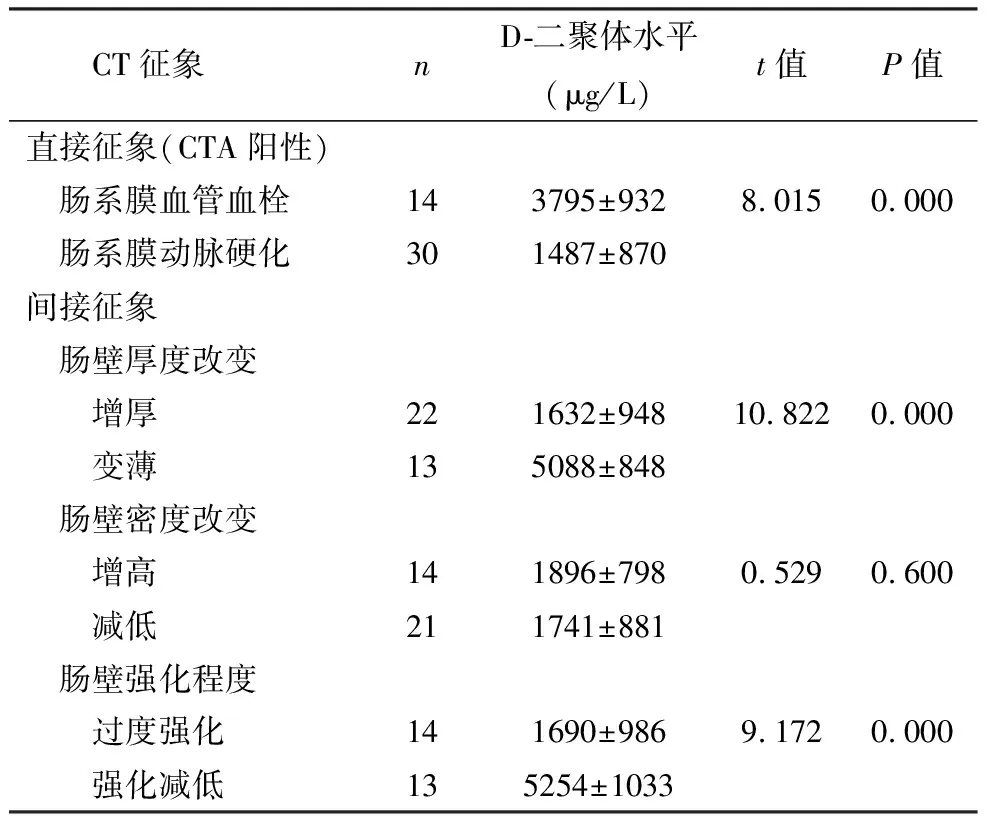
表1 IBD肠系膜CTA的影像学征象与血浆D-二聚体水平相关指标比较
3 讨论
IBD属于消化内科疾病的一种,该病在20世纪60年代首次被提出[10],肠管的血液供应来自于腹腔干动脉、肠系膜上动脉及肠系膜下动脉,各动脉之间通过边缘动脉弓形成广泛的吻合。当肠系膜血流量锐减,肠道接受的氧和血流不能满足正常动能和代谢的需要时引起IBD[11]。肠缺血根据病理分为三期;一期为可逆性结肠炎,表现为局限在粘膜层的坏死、腐蚀和溃疡样变,可自愈。二期肠壁损害达粘膜下层和肌层,可出现局部纤维性狭窄。三期全层肠壁结构的坏死,死亡率高,必须及时手术治疗[12]。王豪杰等[13]研究认为,IBD的治疗需要结合肠系膜的CTA影像特点进行。而准确判断缺血肠管的范围和肠管是否具有活力,是决定术式和切除范围以及影响病人预后的重要指标[14]。近年来,随着生活方式的改变和社会人口老龄化加剧,IBD的发病率呈逐年上升高趋势[15]。警惕IBD的可能性,明确IBD的严重程度,做到早期诊断和对症治疗具有重要意义。
血浆D-二聚体是已交联纤维蛋白的降解产物,其生成或增高反映了凝血和纤溶系统的激活,其血浆中水平可代表体内酶活性及纤维蛋白生成情况,可作为体内血栓形成的指标之一[16]。已有相关文献证实,血浆D-二聚体水平可作为诊断IBD的手段之一[17]。本研究对IBD患者的肠系膜CTA影像学特点进行了分析,结果显示,CTA上显示的直接征象上为肠系膜血管出现充盈缺损及动脉硬化所导致的的管腔狭窄征象,间接征象为出现肠壁厚度的改变、肠壁密度的改变,肠壁强化程度的改变、肠壁或门脉积气及肠系膜水肿积液、腹水等其它征象。这可能是因为多层螺旋CT的图像重建可以从不同角度观察病变,其中MPR可以冠状位、矢状位等多平面显示肠系膜血管正常解剖及病变,且对肠系膜血管的狭窄病变、血管壁光滑、血栓的诊断更有价值。MIP对肠系膜血管的分支显示有效。VR可通过颜色差异显示密度不同的组织和脏器,有利于显示肠系膜血管与周围组织的三围立体关系,并且有利于显示分支血管[18]。笔者认为,可以将多层螺旋CT及其后处理技术作为临床对急腹症IBD诊断的首选方法,可能具有较高的诊断价值[14]。

图2IBD的肠系膜CTA的间接征象 2A:显示肠管管壁增厚,密度减低; 2B:显示肠管管壁变薄,肠腔扩张积气;2C:CT增强扫描显示肠壁强化程度减低; 2D:CT增强扫描显示肠壁强化程度增高;2E:显示局部肠管管壁密度增高; 2F:显示肠壁下小气泡影
国内曹春宇[16]等人研究认为,联合应用血浆D-二聚体检测和螺旋CT血管造影诊断IBD具有较高的灵敏度和特异度。本研究进一步分析了多层螺旋CT及后处理技术所显示的IBD患者的不同影像表现与血浆D-二聚体水平。结果表明,肠系膜CTA影像的直接征象中显示,肠系膜有动脉血栓的患者,其血浆D-二聚体水平显著高于肠系膜有动脉血管硬化性狭窄的患者,即当肠系膜血管内出现充盈缺损征象时体内有血栓形成及溶解,其血浆D-二聚体水平将明显升高。而在间接征象中,血浆D-二聚体水平与肠壁厚度及强化程度显著有关,表现为肠壁变薄或强化程度减弱时血浆D-二聚体的均值都高于5000μg/L;而肠壁变厚或强化程度增强时血浆D-二聚体均值约为1500μg/L。但肠壁密度变化并不影响血浆D-二聚体水平。可能是因为肠壁的厚度及强化程度变化是不可逆性的,而肠壁密度的改变具有可逆性[19]。刘玉峰[20]等的研究也证实血浆D-二聚体对判断缺血性结肠炎病情严重程度有较好的早期诊断价值,与本研究结果相似。
笔者建议,对于临床可疑IBD患者,在排除其他引起血浆D-二聚体值升高的基础疾病后,当血浆D-二聚体值达到5000 μg/L时,应及早进行CTA检查。当发现肠系膜动脉内血栓、肠壁变薄、强化程度减弱、肠壁内积气等不可逆性肠缺血表现时,建议尽早制定有效的外科手术方案。而当血浆D-二聚体均值为1500 μg/L左右时,肠系膜CTA的影像学表现上出现肠壁变厚、强化程度增强、肠壁密度增高或减弱,肠系膜水肿、腹水等可逆性表现时,建议临床进行内科保守治疗,但应密切监察患者的血浆D-二聚体的变化及临床表现。不
综上所述,肠系膜CTA的影像表现联合血浆D-二聚体的水平改变可以有效的判断IBD的严重程度,为临床早期诊断及治疗提供科学依据。

