高机械指数超声辐照微泡对结肠癌细胞影响的体外实验研究
宋丹琳,郑静,孔健,李明伟,王洋,张海
结肠癌是临床常见恶性肿瘤,GLOBOCAN估计我国男性、女性的结直肠癌发病率分别为16.9/10万、11.6/10万,死亡率分别为9.0/10万、6.1/10万[1]。远处转移是导致结肠癌高死亡率的主要原因之一[2],肿瘤细胞的远处转移涉及侵袭及迁移能力的改变[3],且与细胞骨架的形态分布密切相关[4]。近年报道显示超声辐照技术能够提高结肠癌药物治疗效果[5],但针对性分析超声辐照技术对结肠癌细胞骨架及侵袭、迁移能力影响的报道较少,本研究以结肠癌Lovo细胞为对象,拟重点探讨高机械指数超声辐照微泡对结肠癌细胞骨架及侵袭、迁移能力的影响,报道如下。
1 材料与方法
1.1 材料、试剂及仪器
实验材料:结肠癌Lovo细胞株,购自中科院上海生命科学研究院。主要试剂:DMEM培养基,购自美国Gibco;胎牛血清,购自杭州四季青;Hank液及胰蛋白酶、四甲基偶氮唑盐(methyl thiazolyl tetrazolium, MTT),购自美国Sigma;声诺维造影剂,购自意大利Bracco;mytomycin C,购自美国selleck;Transwell小室,购自美国BD。主要仪器:Vivid 5型彩色多普勒超声仪,购自美国GE;TCS-SP5激光共聚焦显微镜,购自德国Leica;BV51荧光显微镜,购自日本Olympas。
1.2 实验方法
1.2.1 细胞培养 从液氮中取出Lovo细胞,复苏,用含10%胎牛血清的DMEM培养基常规培养,培养条件为37 ℃、5%CO2、100%饱和湿度。隔天传代1次,达到对数生长期后,用0.25%胰蛋白酶消化,制备为2×105个/mL单细胞悬液。
1.2.2 分组方法 拟将细胞分为空白对照组、超声辐照组、微泡组及超声辐照+微泡组,开展对照研究。
1.2.3 细胞迁移能力检测 以每孔5×105/个细胞的密度,将Lovo细胞接种于6孔培养板,待细胞贴壁后加入S期细胞周期阻滞剂mytomycin C,预处理1 h以抑制细胞生长。以10 μL移液枪头在每个培养孔内划一条直线,PBS洗去划下的细胞,随后加入无血清DMEM培养基(空白对照组及超声辐照组)或50 μL/mL声诺维含药无血清DEME培养基(超声辐照+微泡组及微泡组),每组3孔。需要超声辐照的两组,调节超声探头频率为1.5 MHz,机械指数1.7,显像深度4 cm,用医用胶带将探头环形缠绕,呈现一凹槽,在凹槽中加入耦合剂,使培养板与耦合剂充分接触,超声辐照6 s,间歇6 s,共20次。继续培养,显微镜下观察24 h各组细胞划痕愈合情况,以Image-Pro Plus 6.0计算划痕愈合率。
1.2.4 细胞侵袭能力检测 在24孔板中加入600 μL含20%胎牛血清的DEME培养基,将Transwell小室放入24孔培养板中,在培养孔中按分组要求加入无血清DMEM培养基(空白对照组及超声辐照组)或50 μL/mL声诺维含药无血清DEME培养基(超声辐照+微泡组及微泡组),每组3孔,然后将250 μL细胞悬液加入至Transwell小室中。需要超声辐照的两组参考细胞迁移能力检测部分进行超声辐照。继续培养24 h,以棉签拭去小室内底部未迁移的细胞,4%甲醛固定小室外底部的细胞,染色后,观察各组细胞穿过小室的细胞数目,取5个高倍镜视野细胞数的均值。
1.2.5 细胞骨架形态检测 在细胞复苏培养时,参考细胞迁移能力检测部分进行相关分组处理,待达到对数生长期后,用PBS漂洗,0.25%胰酶消化,制备为1×105个/mL单细胞悬液,以每孔2×105/个细胞的密度加入预先加有盖玻片的6孔细胞培养板中,每组6孔,其中3孔用于检测细胞微丝,3孔用于检测细胞微管,24~48 h后,取出细胞爬片。用于细胞微管检测的爬片,PBS洗2~3次,2%多聚甲醛固定20 min,再以0.5% Triton X-100+PBS洗3次,每次5 min;随后加入山羊血清,封闭30 min,再以0.5% Triton X-100+PBS洗3次,每次5 min;随后加入鼠抗人β-tubulin单克隆抗体为一抗,37 ℃下孵育90 min,在以0.5% Triton X-100+PBS洗3次,每次5 min;添加FITC标记的二抗,室温孵育90 min,再以PBS洗3次,每次5 min;最后以缓冲甘油封片,镜下观察。用于细胞微丝观察的爬片,1×PBS漂洗3次,每次5 min,2%多聚甲醛固定20 min,再以PBS洗3次,每次5 min;再以0.5% Triton X-100+PBS洗3次,每次5 min;随后将爬片置于湿盒内,加入5 μg/mL FITC-phallodin,37 ℃孵育30 min,PBS洗4次,每次5 min;最后以缓冲甘油封片,镜下观察。
1.3 统计学方法
2 结果
2.1 四组细胞迁移及侵袭能力对比
细胞划痕实验显示超声辐照+微泡组划痕愈合率明显低于其它三组(P<0.05),超声辐照组、微泡组及空白对照组划痕愈合率对比,差异无统计学意义(P>0.05);Transwell细胞侵袭实验显示超声辐照+微泡组细胞侵袭数目明显低于其它三组(P<0.05),超声辐照组、微泡组及空白对照组细胞侵袭数目对比,差异无统计学意义(P>0.05),见表1、图1、图2。

表1 四组细胞迁移及侵袭能力对比
注:*与超声辐照+微泡组对比,P< 0.05
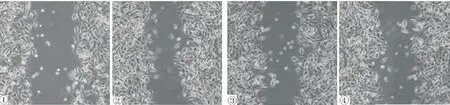
图1 四组细胞划痕愈合结果 ①超声辐照+微泡组;②超声辐照组;③微泡组;④空白对照组
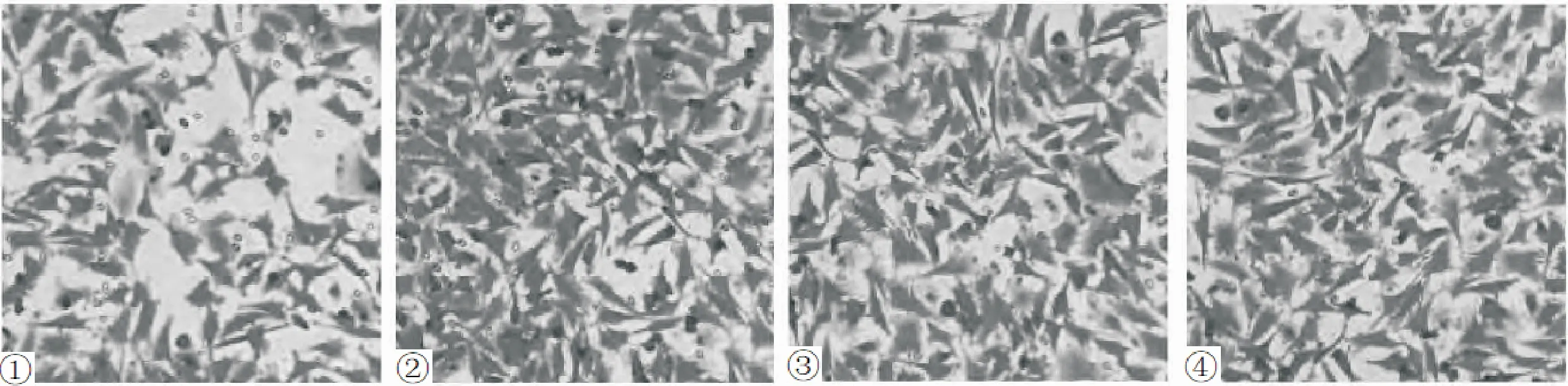
图2四组细胞Tranwell侵袭实验结果 ①超声辐照+微泡组;②超声辐照组;③微泡组;④空白对照组
2.2 四组细胞微管、微丝结构对比
超声辐照组、微泡组、空白对照组微管染色表现均呈细胞致密的丝状网络结构,放射性延伸至细胞边缘;超声辐照+微泡组丝状网络结构稀疏,主要沿细胞长轴排列,见图3;超声辐照组、微泡组、空白对照组微丝染色均呈细胞致密网络状细丝结构,向四周伸出大量短小的毛刺状突起,呈拉丝状,有明显的方向型;超声辐照+微泡组细胞质中部细丝明显减少,荧光暗淡,未构成明显的网络状,周边毛刺状突起减少,见图4。

图3 四组细胞微管结构对比 ①:超声辐照+微泡组;②:超声辐照组;③微泡组;④空白对照组

图4 四组细胞微丝结构对比 ①:超声辐照+微泡组;②:超声辐照组;③微泡组;④空白对照组
3 讨论
侵袭和迁移是结肠癌威胁患者生命安全的主要原因,多数结肠癌患者在确诊时已出现远处转移,即便早期结肠癌患者能够及时接受手术治疗,其中大部分仍死于远处转移[6-7]。抑制肿瘤细胞的侵袭和迁移,对提升患者预后有一定价值[8-9]。
细胞骨架结构与细胞侵袭和迁移密切相关,细胞骨架主要由微管、微丝及中间纤维构成[10-11]。其中微丝主要由肌动蛋白构成,在细胞的变形运动中起关键作用[12]:微丝纤维生长,使细胞表面突出,形成片足,并在片组与基质接触的位置形成粘着斑,随后在肌动蛋白的作用下微丝纤维滑动,使细胞主体前移,同时解除细胞后方的粘着点,循环往复,使细胞向前移动;微管不仅对维持细胞形态、细胞分裂、信号传导及物质输送中有重要作用,且在肿瘤细胞分裂过程中存在微管动力学改变现象,同时微管动力学改变与染色体结构不稳定有关[13]。可见,微管及微丝形态与肿瘤侵袭及迁移能力密切相关。
本研究显示空白对照组Lovo细胞中微管及微丝均存在聚集、重排现象,微丝向四周伸出大量短小的毛刺状突起,有利于其运动与侵袭,与既往研究[14-15]结论一致。而本研究发现高机械指数超声辐照微泡能够降低微管和微丝表达轻度,使微管主要沿细胞长轴排列,并减少微丝的毛刺状突起,这说明超声辐照微泡能够改变微管的组装与分布,影响肌动蛋白应力纤维束的形成及粘着斑的合成与分布,从而改变Lovo细胞的侵袭和迁移能力,与钟华等[16]观察结果类似,杨名珍等[17]针对肺癌的研究也提示超声辐照能够改变肿瘤细胞的骨架。超声辐照对肿瘤骨架的影响,主要得益于其空化效应[18-19]:微泡在超声场的作用下,振动、生长并不断聚集声场能量,当能量超过某个阈值时,微泡急剧崩溃闭合,产生冲击破,破坏细胞的正常结构。
本研究通过细胞划痕实验和Transwell侵袭实验直接观察四组细胞的迁移及侵袭能力,显示超声辐照+微泡组细胞迁移及侵袭能力明显下降,而单纯应用超声辐照或微泡,不会发生上述改变,与针对前列腺癌细胞PC-3的研究[20]结论相似,提示超声辐照微泡形成的空化效应能够抑制结肠癌转移,其机制可能主要与超声辐照微泡对肿瘤骨架的影响有关,这为结肠癌的靶向性治疗提供了一定参考,即可能通过局部高机械指数超声辐照微泡强化结肠癌的治疗效果,但尚需临床研究证实。
综上,高机械指数超声辐照微泡能够抑制结肠癌Lovo细胞的侵袭及迁移能力,这可能与其能够破坏Lovo细胞骨架结构有关。

