分泌酶抑制剂对乏氧环境下骨肉瘤细胞增殖及侵袭力影响的实验研究
王淼 袁冰 刘平 李贺伟 刘洋 邹利军 郭朗
骨肉瘤好发于青少年,是最常见的恶性骨肿瘤[1],其恶性程度高,复发或转移是骨肉瘤患者死亡的最主要原因[2]。因此研究新型、高效、低毒的抗肿瘤药物,对改善骨肉瘤患者的预后具有重要的意义,现已成为骨肉瘤治疗研究的重点之一[3]。肿瘤组织具有缺血、缺氧的病理生理特点,目前普遍认为肿瘤缺氧与其侵袭转移特性密切相关[4]。缺氧诱导因子(hypoxia inducible factor, HIF)在肿瘤缺氧应答体系中居于核心调控位置[5],而针对细胞缺氧反应最重要的介质是缺氧诱导因子HIF-1。Zanotti S 等[6]研究证实骨肉瘤细胞的增殖及分化主要由Notch1 信号通路激活所致,并且其调控骨肉瘤干细胞更新、分化、存活及增殖。Notch1 通路的激活可调控下游靶基因,对骨肿瘤细胞增殖及分化具有重要作用[7]。HIF-1 与Notch1 通路在乏氧微环境中关系较密切,乏氧环境下HIF-1 表达上调并促进Notch1 的表达,同时诱导增殖、侵袭及引起分化阻滞等[8-9]。Hes-1 是胚胎发育过程中的转录抑制因子,它可以调节祖细胞的功能,而Notch1转录因子是促进Hes-1 基因表达的主要激活剂,在缺氧环境下已经证明了Notch1的表达上调能诱导Hes-1的表达,Notch-1通路在多种细胞中主要通过Hes-1 发挥作用[10]。本研究通过体外试验探讨在乏氧微环境下阻断Notch1 通路对骨肉瘤细胞生物学行为的影响,旨在为临床治疗骨肉瘤提供新的思路和依据。
1 材料与方法
1.1 实验细胞
骨肉瘤细胞系MG-63 购自中国典型培养物保藏中心。采用体外分离培养获取后细胞培养至第3 代时选取状态较好的细胞进行实验。
1.2 主要试剂
细胞培养主要试剂:二甲基亚砜(dimethyl sulfoxide,DMSO)(Sigma 公司,美国);MEM(Hyclone 公司,美国);100 U/mL 青霉素、100 pg/mL 链霉素(Hyclone 公司,美国);胎牛血清(fetal bovine serum,FBS)购自Sciencell公司;胰蛋白酶(Trypsin)购自原培生物制品有限公司;磷酸缓冲盐溶液(phosphate buffered saline,PBS)(Hyclone 公司,美国);Transwell 小室(Corning 公司,美国);台盼蓝(Sigma 公司,美国)。
1.3 实验方法
1.3.1 细胞培养及处理
骨肉瘤细胞株MG-63 均培养于37℃、5%CO2培养箱的环境中。培养细胞所用完全培养基为MEM(含有10%的胎牛血清,100 U/mL 的青霉素、链霉素)。细胞每3 天换一次液,取对数期细胞用于实验,将其分为3 种不同药物浓度梯度的处理组。每组在不同实验条件下分别按不同时间点24 h、48 h、72 h 进行检测。最终确定的乏氧模型组以37℃、CO2浓度为5%、O2浓度为1%的培养箱处理48 h 为主,并提取蛋白质。
1.3.2 实验分组
将骨肉瘤细胞株MG-63 细胞置于乏氧(37℃,1%O2,5%CO2)环境下培养作为乏氧组,以正常氧环境(37℃,21%O2,5%CO2)下培养作为正常组,培养24h、48h、72h,组别分为乏氧组、正常组和含有DAPT 的乏氧组(实验组),其中DAPT 的浓度分别为1 M、5 M、10 M。
1.3.3 细胞增殖抑制率检测
采用CCK-8 方法检测细胞的增殖能力,评估细胞生长抑制情况,每组实验重复3 次,以550 nm 和750 nm 分别作为检测波长和参照波长测定各孔光密度值(OD 值),每组细胞增殖抑制率(%)=(1-加药孔平均OD 值/对照孔平均OD 值)×100%。IC50 值,即细胞增殖受抑制后所剩数目与全部细胞数之比等于50%时所对应的浓度。采用SPSS 11.5 软件进行计算,并且将该IC50 值作为后续实验浓度。
1.3.4 细胞转移实验
按照9∶1 的体积比用无血清培养基稀释ECM 胶后,以每孔50 L 的体积加到Transwell 小室的上室,并放入细胞培养箱孵育4 h。待孵育完毕后,小心吸弃上室因为ECM 胶凝固而析出的液体之后,每孔再加入200 L 无血清培养基于37℃环境下水化30 min。小心移弃上室水化培养基,离心收集消化下来的已处理的细胞,用无血清培养基重悬并调整细胞浓度至3×105/mL,于上室中加入200 L 含有细胞的悬液,下室中加入预先配好的包含30%FBS 浓度的培养基。培养48 h 以后,取出小室,用多聚甲醛固定细胞后洗净再用结晶紫进行染色,在用棉签仔细擦去上室细胞后,于显微镜下分9 个视野逐一观察小室下室穿过的细胞数目并拍照用于进一步的分析。
1.3.5 细胞周期及凋亡
细胞处理完成后,用于检测周期的细胞用0.25%的胰蛋白酶消化收集以后离心,PBS 反复清洗2 次以后用预冷的浓度为70%的乙醇固定并于冰箱内过夜。用于检测凋亡的细胞消化后和培养基上清混合再常规离心进行收集。固定好的细胞进行离心后吸弃上清并再用PBS 清洗2 次以后,用160 L PBS 重悬细胞并加入20 L 浓度为50 g/mL 的PI 以及20 L浓度为25 g/mL 的RNase-A 避光条件下37℃孵育15 min。用于检测凋亡的细胞则用500 L 缓冲液重悬,调整细胞浓度至1×106/mL,然后加入5 L AnnexinV-FITC 以及10 L PI(20 g/mL)4℃条件下孵育15 min。最后把处理好的细胞混匀后移到流式管内,用流式细胞仪进行检测。检测结束后用Flowjo 软件分析统计数据,所有试验独立重复3 次。
1.3.6 细胞样本蛋白提取
首先,用无菌PBS 反复漂洗细胞3 遍,向样本中加入适量的含有1%浓度PMSF 的RIPA 强裂解液,将细胞样本充分吹打洗刮后置于冰上15 min。收集混合液于1.5 mL EP管后用超声细胞破碎仪破碎2 次,每次2 s。再将EP 管置于已经预冷至4℃的低温高速离心机中进行离心(12 000 rpm,10 min)。离心完成后小心转移上清至另一个1.5 mL EP 管中,随后用蛋白定量试剂盒对所提取蛋白质的蛋白浓度进行检测。最后,向所得蛋白中加入1/4 蛋白体积的上样缓冲液并煮沸10 min 使蛋白质完全变性。
1.3.7 蛋白印迹实验测相关蛋白的表达
转膜完毕后,打开转膜夹放入用TBST 配制的5%脱脂牛奶内进行封闭,并放置于摇床1 h。取出PVDF 膜,用TBST 洗涤1 遍,并按照抗体说明书上的建议稀释比例用一抗稀释液配制一抗,将配好的抗体滴加一抗孵育盒内以覆盖住有目的蛋白面为宜,将一抗孵育盒置于冰箱内4℃孵育过夜。孵育完毕后,取出一抗中的PVDF 膜,放入TBST 内并置于摇床上,漂洗15 min 重复3 次,并回收一抗。按照二抗说明书上的建议比例用用TBST 配制的5%脱脂牛奶配制二抗,并将二抗孵育盒置于摇床上混匀,待PVDF 膜洗涤完毕,将条带放置在二抗中孵育1 h。1 h 后取出PVDF 膜,再放入TEST 内摇床上漂洗15 min,重复3 次。最后按照1:1 的比例制备ECL AB 发光液,对PVDF 膜进行曝光,检测目的条带。
1.4 统计学方法
采用SPSS 11.5 软件进行统计学分析,计量资料用均数±标准差表示;采用One-way ANOVA 分析和t 检验;P<0.05表示差异有统计学意义。
2 结果
2.1 乏氧环境下及DAPT 介导Notch 下调抑制骨肉瘤细胞促增殖及周期的影响
CCK-8 法检测结果显示如图(见图1),表明乏氧状态下能促进骨肿瘤细胞MG-63 增殖,12 h 后随着时间延长,乏氧的促进增殖作用明显增加,在48 h 常氧及乏氧对细胞增殖的作用可见明显差异;MG-63 细胞经过DAPT 下调Notch1 表达后置入乏氧环境下孵育72 h,细胞增殖作用明显下降,在作用48 h 后MG-63 细胞增殖显著减慢,证明DAPT 确能通过Notch1 通路来抑制MG-63 细胞的增殖。流式细胞仪检测MG-63 细胞在乏氧状态下72 h 的细胞周期分布情况(见图2),与正常组相比,乏氧组G0/G1 期细胞较正常组明显减少,差异具有统计学意义;MG-63 细胞经过DAPT 下调Notch1 表达后置入乏氧环境下孵育72 h,细胞周期分布发生变化,与正常组相比,乏氧能明显促进细胞向G2 期转化,促进细胞增殖,而实验组呈G0 期阻滞。
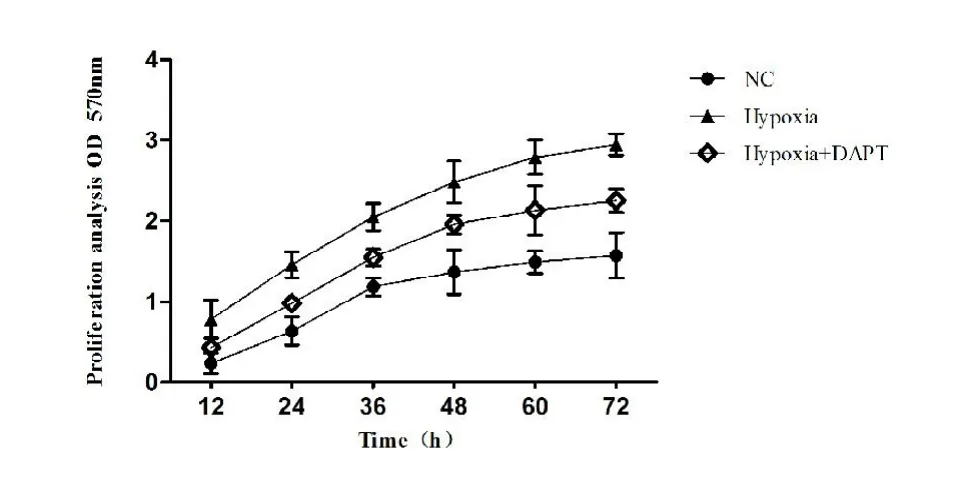
图1 CCK-8 法检测细胞增殖(图中NC为正常组、Hypoxia为乏氧组、Hypoxia+DAPT 为实验组)
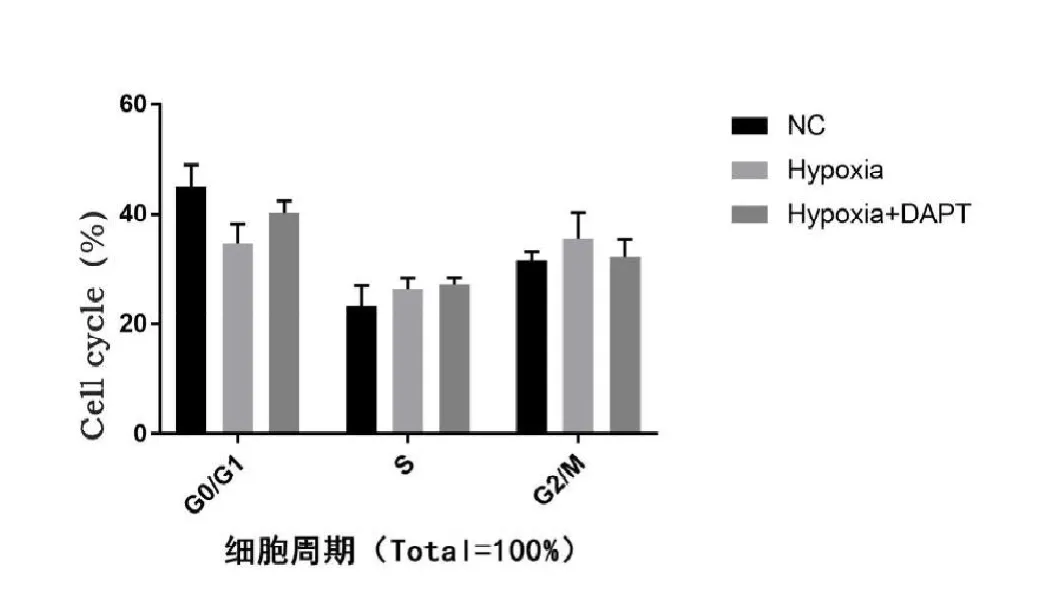
图2 流式细胞仪检测MG-63 细胞在乏氧状态下72 h 的细胞周期分布情况(图中NC 为正常组、Hypoxia 为乏氧组、Hypoxia+DAPT 为实验组)
2.2 乏氧环境下及DAPT 介导Notch 下调乏氧环境下对MG-63 细胞转移的影响
参照Transwell 小室说明书,同步化处理正常组与乏氧组的细胞,倒置显微镜下观察并进行穿膜细胞计数。Transwell实验结果如图3 显示,乏氧组比正常组在单位视野下,48 h内细胞穿膜数量增多。实验组比乏氧组在单位视野下,48 h内细胞穿膜数量减少。
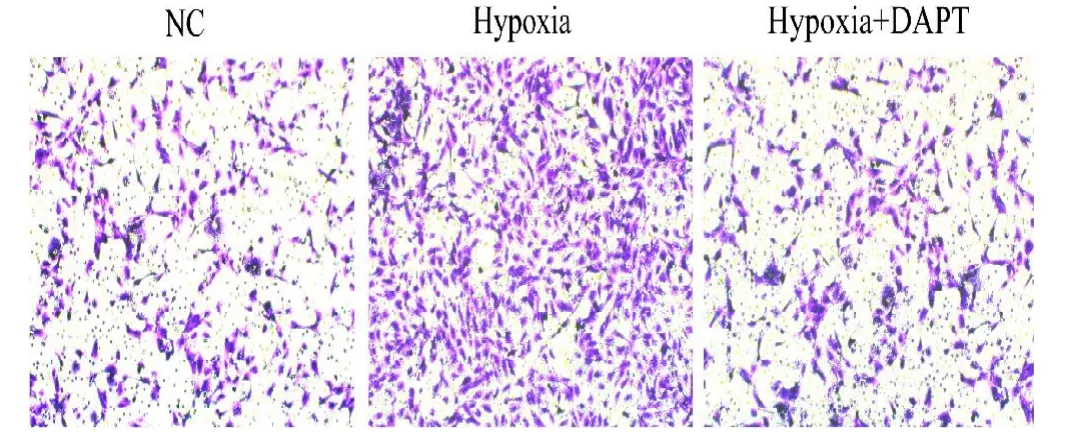
图3 Transwell 实验显示48 h 内细胞穿膜数量来验证其转移能力(×400 倍,图中NC 为正常组、Hypoxia 为乏氧组、Hypoxia+DAPT 为实验组)
2.3 乏氧环境能调节骨肉瘤细胞的相关蛋白的改变
Western Blot 检测乏氧环境下HIF-1 的表达明显上调。乏氧状态下乏氧组与正常组MG-63 细胞相比,HIF-1 下游的Notch1、Hes-1 蛋白表达情况如图4 所示,蛋白表达增强且呈时间依耐性(见图4)。
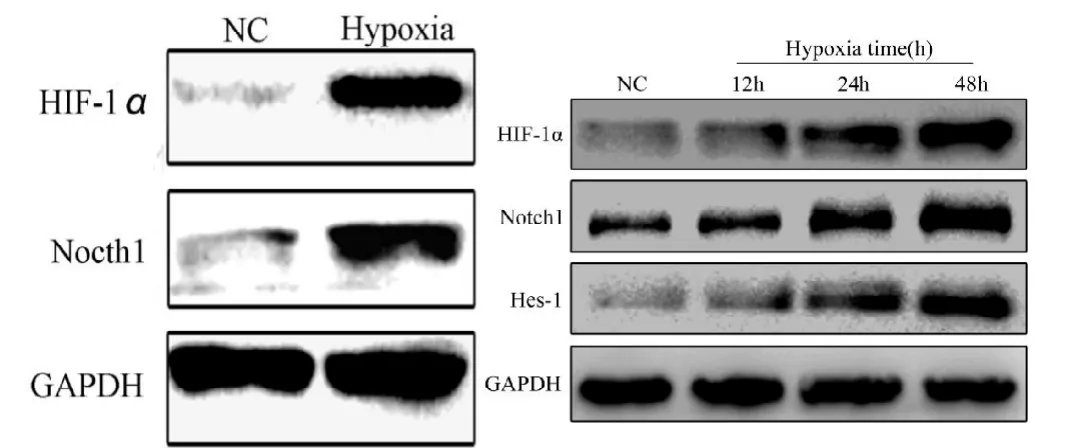
图4 乏氧状态下乏氧组与正常组MG-63 细胞相比,HIF-1 下游的Notch1、Hes-1 蛋白表达情况(图中NC为正常组、Hypoxia 为乏氧组)
2.4 乏氧环境下DAPT阻断Notch1 通路对骨肉瘤细胞的Notch蛋白表达影响
Western Blot 检测不同条件下MG-63 细胞骨肿瘤Notch1-ICN 蛋白表达变化,正常组、乏氧组和实验组蛋白表达分别为图5 所示。在乏氧环境下,DAPT 阻断Notch1 通路的MG-63细胞Notch1、Hes-1 蛋白明显下调,且与DAPT 的浓度呈依耐性,乏氧组与实验组Notch1-ICN 蛋白表达具有明显差异(P<0.05)。
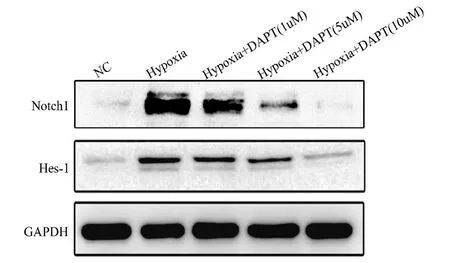
图5 乏氧环境下,DAPT 阻断Notch1 通路的MG-63 细胞Notch1、Hes-1 蛋白明显下调,且与抑制剂DAPT 的浓度呈依耐性(图中NC为正常组、Hypoxia 为乏氧组、Hypoxia+DAPT 为实验组)
3 讨论
骨肉瘤是一种起源于间叶组织的骨原发性恶性肿瘤,其恶性程度高、生长快且易转移,临床预后差,好发于儿童及青少年,常规方法治疗效果仍不理想。随着近年来新辅助化疗和手术治疗的应用,使得恶性骨肉瘤的保肢率及生存率有了较大提升,但较高的死亡率使得骨肉瘤的临床治疗仍面临着巨大的挑战。恶性肿瘤的过度生长和异常增殖超过新生血管形成的速度而造成的氧扩散距离增加会引起慢性缺氧,使得实体瘤内出现乏氧微环境,缺氧将触发基因的表达变化,它能通过几种机制来促进肿瘤的进展,包括新生血管的形成和增加细胞的增殖、迁移、侵袭、耐药能力等。已经证实骨肉瘤存在乏氧微环境,乏氧可促进骨肉瘤细胞增殖及侵袭能力增强等[11]。在乏氧微环境下,HIF-1 在维持肿瘤细胞的增殖、凋亡、迁移和侵袭及肿瘤耐药等方面发挥重要的作用。
研究[12]显示肿瘤的发生发展与Notch 的活化关系密切,其参与肿瘤细胞的增殖、侵袭及耐药等。Notch 的异常表达已经在人类许多实体瘤中发现,在乳腺癌、前列腺癌、肉瘤、肺癌等恶性肿瘤疾病中存在异常表达[13]。Notch 信号通路包括Notch 配体、受体,阴性和阳性调节剂以及Notch 靶向转录因子。对于Notch1 与骨肉瘤的研究,国内学者李永刚等[14]指出大蒜素和姜黄素能够通过下调Notch1 信号通路和上调肿瘤抑制基因miRNAs 来诱导骨肉瘤细胞周期阻滞、凋亡增加来抑制骨肉瘤发生、发展,从而发挥抗骨肉瘤作用。国内外研究提示多种分子可通过激活Notch 信号来增强骨肉瘤侵袭力及其增殖能力,研究Notch1 信号通路的抑制剂将成为肿瘤治疗的新思路。实验研究表明,乏氧微环境下转录调控因子HIF-1 被激活使其下游Notch1 表达上调引起Notch1 信号通路的激活,同时诱导肿瘤细胞增殖及肿瘤侵袭力增强等[15]。这些发现提示骨肉瘤Notch1 通路的抑制剂(分泌酶抑制剂)将成为Notch 靶向治疗的的有效靶点。
本研究中选用的骨肉瘤MG-63 细胞系存在较高的Notch1 信号表达。研究结果中图1 显示骨肉瘤细胞在乏氧微环境下可以明显增殖,在图2 中显示乏氧微环境下G1/G2 期细胞减少,证明乏氧微环境能促使骨肉瘤细胞MG-63 周期从G0/G1 向G2/M 转化,而实验组呈G0 期阻滞增多说明DAPT 对骨肉瘤细胞MG-63 增殖的抑制作用明显。图3 也印证了DAPT 抑制骨肉瘤细胞转移能力。细胞增殖与乏氧微环境下HIF-1 激活有关,图4 中已经证实在乏氧状态下HIF-1 与Notch基因水平及蛋白水平均表达上调并且呈时间依耐性。图5 应用 分泌酶抑制DAPT 下调Notch1 能诱导乏氧环境下骨肉瘤细胞的增殖能力减弱,且强调了Notch1 是乏氧的下游通路,阻断Notch1 可以逆转乏氧对骨肉瘤细胞MG-63 细胞的促增殖作用,提示Notch1 是骨肉瘤细胞恶性增殖的有效分子靶点。图5 显示DAPT 作为Notch1 通路的有效抑制剂其抑制作用呈浓度依耐性,本研究选取10 M 浓度的DAPT 作为本研究的实验浓度,在10 M 的作用浓度下,基因水平及细胞周期都能发生阻滞,可见肿瘤细胞的侵袭力在DAPT 的作用下得到有效抑制(见图1、图2、图3)。上述结果均显示在乏氧微环境下HIF-1 在骨肉瘤中的表达模式和生物学功能,同时初步阐明了其通过调控下游靶基因Notch1 从而影响骨肉瘤细胞增殖、凋亡、迁移和侵袭能力的作用机制,这为深入了解骨肉瘤发生发展机制提供了理论指导,同时为骨肉瘤的诊断和治疗提供了新的思路。
乏氧微环境下HIF-1 活化是细胞乏氧应答的关键环节,HIF-1 的转录激活能增强肿瘤细胞的葡萄糖转运及糖酵解能力,调节肿瘤细胞的增殖及代谢的生理学过程[16]。乏氧环境下HIF-1 与Notch 相互作用,诱导多种肿瘤的发生发展进程。
综上所述,本研究选取HIF-1 及Notch1 信号通路作为作用靶点进行细胞体外实验,研究结果显示DAPT 可通过下调Notch1 通路显著抑制乏氧状态下骨肉瘤细胞株MG-63的增殖与侵袭。DAPT 作为骨肉瘤的靶向治疗药物,与传统药物相比具有更加光明的应用前景;接下来将进一步研究明确在体动物实验中DAPT 对骨肉瘤MG-63 细胞系生物学影响的具体作用机制,为将来DAPT 临床应用治疗骨肉瘤提供新的思路和依据。

