过表达SIRT1基因通过PI3K/AKT信号通路抑制高糖刺激心肌H9c2细胞凋亡和活性氧水平*
翟 铁,郝凤杰△,田雪品,张宗群
(承德市中心医院1内分泌科,2神经内科,河北 承德 067000)
糖尿病心肌病(diabetic cardiomyopathy,DCM)主要是由于机体持续高糖状态导致心脏功能代谢异常,结构发生改变的一种疾病状态[1-3]。既往研究表明,在糖尿病患者和动物模型中心肌细胞表现为凋亡率增加,增殖能力降低,但目前对其分子机制尚不明确[4-5]。近年来的研究表明,细胞中氧化应激损伤是导致糖尿病心肌病发生的主要原因之一[6]。沉默信息调节因子1(silent information regulator 1,SIRT1)是一种被广泛研究的sirtuins家族成员,在机体多种器官中均有表达如大脑、心脏和脂肪组织等,主要存在于细胞核中,对机体多种信号通路的调节作用具有重要意义[7-8]。SIRT1调节蛋白质发生脱乙酰化反应,参与蛋白质的转录和翻译,调节细胞的增殖、氧化应激和新陈代谢等,对代谢性疾病、肿瘤和心脏功能发挥重要作用[9-10]。本研究探讨过表达SIRT1对高糖诱导下心肌 H9c2细胞活力和凋亡的影响,以期为糖尿病心肌病的预防和治疗寻找新的思路。
材 料 和 方 法
1 实验材料
心肌H9c2细胞购自中科院上海细胞库。DMEM培养基购自Gibco;SIRT1过表达质粒(pcDNA3.1-SIRT1)和空载质粒(pcDNA3.1-NC)购自上海吉玛有限公司;TRIzol和Lipofectamine 2000购自Invitrogen;细胞凋亡检测试剂盒、抗β-肌动蛋白(β-actin)抗体和噻唑蓝(methylthiazolyldiphenyl te-trazolium bromide,MTT)购自上海碧云天生物有限公司;双氯荧光素(2’,7’-dichlorfluorescein diacetate, DCFH-DA)购自Sigma;抗磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)抗体、抗磷酸化PI3K(p-PI3K)抗体、抗AKT抗体、抗磷酸化AKT(p-AKT)抗体和抗SIRT1抗体购自Santa Cruz。ABI 7900实时荧光定量PCR仪购自Applied Biosystems;流式细胞仪购自Thermo Fisher Scientific;凝胶成像仪购自Bio-Rad。
2 方法
2.1细胞的培养与分组 心肌 H9c2细胞培养于37 ℃、5% CO2的细胞培养箱中,加入含10%胎牛血清的DMEM培养基,每2~3 d加入0.25%胰酶消化,加入完全培养基终止消化,按照1∶3或1∶4进行传代。取生长状态良好的细胞,随机分为对照(control)组(常规培养)和高糖(high glucose,HG)组(加入33 mmol/L葡糖糖刺激24 h),高糖组又分为3组:高糖+过表达SIRT1(HG+SIRT1)组(转染pcDNA3.1-SIRT1后给予高糖刺激)、高糖+阴性对照(HG+NC)组(转染pcDNA3.1-NC后给予高糖刺激)和高糖(HG)组(加入高糖刺激)。
2.2细胞的转染 转染前24 h,胰酶消化、计数心肌 H9c2细胞,接种于24孔板中,采用不含抗生素的培养基稀释pcDNA3.1-SIRT1和pcDNA3.1-NC,与Lipofectamine 2000混合均匀,37 ℃静置20 min,加入每孔细胞中,37 ℃孵育5 h,更换为含10%血清的培养基培养48 h。
2.3qPCR检测SIRT1的mRNA表达 使用 TRIzol试剂提取细胞中总RNA。微量移液器吸取5 μg RNA反转录为cDNA,进行扩增反应。SIRT1的上游引物序列为5’-CTTCAGGTCAAGGGATGGTAT-3’,下游引物序列为5’-GCGTGTCTATGTTCTGGGTAT-3’;内参照β-actin的上游引物序列为5’-GGGAAATCGTGCGTGACA-3’,下游引物序列为5’-TCAGGAGGAGCAATGATC-3’。置于ABI 7900实时荧光定量PCR仪中进行扩增,条件为:95 ℃ 5 min;95 ℃ 30 s、58 ℃ 30 s、72 ℃ 8 min,40个循环。实验重复3次,采用2-ΔΔCt法计算SIRT1 mRNA的相对表达量。
2.4细胞活力的检测 将各组细胞以每孔5×103个接种于96孔板上,培养箱中培养24 h、48 h和72 h,加入MTT 20 μL,37 ℃静置4 h,加入200 μL 二甲基亚砜,37 ℃孵育30 min,酶标仪中检测细胞570 nm的吸光度(A)值。细胞的活力=(实验组A570-空白组A570)/(对照组A570-空白组A570)×100%。
2.5细胞凋亡的检测 收集各组细胞,加入PBS清洗3次,加入胰酶,调整其密度为1×109/L,吸取0.5 mL细胞悬浮液培养24 h后,每孔加入1.25 μL 膜联蛋白 V-FITC和10 μL 碘化丙啶,4 ℃染色过夜,流式细胞术分析凋亡率。
2.6细胞中活性氧簇 (reactive oxygen species,ROS)的检测 收集各组心肌 H9c2细胞,接种至24孔板中,待细胞密度为80%左右,每孔加入10 μmol/L DCFH-DA,37 ℃培养30 min,荧光显微镜下随机选取5个视野,分析绿色荧光强度,取平均值(mean fluorescence intensity, MFI),可间接反映ROS水平。
2.7Western blot检测蛋白水平 收集细胞,加入预冷的PBS缓冲液清洗2次,置于细胞裂解液中30 min,12 000×g离心20 min,收集上清。吸取50 μg总蛋白,采用10% SDS-PAGE分离蛋白,将分离的目的蛋白转移至聚偏二氟乙烯膜中,阻断缓冲液封闭2 h;加入 I 抗,4 ℃过夜,Tris-HCl-Tween缓冲盐溶液漂洗3次,每次10 min,加入 II 抗,37 ℃孵育2 h,Tris-HCl-Tween缓冲盐溶液漂洗3次,每次10 min,凝胶成像仪中拍照,Quantity One软件分析蛋白质灰度值,计算蛋白的相对表达量。
3 统计学分析
采用SPSS 22.0软件进行统计处理,结果以均数±标准差(mean±SD)表示,多组数据间的比较采用单因素方差分析,组间多重比较使用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 转染后心肌H9c2细胞中SIRT1的表达变化
与对照组相比,高糖诱导的心肌 H9c2细胞显著降低SIRT1的表达量(P<0.05);与高糖组相比,转染过表达载体显著增加心肌 H9c2细胞中SIRT1的表达量(P<0.05),见图1。

Figure 1.The expression of SIRT1 at mRNA and protein levels in the H9c2 cells after transfection. A: the mRNA expression level of SIRT1 detected by qPCR; B: the protein level of SIRT1 detected by Western blot. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsHG group.
图1 转染后心肌H9c2细胞中SIRT1的mRNA 和蛋白表达
2 过表达SIRT1对心肌H9c2细胞活力的影响
MTT结果显示,与对照组相比,高糖诱导的心肌 H9c2细胞的活力显著降低(P<0.05);与高糖组相比,过表达SIRT1显著增加心肌 H9c2细胞的活力(P<0.05),见图2。
3 过表达SIRT1对H9c2心肌细胞凋亡率的影响
与对照组相比,高糖诱导显著提高心肌 H9c2细胞的凋亡率(P<0.05);过表达SIRT1细胞的凋亡率与对照组相比差异无统计学显著性;与高糖组相比,过表达SIRT1显著降低细胞凋亡率(P<0.05),见图3。
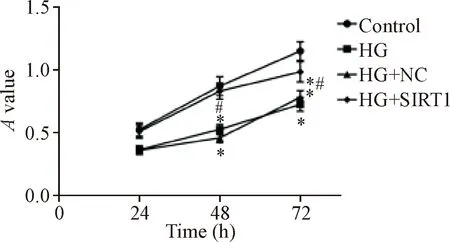
Figure 2.The effect ofSIRT1over-expression on the viability of H9c2 cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsHG group.
图2 过表达SIRT1对心肌 H9c2细胞活力的影响
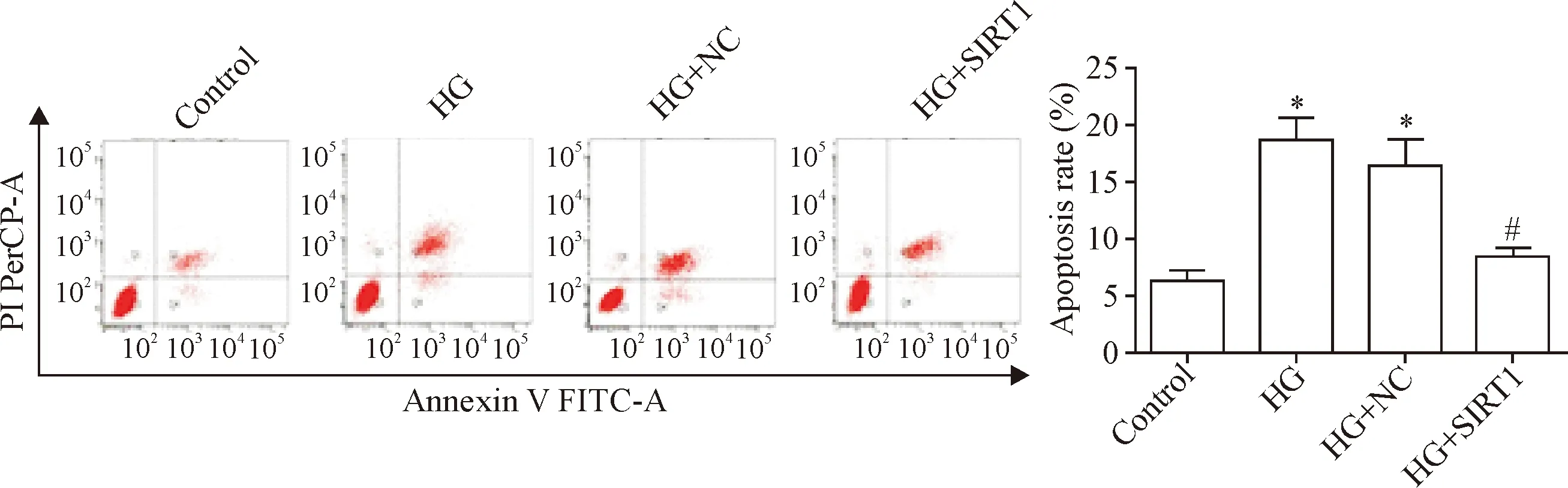
Figure 3.The effect ofSIRT1over-expression on the apoptotic rate of H9c2 cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsHG group.
图3 过表达SIRT1对心肌H9c2细胞凋亡率的影响
4 过表达SIRT1对心肌 H9c2细胞ROS生成的影响
与对照组相比,高糖诱导显著提高心肌 H9c2细胞中ROS的水平,过表达SIRT1的细胞与对照组相比差异无统计学显著性;与高糖组相比,过表达SIRT1显著降低细胞中ROS的水平(P<0.05),见图4。
5 过表达SIRT1对PI3K/AKT蛋白水平和磷酸化的影响
Western blot结果显示,各组间心肌 H9c2细胞中PI3K和AKT总蛋白的水平变化差异无统计学显著性;与对照组相比,高糖诱导显著降低PI3K和AKT磷酸化蛋白的水平(P<0.05),过表达SIRT1对细胞中PI3K和AKT磷酸化蛋白的水平无显著影响;与高糖组相比,过表达SIRT1显著增加PI3K和AKT磷酸化蛋白的水平(P<0.05),见图5。

Figure 4.The effect ofSIRT1over-expression on the production of ROS in the H9c2 cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsHG group.
图4 过表达SIRT1对心肌H9c2细胞生成ROS的影响

Figure 5.The effect ofSIRT1over-expression on the protein levels of PI3K/AKT signaling pathway-related molecules in the H9c2 cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsHG group.
图5 过表达SIRT1对PI3K/AKT信号通路相关分子蛋白水平的影响
讨 论
心肌细胞凋亡率升高和存活率下降是多种心血管疾病发生的主要特征之一[11-12]。研究发现,糖尿病患者心肌细胞凋亡的增加和坏死等导致心肌结构的变化,严重下调心脏的代偿能力,阻碍心脏的泵血功能[13-14]。心肌细胞凋亡在糖尿病心肌病的发生、发展过程中发挥重要作用,糖尿病心肌病患者的心肌细胞更易发生坏死和凋亡。SIRT1是一种组蛋白脱乙酰基酶,转移DNA组蛋白赖氨酸N端乙酰基并调控转录过程,参与细胞的增殖、凋亡、氧化应激、糖尿病细胞的新陈代谢等[15-18]。在糖尿病大鼠模型中,SIRT1通过调节S-腺苷同型半胱氨酸水解酶的水平参与糖尿病心肌病的发生和发展[9],表明SIRT1在DCM过程中起重要作用。因此SIRT1在临床治疗DCM中发挥关键作用,在心脏和血管等细胞异常增殖的治疗中具有很好的前景。在本实验中,高糖诱导的心肌细胞中SIRT1的表达量降低,共转染过表达载体显著增加高糖诱导的心肌细胞中SIRT1的表达量;过表达SIRT1促进高糖刺激的心肌 H9c2细胞的活性,抑制细胞的凋亡,降低细胞中ROS的累积。既往研究表明,SIRT1可抑制心肌细胞的凋亡,白藜芦醇显著增加SIRT1的表达量,减少高糖诱导的心肌细胞凋亡[19-20],与本实验研究结果相似。
氧化应激在DCM病变过程中起关键作用,损害心血管系统和微血管结构的改变。糖尿病患者持续的高糖环境导致细胞代谢紊乱,促进血管内皮、微血管、心肌细胞中线粒体过氧化产物的积累,从而增加细胞内活性氧水平,活性氧的产物通过促进细胞凋亡或者激活细胞内的信号转导通路导致心肌细胞损伤,还可直接调节细胞DNA损伤以及损伤修复机制的活化,从而增强活性氧诱导的细胞凋亡过程,最终导致糖尿病心肌病的心脏功能和结构障碍[21]。在糖尿病心肌细胞的氧化应激过程中,由多种信号通路的参与,如PI3K/AKT和核因子κB(nuclear factor-kappa B, NF-κB)等信号通路。研究表明SIRT1可通过PI3K/AKT信号通路参与细胞的增殖和凋亡过程[22]。因此本实验通过Western blot检测心肌 H9c2细胞中PI3K/AKT信号通路关键蛋白的水平,结果发现细胞中总蛋白水平无显著变化,但PI3K和AKT的磷酸化水平在高糖的诱导下显著降低,过表达SIRT1可升高PI3K和AKT的磷酸化水平,表明SIRT1可能通过PI3K/AKT信号通路调节心肌 H9c2细胞凋亡和氧化应激。
综上所述,过表达SIRT1可增加高糖诱导的心肌 H9c2细胞活性,降低其凋亡率和氧化应激反应,可能通过影响PI3K/AKT信号通路发挥作用,为糖尿病心肌病的治疗提供实验依据。

