吡咯伯克霍尔德菌WY6-5的溶磷、抑菌与促玉米生长作用研究
宫安东,朱梓钰,路亚南,万海燕,吴楠楠,Cheelo Dimuna,龚双军,文淑婷,侯晓
(信阳师范学院生命科学学院/河南省茶树生物学重点实验室,河南信阳 464000)
0 引言
【研究意义】中国为农业生产大国,土壤保肥和粮食增产是农业可持续发展的重要议题。长期以来,由于对作物增产的盲目追求,化学肥料施用量逐年增多,导致土壤生态恶化[1]、有机质减少、微生物区系改变[2]、肥力降低[3]等问题,严重制约了农业的可持续发展。为此,中国农业农村部制订了《到2020年化肥使用量零增长行动方案》,以解决土壤持续恶化问题[4]。微生物在土壤中分布广泛,种类和功能多样[5],到目前为止,已报道多种微生物具有固氮、溶磷、解钾和促生长等重要作用,可以改善土壤微环境,提升土壤肥力[6]。因此,开展微生物菌肥研制,对土壤肥力的提升和农业可持续发展具有重要意义。【前人研究进展】磷肥是植物生长所必需的三大肥料之一。在我国,约74%的土壤中缺磷[7],且95%以上的磷以难溶性的铝硅酸盐和磷灰石存在,无法被植物吸收利用[8],加之农业生产中对化学磷肥的过度依赖,施用量逐年增多,进一步加重了土壤的矿质化污染[9]。据估算,1949—1992 年间,我国累计施入农田的磷肥达3.4×107t,其中大约有2.6×107t磷累积在土壤中[10],造成了土壤酸化、板结、肥力降低和水体富营养化等问题。如何改善土壤磷环境,提升可溶性磷含量,是目前研究的热点。溶磷微生物可产生酸性代谢物,溶解土壤中的难溶性磷化物,转化为可溶性磷肥,补充植物所需磷营养[11],并能促进植物对N、K、Ca、Mg、Fe、Zn 等其他营养元素的吸收,进一步提高作物的生物量和产量[12]。曾广勤等[13]研究表明,施用溶磷菌可以提高小麦的氮、磷含量,改善农产品质量,并提高小麦的抗旱和抗寒能力。郝晶等[14]证明,溶磷菌能促进植物生长,大幅度提高豌豆产量。溶磷菌广泛使用不仅可以提升土壤磷肥力,促进植物生长,同时还有效缓解了土壤矿质化污染问题,具有较好的应用价值和生态效益。到目前为止,已报道多种微生物具有溶磷能力,如放线菌(Actinomycetessp.)[15]、芽孢杆菌(Bacillussp.)[16]、假单胞菌属(Pseudomonassp.)[17]、沙雷氏菌属(Serratiasp.)[18]、肠杆菌属(Enterobactersp.)[19]、根瘤菌属(Rhizobiumsp.)[20]以及伯克霍尔德菌属(Burkholderiasp.)等。但针对伯克霍尔德菌的溶磷效果研究相对较少,且筛选到的菌株仅在液体摇培条件下具有活性,而在土壤中的溶磷效果,以及对植物生长的作用尚未可知[7,21]。与此同时,报道的多数溶磷微生物,仅有单一溶磷活性,其抑菌效果尚未揭示,在一定程度上制约了其广泛应用。【本研究切入点】本研究以筛选兼具有溶磷和抑菌的微生物菌株为研究目的,从百年茶龄茶树根际土中,筛选高效溶磷且产气抑菌的吡咯伯克霍尔德菌WY6-5,分析WY6-5在不同环境条件下的溶磷作用,验证对玉米植株生长作用,检测对不同病原真菌的抑菌效果,并鉴定抑菌功能物质,确定其生物学功能。【拟解决的关键问题】筛选高效溶磷抑菌微生物菌株,确定筛选菌株的分类学地位,并验证其在溶磷、抑菌和促生长方面的重要作用,鉴定抑菌代谢物质,为多功能微生物菌株的筛选,提供参考依据。
1 材料与方法
1.1 供试菌株与植物材料
供试细菌菌株WY6-5,为本试验分离野生菌株,分离于信阳市车云山茶区,为百年树龄茶树根际土壤微生物。
供试玉米材料为鲲玉品种。供试真菌菌株有禾谷镰刀菌、禾谷炭疽菌、链格孢菌、稻瘟病菌、烟曲霉菌、黄曲霉菌、黑曲霉菌和灰霉菌。
1.2 供试培养基
无机磷培养基:(NH4)2SO40.5 g,MgSO40.3 g,NaCl 0.3 g,Ca3(PO4)28.0 g,葡萄糖 10.0 g,11% MnSO41 mL,1% FeSO41 mL,琼脂20 g,pH 7.2,去离子水定容至1 L。
有机磷培养基:(NH4)2SO40.5 g,NaCl 0.3 g,KCl 0.3 g,CaCO35 g,11% MnSO41 mL,1% FeSO41 mL,卵磷脂 0.8 g,酵母膏 0.8 g,琼脂 20 g,pH 7.0,去离子水定容至1 L。
1.3 溶磷菌株的筛选
取新鲜土壤样品1 g于2 mL 离心管内,加入1 mL无菌水混匀,梯度稀释至10-5。取稀释液100 μL,涂布棒涂布于无机磷平板表层,37℃恒温培养72 h,挑取溶磷圈大、澄清且边缘整齐的单菌落,于 NA(牛肉膏3 g,蛋白胨 10 g,氯化钠 5 g,蒸馏水定容至1 L,琼脂15 g,pH=7.2)平板划线纯化,获取单菌落。
采用无机磷(有机磷)培养基筛选法,检测菌株的溶磷效果,在培养基表面距中心位置1.5 cm处,放置5 mm直径的无菌滤纸,中心位置另一端对称处打孔器打孔(5 mm直径),向滤纸片上和孔洞中分别加入10 μL细菌菌悬液(OD600=1.8),以接种等量无菌水的处理做对照。37℃恒温培养5 d,当两种接种方法中同时出现溶磷圈时,认定为溶磷菌。测定打孔培养法中,溶磷圈直径与菌落直径,计算溶磷率(溶磷圈直径与菌落直径比,D/d),筛选高活性菌株。
1.4 菌株 WY6-5 的鉴定
1.4.1 形态学鉴定 将菌株WY6-5划线培养于NA培养基表面,37℃培养24 h,观察菌落形态,挑取单菌落进行形态学分析。
1.4.2 分子生物学鉴定[22]采用Tris-HCl(Amresco公司)和EDTA(Amresco公司)法提取基因组DNA,16S rRNA通用引物27 F(AGAGTTTGATCCTGGC TCAG)和 1492 R(AAGGAGGTG ATCCAGCCGCA)扩增保守序列。琼脂糖凝胶电泳检测扩增条带,回收纯化PCR产物,送武汉天一辉远生物科技公司测序。测序结果于NCBI数据库进行同源性分析,归类为伯克霍尔德菌属,筛选同属中同源性高,且已鉴定的模式菌株为参比,进行系统发育树构建。CLUSTAL X1.83 进行多重序列比对,MEGA 7软件 Neighbor joining法构建系统发育树。
1.4.3 生理生化鉴定 将菌株WY6-5在NA培养基上进行划线活化,12 h后挑取单菌落接种至IF-A GEN III inoculating fluid培养液混合均匀,并转接至Biolog Gen III 培养板中,37℃下培养 10—20 h,BIOLOG MicroStation™ System微生物鉴定系统进行生理生化特性分析,与数据库中已鉴定模式菌株进行比对分析,选取生理生化反应相似度最高的种,确定同源菌种。
1.5 液体培养条件菌株 WY6-5 的溶磷效果
将菌株 WY6-5 培养于NB培养液(牛肉膏3 g,蛋白胨 10 g,氯化钠 5 g,蒸馏水定容至1 L,pH=7.2)中,200 r/min,37℃摇培24 h,离心收集菌体,无菌水清洗 2 次,按 6%(v/v)比例接种菌液至装有40 mL无机磷液体培养基的三角瓶中,以接种等量无菌水的处理为对照,每个处理重复3次,所有处理培养于37℃200 r/min。分别于第0、3、6、12、20天取样,测定可溶性磷含量,分析菌株溶磷能力。
应用 AMS France连续流动分析仪进行菌株溶磷能力的测定。取优级纯磷酸二氢钾粉末4.3871 g,溶解到400 mL dd H2O水中,定容到1 000 mL,配成1 g·L-1标准储备液。依次稀释至3.0、6.0、9.0、12.0、15.0 mg·L-1的标准液,检测不同浓度下,可溶性磷峰面积,与对应浓度构建标准曲线回归方程,计算样品中可溶性磷含量。
1.6 菌株WY6-5 在土壤中的溶磷效果
供试土壤取自信阳市浉河区车云山茶厂,地表下5—10 cm深茶树根迹土壤,土质为黄褐土,有机质含量偏低,呈弱酸性[23]。烘干过 10目筛,将其分装成每袋 1.4 kg,121℃下灭菌 30 min,灭菌3次。按 20%(v/w)接种量添加无机磷培养液,按 1%(v/w)接种量接种 WY6-5菌悬液(OD600=1.8),混合均匀;以接种等量无菌水的处理作为对照,每个处理组重复3次,于室温下静置培养。两组分别培养至第0、3、12、20天时取样,采用Olsen法对所取土样前处理[24],使用连续流动分析仪测定可溶性磷含量。
1.7 菌株WY6-5 对玉米生长的作用
土壤灭菌处理后,自然晾干,分别取1.4 kg,添加于每个花盆(开口直径19.2 cm,高14.2 cm)中,按照 20%(v/w)接种量添加无机磷培养液,按 1%(v/w)接种量添加WY6-5的菌悬液,以接种等量无菌水的处理为对照,混合均匀后播种萌发的玉米籽粒,每盆播种4粒,每个处理重复3次。自然环境条件下培养27 d后,测定玉米植株叶长、叶宽、单叶叶面积、叶片数、株高、茎粗、鲜重和地上、地下干重等指标。
1.8 菌株WY6-5的广谱抑菌作用分析
采用双皿(直径9 cm)对扣培养法[25],检测菌株WY6-5对不同病原真菌的抑菌活性。挑选活化的真菌菌丝块接种于含 PDA培养基的培养皿中央。100 μL菌株WY6-5(OD600=1.8)涂布于另一个含NA培养基的培养皿表面。将接种真菌菌丝块的培养皿对扣于涂布WY6-5的培养皿之上,透明胶带密闭封口。以仅接种真菌菌丝块的处理作为对照,每个处理重复3次,所有培养皿于28℃黑暗条件下培养5 d,统计真菌菌丝直径,计算抑菌率。
抑菌率(%)=(对照菌丝直径-处理菌丝直径)/对照菌丝直径×100。
1.9 菌株WY6-5挥发性代谢物质鉴定
将菌株WY6-5接种于100 mL三角瓶中的NA培养基表面,用涂棒涂布均匀,以接种等量无菌水的NA培养基为对照,所有接种的三角瓶用双层塑料薄膜密封,并置于28℃黑暗条件下培养48 h[26]。培养后的三角瓶转移到40℃的水浴锅中平衡30 min。采用固相微萃取柱(Solid phase micro-extraction,SPME,DVB/CAR/PDMS,30/50 μm)进行挥发性物质的富集,将SPME的金属针插入塑料薄膜下,推出内部的富集针,使富集针处于样品瓶中部正上空位置,吸附微生物产生的挥发性物质,30 min后,将富集针收回金属针内,并转入气相色谱质谱联用仪(GC-MS/MS)进样口,手动进样进行检测。
GC-MS/MS检测过程中,进样口温度250℃;离子源为EI源,温度为230℃,轰击能量为70 eV,四极杆温度 150℃,采用不分流进样,全扫描的模式进行检测。载气为氦气,柱流速1 mL·min-1。气相色谱采用程序升温:起始温度60℃,保持2 min;以5℃·min-1的速度升温至150℃,保持2 min;以10℃·min-1速率升至280℃,保持2 min。检出所有物质进行谱库检索National Institute of Standards and Technology(NIST 17)。每个处理检测两次,两次重复中微生物组均出现,且对照组中未检出的物质,确定为WY6-5产挥发性物质。
1.10 统计学处理
采用SPSS17.0软件对试验数据进行统计分析,统计结果为3次重复数据取平均值,采用独立性T检验进行方差分析,计算标准误,计算显著性差异(P<0.05)。
2 结果
2.1 高效溶磷微生物的筛选
采用稀释涂平板法,将稀释液涂布于无机磷培养平板表面,培养3 d后,筛选可形成溶磷圈的微生物菌株。本研究中,共计获得 11个溶磷细菌,其中 3株细菌兼具有降解难溶性无机磷和有机磷的生物学功能。溶磷活性分析表明,菌株 WY6-5溶磷效果最好,明显优于其他菌株,对难溶性无机磷的溶解直径为2.3 cm,溶磷率D/d值高达4.6;对难溶性有机磷溶解直径 3.6 cm,溶磷率 D/d值为7.2(图 1)。因此本试验中以 WY6-5为优势生物菌株,进行后续溶磷作用分析。
2.2 菌株 WY6-5的鉴定
细菌WY6-5于NA培养基培养24 h后,菌落呈乳白色,不透明,边缘规则,表面光滑湿润。16S rRNA序列比对发现,菌株WY6-5为伯克霍尔德菌属,且与模式菌株[27]Burkholderia pyrrociniaCIP 105874和Burkholderia stabilisCIP 106845的亲缘性最高,遗传距离相对最近,三者聚为一个分支,将菌株 WY6-5初步鉴定为Burkholderia pyrrocinia/ stabilis(图2)。
对菌株 WY6-5进行生理生化分析表明,菌株WY6-5与BIOLOG MicroStation™ System数据库中的洋葱/吡咯伯克霍尔德氏菌种(Burkholderia cepacia/pyrrocinia)具有相似生理生化特性。可利用α-D-葡糖、D-山梨醇、D-果糖、D-天冬氨酸等 24种碳、氮源,对1%的氯化钠具有耐受性,4%的氯化钠不具有耐受性,耐pH 5酸性条件,对万古霉素、林肯霉素等多种抗生素和化学物质具有抗性(表1)。
综上所述,结合表型观察、生理生化试验、系统发育树分析,菌株WY6-5与吡咯伯克霍尔德菌在分子水平和生理生化水平均具有高度同源性,故将其鉴定为吡咯伯克霍尔德菌。

图1 菌株WY6-5对难溶性无机磷和有机磷的溶解效果Fig. 1 P-solubilizing activity of strain WY6-5 in the medium containing insoluble organic/inorganic phosphorus

图2 菌株WY6-5及其近缘种的系统进化树分析Fig. 2 Phylogenetic tree analysis of strain WY6-5 and other homologous strains based on 16S rRNA sequences

表1 菌株WY6-5的生化活性鉴定Table 1 Biochemical analysis of strain WY6-5
2.3 菌株 WY6-5 的溶磷效果分析
吡咯伯克霍尔德菌 WY6-5在培养基中具有高效的溶磷活性,为进一步分析其在不同环境下的溶磷效果,进行液体摇培和土壤溶磷试验。摇培试验表明,菌株WY6-5在液体环境下具有较好的溶磷活性,能显著提高可溶性磷含量。整个培养周期内,对照组中磷含量未发生明显变化,WY6-5添加组,随着时间的延长,可溶性磷含量呈线性梯度增多,培养至第6天时,磷含量达到 181.0 mg·L-1,第 20 天达到 520.4 mg·L-1,为对照组的176倍(图3-A)。
菌株 WY6-5在土壤中同样具有溶磷活性(图3-B),与对照组相比,培养20 d内,WY6-5添加组的磷含量均高于对照组,尤其在培养3—12 d内,有效磷含量明显高于对照组。但由于土壤组成复杂,随时间的延长,土壤有效磷含量逐渐降低。
2.4 菌株WY6-5 对盆栽玉米的促生长作用
盆栽试验表明,吡咯伯克霍尔德菌WY6-5在土壤中具有较好的促生长活性,可以明显促进苗期玉米的生长。培养27 d后观察,菌株WY6-5添加组玉米长势明显优于对照组(图4),在叶长、叶宽、单叶叶面积、叶片数、茎粗、株高、鲜重和地上部干重等相应指标显著高于对照组,且与对照组相比,增长量分别达21.7%、21.1%、47.8%、8.0%、24.6%、13.0%、23.5%和49.5%(表2),表明菌株WY6-5施用于土壤后,能改善土壤营养状况,促进作物生长。
2.5 菌株WY6-5的抑菌作用与代谢产物鉴定
采用双皿对扣培养法,检测WY6-5抑菌效果。结果表明,WY6-5通过产生挥发性物质,抑制病原真菌的生长(图5)。培养5 d后观察,对照组真菌菌丝生长迅速,WY6-5处理组,真菌菌丝生长受抑制,抑菌率均高于70%,其中对稻瘟菌和禾谷镰刀菌抑菌率分别达到 86.3%和 92.6%,对烟曲霉菌、黄曲霉菌、灰霉菌和黑曲霉菌的抑菌效果最显著,抑制率达100%。菌株WY6-5产生的挥发性物质具有较好的抑菌效果,对多种病原真菌具有高效广谱的抑菌作用。
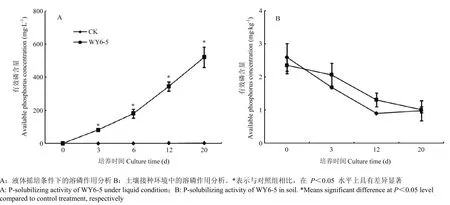
图3 菌株 WY 6-5 对培养液和土壤中的溶磷效果分析Fig. 3 P-solubilizing activity of the strain WY 6-5 in water and soil
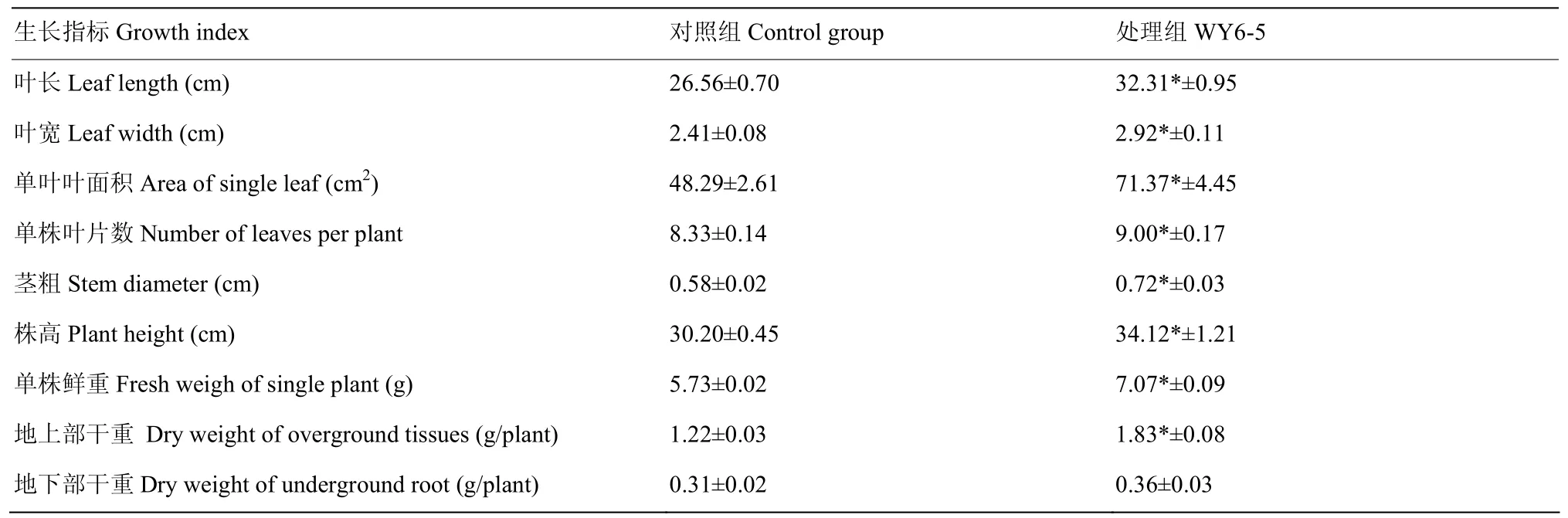
表2 菌株WY6-5对苗期玉米生长的影响Table 2 Effect of strain WY6-5 on the growth of maize seedling
2.6 挥发性代谢物质鉴定
运用GC-MS/MS检测菌株WY6-5产生的挥发性气体,结果显示,菌株WY6-5产生一种高丰度的挥发性物质,保留时间为2.7 min,与色谱峰总面积相比,相对丰度达99%以上。经NIST谱库检索比对,将该物质鉴定为二甲基二硫(dimethyl disulfide, DMDS)(图6)。
3 讨论
在我国,土壤中有效磷含量相对不足,矿质化严重,难以满足农业生产的需求[28]。溶磷菌在土壤中分布广泛,能通过酸化、螯合以及交换等反应机制,将无效磷转化为植物可利用的有效磷[29],提升磷肥利用率,是目前解决磷肥短缺问题的重要手段之一。本研究从茶树根际土壤中筛选到一株具有高效溶磷作用的微生物菌株WY6-5,通过菌体表型特征、生理生化检测和16S rRNA序列比对分析,将菌株 WY6-5 鉴定为吡咯伯克霍尔德菌(B. pyrrocinia)。该菌株不仅可以溶解难溶性的磷酸钙,还可溶解有机态的卵磷脂,培养皿培养中,呈现面积大、边缘整齐、透明度高的溶磷圈,具有高效的溶磷活性。
溶磷微生物不仅在固体培养基中具有溶磷作用,在液体培养条件下,也具有较好的溶磷活性,如张云霞等[30]报道的枯草芽孢杆菌JT-1,液体摇培条件下,解磷量最高达到386.3 mg·L-1,余贤美等[31]筛选到一株洋葱伯克霍尔德菌PSB3,液体培养后,上清液中含磷量最高达 218.6 μg·mL-1,戴沈艳等[32]获得的解磷菌,培养后溶磷量可达 240.1 mg·L-1。与上述溶磷菌株相比,本研究筛选的菌株WY6-5,在液体环境中具有更好的溶磷效果,培养20 d内,磷含量呈直线增长,最高达520.4 mg·L-1,达对照组的176倍,溶磷活性显著高于现阶段报道的其他菌株。除此之外,菌株WY6-5在土壤中也具有较好的溶磷活性,整个培养周期内,WY6-5添加组可溶性磷含量均高于对照组;但随时间的延长,溶磷菌添加组和对照组中可溶性磷含量均呈降低趋势,该变化趋势与张爱民[33]和王琰[34]等报道的研究结果相似,主要原因为土壤组成成分复杂,受金属离子、生物酶、微生物等因素影响,溶解后的可溶性磷再次被固定,导致含量降低;同时,随培养时间延长,土壤中营养物质消耗,有害物质积累,WY6-5活性减弱,是可能导致磷含量降低的另一诱因。土壤中微生物的高效溶磷活性,是多种因素共同作用的结果,揭示各因素间的相互关系,是后期研究的重点。

图4 菌株WY6-5对玉米幼苗生长的影响Fig. 4 Effect of strain WY6-5 on the growth of maize seedlings

图5 菌株WY6-5对各种病原真菌的抑制作用Fig. 5 Inhibitory effect of strain WY6-5 against the growth of different fungal pathogens

图6 菌株WY6-5产挥发性气体物质的GC-MS/MS检测Fig. 6 Identification of volatiles from strain WY6-5 through GC-MS/MS
伯克霍尔德菌是一种重要的微生物资源,在土壤中分布广泛,对小麦、玉米、甘蔗、草莓等多种植物的生长有重要作用[35-38]。该菌株不仅可以通过固氮、溶磷和分泌植物激素等作用促进植物生长[39],同时还可产生硝吡咯菌素、吩嗪、cepaciamide A、cepabactin、cepacidine A等多种抑菌产物,抑制土传病害的侵染[40],部分物质已开发为生物农药,用于防治小麦纹枯病、番茄根结线虫病等多种田间病害[41-43]。但上述物质分子量大,分散速度慢,使用过程中,接触病原菌后方可发挥抑制作用,在一定程度上限制了其广泛应用。与其相比,小分子物质结构简单,易挥发,分散迅速,可远距离发挥作用,且不易产生残留,对不同分布条件下的病原菌均可抑制,不仅可以防治土壤病害,对于储藏期病害同样有效[26]。本研究首次证明,溶磷吡咯伯克霍尔德菌 WY6-5,可产生挥发性抑菌物质二甲基二硫,具有广谱抑菌作用,能高效抑制灰霉属、炭疽菌属、镰刀菌属、曲霉菌属等 8种病原真菌的生长,为潜在的高效抑菌生物制剂。且该物质生物安全性较好,在多种生物中均有发现,如芽孢杆菌、假单胞菌、沙雷氏菌等[44-46]微生物,以及白芥和韭葱[47-48]等植物中。该物质易于分散,具有较好的抑菌活性,可抑制根结线虫、立枯似核菌、大丽轮枝菌、尖孢镰刀菌等多种土传病害[49]。同时,该物质还具有诱导寄主植物抗性,促进植物生长等重要作用[44,50],为潜在的高活性多功能生物菌剂。
伯克霍尔德菌具有较好的生物活性,以其为原料制成的生物农药,在部分国家中已得到应用。但与此同时,该菌被认定为条件性致病菌,可引起人类和植物病害,一定程度上制约了其广泛应用。因此,笔者建议,在针对WY6-5及其同属菌的应用时,应特别谨慎,首先做到(1)生物安全性分析,分析其对不同生物的影响,严格采用对人类无毒菌株进行应用研究;(2)环境安全性评价,分析菌株不同剂量施用后对环境微生物群落、非靶标生物及生态的影响,确定其环境安全作用;(3)作用机制分析,鉴定功能活性物质,在无法确定菌株(1)与(2)中的安全性时,可尝试代谢物质应用研究,以及功能基因的克隆和转化工程菌株,利用的拮抗物质进行植物病害生防是国际上认同的观点。
4 结论
本研究创新性指出,吡咯伯克霍尔德菌WY6-5,可高效降解难溶性无机磷和有机磷,并提升液体和土壤中可溶性磷含量,促进植物生长;与此同时,该菌株可产生挥发性物质二甲基二硫,具有高效广谱的抑菌作用,以及潜在的促进植物生长活性,为抑菌性生物肥料的制备,提供潜在的生物活性材料。
致谢:感谢信阳师范学院“南湖学者奖励计划”青年项目,农业部华中作物有害生物综合治理重点实验室/农作物重大病虫草害防控湖北省重点实验室开放基金课题(2018ZTSJJ2),信阳师范学院分析测试中心对本项目的资助。

