转录因子CEBPα和p53在猪卵巢颗粒细胞中对Kiss1基因表达的调控
辛晓萍,王家迎,张爱玲,钟玉宜,何颖婷,陈赞谋,张哲,张豪,李加琪,袁晓龙
(1广东省农业动物基因组学与分子育种重点实验室/国家生猪种业工程技术研究中心/华南农业大学动物科学学院,广州 510642;2广东高校应用生态工程技术开发中心/广东第二师范学院生物与食品工程学院,广州 510310)
0 引言
【研究意义】Kiss1基因位于人类1号染色体1q32—41区[1],最早是在1996年由LEE等发现并命名[2]。目前,关于Kiss1基因的研究主要集中在哺乳动物中枢和神经内分泌系统的调节上[3]。有研究表明,Kiss1基因可以促进卵巢卵泡的发育和排卵[4],在卵泡生长发育的过程中扮演着重要角色[5],例如,在成年发情期的大鼠中,抑制 kisspeptin的表达导致卵巢卵泡的发育异常[6-7]。除此之外,外源性的kisspeptin可以影响小鼠卵巢卵泡的正常发育与排卵[6-7]。猪的Kiss1基因位于9号染色体上[8],包含2个外显子,蛋白质编码区长度为417 bp(含终止子),编码138个氨基酸[9],编码的多肽类激素是kisspeptin,经剪切后生成含有54个氨基酸的kisspeptin-54多肽,kisspeptin-54在体内可被分解为 kisspeptin-10,kisspeptin-13,kisspeptin-14,它们可以特异性结合在 G蛋白偶联受体 54(G Protein-Coupled Receptors 54,GPR54)上[10]。本研究以猪卵巢颗粒细胞为模型,通过构建p53和CEBPα的超表达载体和小干扰RNA,在mRNA和蛋白水平探索p53、CEBPα与Kiss1之间的表达调控关系,为探索Kiss1基因在卵巢颗粒细胞中的功能提供一定的理论基础。【前人研究进展】2008年,臧猛等克隆出了猪Kiss1基因全长,发现Kiss1基因在下丘脑、卵巢、垂体、心、肝等组织中都有不同水平的表达[9]。在小梅山猪卵巢组织中,刘萍等人发现 Kiss1基因主要分布于各级卵泡颗粒细胞和卵泡膜细胞上[11],同时,在人类、狨猴和大鼠的卵巢和颗粒细胞中都有检测到kisspeptin的表达。研究发现,Kiss1基因突变可以导致人类、大鼠和小鼠的卵泡数量减少,阻碍卵巢卵泡的生长发育[12-14]。这些结果表明,Kiss1基因影响着卵泡的生长发育。但是,目前Kiss1基因在猪卵泡中的表达调控机制仍不清楚。【本研究切入点】本课题组前期研究发现,Kiss1的上游区域存在p53和CEBPα的潜在结合位点,但是在猪卵巢颗粒细胞中,有关Kiss1、p53和CEBPα之间的表达调控关系尚不清楚。【拟解决的关键问题】研究转录因子p53和CEBPα在猪卵巢颗粒细胞中对Kiss1基因之间的表达调控作用。
1 材料与方法
本研究所有试验工作于2016年6月至2017年6月在广东省农业动物基因组学与分子育种重点实验室完成。
1.1 试验材料
动物组织与细胞:用于基因克隆的 DNA样品来源于中山白石猪场的长大二元杂母猪卵巢组织;猪卵巢颗粒细胞是取自广州嘉禾望岗屠宰场母猪卵巢组织的原代细胞。
主要试剂:DNA提取试剂盒购自OMEGA公司;总RNA提取试剂Trizol、PrimeScript®1st Strand cDNA Synthesis Kit、DL2000、DL500均购自 TaKaRa公司;Taq酶购自南京诺唯赞生物科技有限公司;Lipofectamine® 3000、Opti-MEM® 购自Invitrogen公司;凝胶回收试剂盒、普通质粒小提试剂盒、无内毒素质粒小提试剂盒购自广州欣研(美技)生物科技有限公司;胰蛋白酶、DMEM基础培养基、PBS缓冲液、胎牛血清、青链霉素(双抗)购自Hyclone公司;其他均为常规化学试剂。
1.2 母猪Kiss1基因上游区域潜在转录因子的预测
根据NCBI公布Kiss1基因的序列信息,参考基因转录起始上游850 bp到下游221 bp序列,通过以下4个在线软件预测其潜在转录因子结合位点,并取交集作为预测结果:
TFBIND:http://tfbind.hgc.jp/
Biobase:http://www.gene-regulation.com/pub/programs/alibaba2/index.html
Jaspar:http://jaspar.genereg.net/
Research:http://alggen.lsi.upc.es/cgi-bin/promo_v3/promo/promoinit.cgi?dirDB=TF_8.3
1.3 猪p53和CEBPα真核表达载体的构建
根据NCBI数据库转录因子p53和CEBPα的基因序列信息,以猪卵巢颗粒细胞mRNA反转录的cDNA为模板,分别以CDS-p53和CDS-CEBPα引物(表1)克隆其CDS区序列,长度分别为1 161 bp和1 227 bp,测序验证后连接到真核表达载体pcDNA3.1(+)上,分别命名为pcDNA3.1-p53和pcDNA3.1-CEBPα,用于转染颗粒细胞,酶切鉴定结果如图1。抽提无内毒素质粒,-20℃保存,用于下一步试验。PCR程序:94℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸 2.5 min,35个循环;72℃后延伸 10 min。
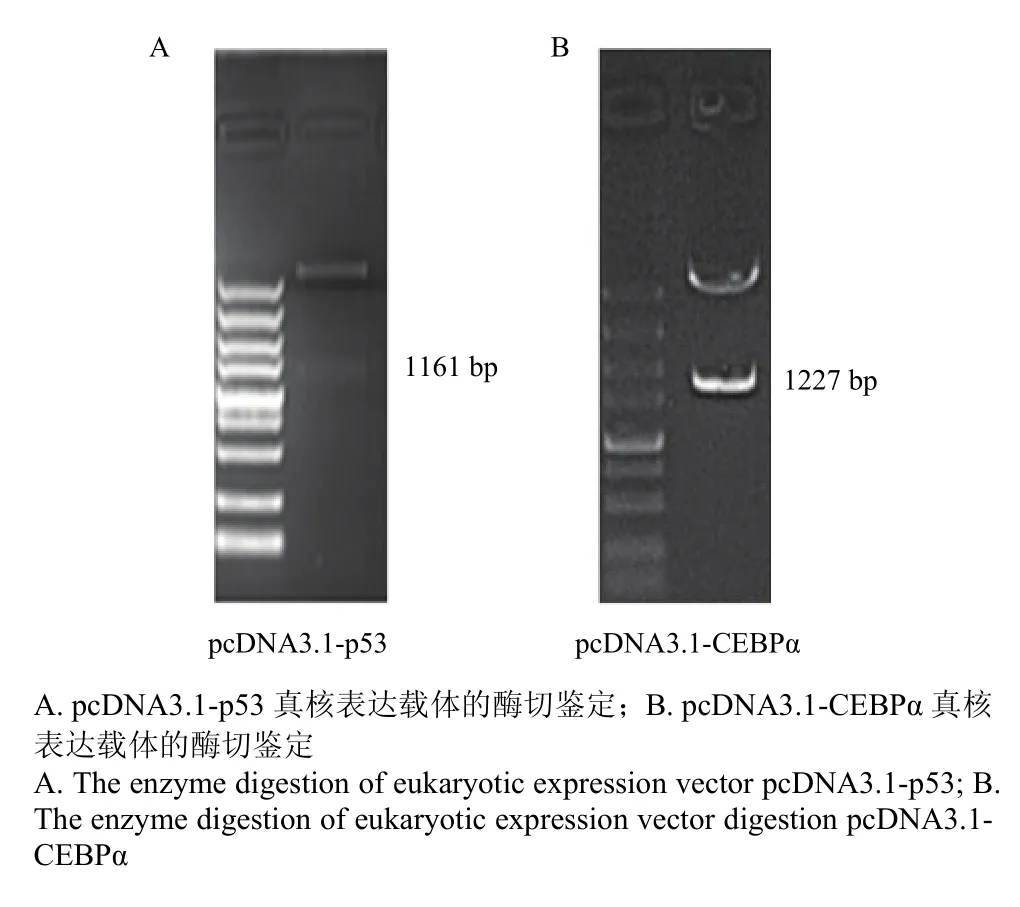
图1 p53和CEBPα真核表达载体的酶切鉴定Fig. 1 Identified the eukaryotic expression vector of p53 and CEBPα
1.4 猪卵巢颗粒细胞的分离与培养
参考文献[15]的方法分离与培养猪卵巢颗粒,主要步骤为:将屠宰场采集的母猪卵巢组织放入37℃的加入双抗的PBS中,用注射器快速吸取卵巢颗粒细胞;用预热的PBS重悬细胞,洗涤两次,转移到75 cm2的细胞培养瓶,放入CO2培养箱中培养;48 h之后,换液,继续培养,待细胞长至90%以上时,用胰酶消化,转移至24孔板、12孔板或6孔板,培养待用。
1.5 转录因子p53和CEBPα对Kiss1基因转录表达的影响
培养猪的卵巢颗粒细胞,24孔板分别转染 50、100、200和500 ng的pcDNA3.1空载和pcDNA3.1-p53,通过qRT-PCR确定p53的超表达效果。24孔板分别转染200 ng的pcDNA3.1-p53和pcDNA3.1至猪的卵巢颗粒细胞,qRT-PCR检测超表达转录因子p53后Kiss1基因的mRNA表达水平变化。6孔板分别转染200 ng的pcDNA3.1-p53和pcDNA3.1至猪的卵巢颗粒细胞,Western Blot检测转录因子p53对Kiss1基因蛋白表达水平的影响。
根据GenBank上猪p53已知序列,按siRNA序列设计原则,结合Ambion公司提供的网上在线设计工具,设计p53的siRNA引物,将siRNA序列进行BLAST比对,以确定和其它基因没有同源性。该siRNA由广州锐博公司合成,引物序列见表 1中p53-siRNA引物。培养猪的卵巢颗粒细胞,24孔板分别转染 50 nmol·L-1的 Scrambled 和 p53-siRNA,qRT-PCR检测转录因子p53的干扰效果。24孔板分别转染 50 nmol·L-1的 Scrambled 和 50 nmol·L-1的p53-siRNA至猪的卵巢颗粒细胞,qRT-PCR检测干扰p53后Kiss1基因的mRNA水平变化。6孔板分别转染 50 nmol·L-1的 Scrambled 和 50 nmol·L-1的p53-siRNA至猪的卵巢颗粒细胞,Western Blot检测干扰转录因子p53后对Kiss1基因蛋白表达水平的影响。
转录因子CEBPα的操作同转录因子p53。
1.6 ChIP检测p53和CEBPα在Kiss1基因上游区域的结合情况
使用转录因子p53和CEBPα的特异性抗体,通过染色质免疫共沉淀方式富集DNA;在潜在转录因子结合位点附近设计引物,产物范围为100—160 bp,引物序列见表1(ChIP-kiss1-p53和ChIP-kiss1-CEBPα)以富集的 DNA为模板进行扩增;具体操作为:在细胞培养瓶里加入37%甲醛使甲醛终浓度为1%,加10×甘氨酸中和未反应的甲醛,用预冷的PBS洗涤两遍,经超声裂解,染色体免疫沉淀,反向交联和 DNA纯化,定性PCR,PCR反应条件为:95℃ 3 s,然后 95℃ 10 s,60℃ 30 s,72℃,1 min,共40个循环,72℃ 5 min。

表1 引物序列Table 1 Primer sequences
1.7 瞬时转染
当细胞培养板内细胞密度为80%—90%时进行换液,换无双抗的培养基,随后进行瞬时转染,具体操作按照 Invitrogen公司提供的 Lipofectamine® 3000 Reagents说明书进行,转染6—8 h时更换有双抗的培养基,转染48 h后进行下一步试验。
1.8 qRT-PCR和Western Blot检测p53和CEBPα对Kiss1表达水平的影响
参照Invitrogen TRIzol操作说明书,提取母猪卵巢颗粒细胞的总RNA;总RNA的反转录和PCR参照TaKaRa公司的试剂盒说明书进行操作。根据每个基因的NCBI的GenBank登录号,设计定量PCR引物,引物序列如表1(qRT-p53和qRT-CEBPα)。RT-PCR的反应条件:94℃预变性5 min;94℃变性30 s;57℃退火30 s;72℃延伸15 s;经过45个循环后72℃延伸10 min。
具体操作参考文献[16],取培养好的母猪卵巢颗粒细胞,细胞按比例加入裂解液,用枪吹打数下,研磨器研磨使裂解液和细胞充分接触,充分裂解后,4℃高速离心机以12 000×g离心30 min,取上清,提取总蛋白后,立即测定蛋白浓度。取已定量蛋白,按1∶4的体积比加入5×protein loading buffer,沸水煮5 min,12 000×g离心3min,待用。上样(考马斯亮蓝G-250法总蛋白定量,上样量分别为80 μg总蛋白/个样品)、SDS-PAGE胶电泳、蛋白转膜、室温封闭1.5 h,抗体孵育,ECL显色,样品膜放置暗箱中曝光定影,基因的灰度值与GAPDH内参的灰度值比值代表基因蛋白的相对表达水平。
1.9 数据的统计分析
DNASTAR分析基因序列;primer5.0 设计 PCR引物;每个处理至少3个生物学重复,所有数据均用平均值±标准差表示,并经双尾 T-test 检验差异是否具有统计学意义。**代表P<0.01,*代表P<0.05。
2 结果
2.1 猪 Kiss1基因上游区域生物信息学预测以及与转录因子结合的鉴定
通过在线生物学软件分析猪 Kiss1基因的-850—+221 区域序列,发现该区域存在p53(肿瘤抑制蛋白,tumor protein p53,p53)、CCAAT增强子结合蛋白(CCAAT/enhancer binding protein, CEBP)、信号传导及转录活化家族Stat4(signal transducer and activator of transcription 4, Stat4)等转录因子的潜在结合位点,其中,在-744—-733处存在 CEBPα因子潜在结合位点,在-533—-523处存在的 p53潜在结合位点(图2-A)。

图2 猪Kiss1基因上游区域区结合潜在转录因子生物信息学预测以及转录因子结合猪Kiss1基因上游区域的ChIP鉴定Fig. 2 Bioinformatics prediction for the potential binding site of transcription factors in the upstream region of porcine Kiss1, and ChIP results of transcription factors binding to the upstream region of porcine Kiss1 gene
p53的潜在结合序列为AGGCACATTC,CEBPα的结合序列为 AATAAGACAAT。使用转录因子 p53和CEBPα的特异性抗体,免疫共沉淀方式富集DNA;在潜在转录因子结合位点附近设计引物,产物范围为100—160 bp,以富集的DNA为模板进行扩增,其结果见图2-B。引物ChIP-p53和ChIP-CEBPα扩增到了预期的DNA片段(图2-B中p53和图2-C中CEBPα泳道);阴性对照(IgG)则没有扩增到相应的DNA片段(图2-B和图2-C中IgG泳道);阳性对照则获得了预期大小的DNA片段(图2-B和图2-C中的Input和H3)。结果表明转录因子p53和CEBPα可通过相应的DNA作用元件与猪Kiss1基因上游区域结合,分别特异性的结合在Kiss1基因-533—-523和-744—-733上。
2.2 转录因子p53对Kiss1基因表达的影响
分别转染50、100、200和500 ng的pcDNA3.1-p53,发现随着转染质粒浓度的增加,p53的mRNA水平显著升高(P<0.01)(图3-A),说明p53的超表达载体具有转录活性,本研究选择200 ng的浓度用于后续实验。与对照组相比,超表达p53能显著降低Kiss1的mRNA水平(P<0.05)(图3-B)和蛋白水平(P<0.05)(图 3-C,D)。这些结果说明,超表达p53能降低Kiss1的mRNA和蛋白表达水平。

图3 超表达p53对Kiss1基因表达的影响Fig. 3 The effects of over-expressed p53 on the expression of Kiss1
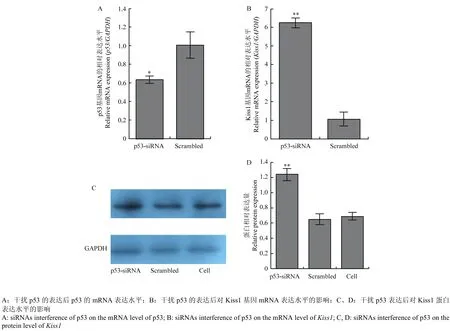
图4 干扰p53的表达后对Kiss1基因表达的影响Fig. 4 The effects of interfering p53 on the expression of Kiss1
按照使用说明,瞬时转染50 nM的p53-siRNA进颗粒细胞。通过qRT-PCR检测发现,转染p53-siRNA后,p53的mRNA水平显著低于Scrambled组(P<0.05)(图4-A),说明p53-siRNA能有效的干扰转录因子p53的表达。与Scrambled组相比,p53-siRNA能显著升高Kiss1的mRNA水平(P<0.01)(图4-B)和蛋白水平(P<0.01)(图 4-C,D),这些结果说明干扰转录因子p53的表达能上调Kiss1的mRNA和蛋白表达水平。
2.3 转录因子CEBPα对猪Kiss1基因表达的影响
分别转染50、100、200和500 ng的pcDNA3.1-CEBPα,发现随着转染质粒浓度的增加,CEBPα的mRNA水平显著升高(P<0.01)(图 5-A),说明CEBPα的超表达载体具有转录活性,本研究选择200 ng的浓度用于后续试验。与对照组相比,超表达CEBPα能显著降低Kiss1的mRNA水平(P<0.05)(图 5-B)和蛋白水平(P<0.01)(图 5-C,D),这些结果说明,超表达CEBPα能降低Kiss1的mRNA和蛋白表达水平。
按照使用说明,瞬时转染50 nmol·L-1的CEBPαsiRNA进颗粒细胞。通过 qRT-PCR检测发现,转染CEBPα-siRNA后,CEBPα基因的mRNA水平显著低于 Scrambled组(P<0.05)(图 6-A),说明CEBPα-siRNA 能有效的干扰转录因子 CEBPα的表达。与Scrambled组相比,CEBPα-siRNA能显著升高Kiss1的mRNA水平(P<0.01)(图6-B)和蛋白水平(P<0.05)(图6-C,D),这些结果说明干扰CEBPα的表达能上调Kiss1的mRNA和蛋白表达水平。
3 讨论

图5 超表达转录因子CEBPα对猪Kiss1基因表达的影响Fig. 5 The effects of over-expressed CEBPα on the expression of Kiss1
Kiss1基因的突变将导致大鼠[12]和小鼠[17]的卵巢功能衰退,引起卵泡发育异常,阻碍卵泡成熟。同时,Kiss1可以影响小鼠卵巢黄体组织的形成[7,18]。这些研究结果说明,在人和哺乳动物卵巢卵泡成熟的过程中,Kiss1基因可以促进卵巢卵泡的发育和排卵,但是目前关于Kiss1基因在猪卵泡中的表达机制尚不清楚。本研究主要以长大二元杂母猪的卵巢颗粒细胞为模型,扩增猪的Kiss1基因上游区域,通过转录因子预测网站预测其潜在结合的转录因子 p53和 CEBPα,通过ChIP鉴定p53和CEBPα结合到Kiss1基因上游区域相应的位置(图2),而且超表达转录因子p53和CEBPα后,Kiss1基因的mRNA和蛋白表达水平均显著下降(图3和图5),干扰转录因子p53和CEBPα后,Kiss1基因的mRNA和蛋白表达水平均显著上升(图4和图6),这些结果说明,转录因子p53和CEBPα结合在Kiss1基因的上游区域,抑制Kiss1基因的转录表达。
p53是一种抑癌基因,具有很多生物学作用,可以直接或间接通过调控靶基因,进而促进或抑制细胞生长、细胞增殖、血管生成和炎症反应等过程,此外,p53还具有活化DNA修复蛋白的作用[19-20]。p53可以调控其他靶基因发挥作用,例如p53可以下调PRR11-SKA2从而抑制肿瘤的生成[21],上调miR-34c家族基因抑制癌症的发生等[22]。研究表明,p53蛋白在人卵巢上皮癌组织中过表达[23],抑制p53基因的表达后,卵巢癌细胞的增殖数目显著减少,凋亡数目显著增加[24],此外,p53可以促进人颗粒细胞的凋亡[25],抑制猪卵巢颗粒细胞的增殖,激发凋亡标记物MAP3K5基因的表达,从而影响孕酮、雌激素等性激素的分泌[26]。CCAAT/增强子结合蛋白(CCAAT/enhancer-binding proteins,CEBPs)是一类可以与DNA增强子结合的转录因子家族,其由 CEBPα、CEBPβ、CEBPγ、CEBPδ、CEBPε和 CEBPζ六个成员组成[27],广泛参与到细胞增殖分化、细胞凋亡、胚胎发育、机体能量代谢和免疫反应等。

图6 干扰转录因子CEBPα对Kiss1基因的影响Fig. 6 The effects of interfering p53 on the expression of Kiss1
研究表明,CEBPα的表达对小鼠的排卵、黄体生成和卵巢卵泡关键基因的表达起着至关重要的调节作用[28]。此外,CEBPα影响大鼠卵巢卵泡的发育和排卵[29];上调CEBPα的表达能抑制合成FSH或者LH相关基因的表达,从而调控小鼠排卵及黄体形成[30]。这些研究说明,转录因子p53和CEBPα参与调控哺乳动物卵泡的成熟、颗粒细胞功能和黄体形成等繁殖活动,也佐证了Kiss1基因可能是影响母猪卵巢发育及成熟的重要候选基因。
4 结论
在猪卵巢颗粒细胞中,转录因子 p53和 CEBPα能结合到Kiss1基因-533—-523和-744—-733区域处,抑制其mRNA和蛋白的表达水平。此研究为Kiss1基因在猪卵巢颗粒细胞中表达调控在分子水平上提供理论依据。

